Dispensa di Scienze integrate
Docente : Prof.ssa Elena Angotti
ITE Polo di Cutro
Corso Serale Classe I A
Anno scolastico 2013-2014
I Modulo
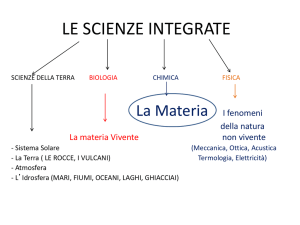
La composizione della materia
Possiamo definire materia tutto ciò che occupa uno spazio e possiede una massa( m).
La massa è la quantità di materia che costituisce un corpo. La massa ha come unità di misura il
chilogrammo . La misura delle masse si effettua per confronto con masse campione ,per mezzo
della bilancia a due piatti. La massa ha la caratteristica di rimanere costante in qualunque
luogo della Terra. Tutta la materia è formata da elementi , l’unità che non può essere separata in
costituenti più semplici. Sono elementi il cloro, il sodio, l’ossigeno, l’idrogeno. La Tavola
periodica degli elementi, ideata da Mendeleev, li riunisce tutti.
Definiamo composto una sostanza chimica che può essere scomposta in costituenti più semplici.
L’acqua è un composto separabile nei due elementi ossigeno e idrogeno.
La molecola può essere costituita da due elementi uguali o da due elementi diversi.
Esempi :la molecola dell’ossigeno è infatti costituita da due atomi uguali di ossigeno;
La molecola di biossido di carbonio unisce due atomi di ossigeno e un atomo di carbonio, due
elementi diversi.
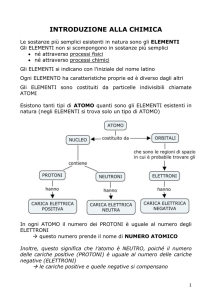
Gli ingredienti di base della materia sono gli atomi
L’atomo presenta una zona centrale , il nucleo , dove si concentrano protoni e neutroni; gli elettroni
sono distribuiti in una regione intorno al nucleo , dove sono in continuo movimento entro
determinati spazi denominati livelli, orbitali o strati.
Un atomo è generalmente neutro: il numero dei protoni è uguale al numero degli elettroni.
Se un atomo perde un elettrone si trasforma in ione positivo o catione; se acquista un elettrone
diventa ione negativo o anione.
L'ATOMO E LE MOLECOLE
L'ATOMO
L'atomo, la particella che come un mattone costituisce tutta la
materia, non è un corpicciolo semplice. Esso è a sua volta composto
da particelle elementari piccolissime: i protoni, i neutroni e gli
elettroni.
I PROTONI E I NEUTRONI
I protoni e i neutroni formano insieme quello che possiamo definire il
cuore dell'atomo: il nucleo. Queste due particelle hanno più o meno
la stessa massa, cioè sono formate da una quantità di materia quasi
uguale. Il protone, però, è diverso dal neutrone perché ha una
proprietà, chiamata carica elettrica positiva, che il neutrone non
possiede.
GLI ELETTRONI
Intorno al nucleo si muovono rapidissimamente altre particelle: gli elettroni. Essi hanno una massa così piccola che ne servono 1836 per
uguagliare la massa di un protone. Anche gli elettroni hanno una carica elettrica, ma essa è diversa da quella del protone: è una carica
elettrica negativa.
L'ATOMO NEUTRO
In un atomo in condizioni normali il numero degli elettroni è sempre
uguale a quello dei protoni: a un certo numero di cariche positive
corrisponde un ugual numero di cariche negative. L'atomo, dunque,
risulta neutro, né positivo né negativo.
ELIO - HE - Numero atomico 2
GLI ATOMI SONO TUTTI UGUALI TRA LORO?
Pur essendo tutti formati dalle stesse particelle, gli atomi non sono
tutti uguali tra loro: alcuni sono più piccoli, altri più grandi. La
piccolezza o la grandezza di un atomo dipende dal numero di protoni
del suo nucleo. L'atomo più piccolo ha il nucleo composto da un solo
protone; il più grande in natura possiede ben 92 protoni.
Questi atomi hanno un diverso numero atomico, termine che
indica quanti protoni sono presenti nel nucleo: il primo ha numero
atomico 1 perché ha un solo protone e il secondo ha numero atomico
92 perché ha 92 protoni.
GLI ATOMI HANNO UN NOME?
Il numero atomico permette di distinguere un atomo da un altro:
questo consente anche di dare un nome a ciascuno di essi. L'atomo
più piccolo, quello con un solo protone, è l'idrogeno; il più grande in
natura si chiama uranio e ha 92 protoni. L'atomo che possiede 7
protoni è quello dell'azoto, una sostanza presente nell'aria; l'atomo
con numero atomico 8, cioè con 8 protoni, è l'ossigeno, il gas che ci
permette di respirare. Imparerai il nome di molti altri atomi:
carbonio, rame, ferro, oro, argento, sodio, cloro...
Essi si definiscono elementi chimici.
AZOTO - N - Numero atomico 7
QUANDO GLI ATOMI SI UNISCONO: LA MOLECOLA
I SIMBOLI DEGLI ELEMENTI CHIMICI
Ogni elemento chimico, per brevità, è indicato con un simbolo, che
deriva dal nome dell'atomo. Ogni simbolo è formato dalla prima o
dalle prime due lettere del nome dell'atomo, per non creare
confusione tra atomi i cui nomi hanno la stessa iniziale. Per esempio il
simbolo del carbonio è C (si legge ci), quello del calcio è Ca (si
legge ci-a) e quello del cloro è CL (si legge ci-elle). Ci sono poi alcuni
elementi il cui simbolo è molto diverso da quello del loro nome.
Così il simbolo dell'oro è Au, perché è ricavato dal termine latino
aurum; quello del rame è Cu, perché gli antichi romani chiamavano il
rame cuprum.
Gli atomi hanno la capacità di unirsi tra loro formando le molecole. Ma che cos'è una molecola?
E la più piccola particella di una sostanza che ne conserva tutte le proprietà. Un esempio di molecola è la molecola dell'acqua. Se potessimo
spezzare questa particella, i suoi frammenti non sarebbero più acqua ma altre sostanze. La molecola dell'acqua è infatti costituita da tre
atomi: due atomi di idrogeno (H) e uno di ossigeno (0) legati tra loro. Così accade per tutte le sostanze. La molecola dell'ammoniaca, cioè la
più piccola quantità di materia che ha le caratteristiche di questa sostanza, per esempio, è formata da un atomo di azoto (N) e tre di
idrogeno (H) tra loro uniti; la molecola dell'ossigeno, il gas che respiriamo, è formata da due atomi di ossigeno (0) legati tra loro.
LE FORMULE CHIMICHE
Per indicare le molecole si usano segni convenzionali: si scrivono i simboli degli atomi che le costituiscono e in basso a destra di ogni simbolo
si indica un numero, che corrisponde al numero di atomi di quell'elemento presenti nella molecola stessa.
SOSTANZA
SIMBOLO
COME SI LEGGE
SIGNIFICATO
ANIDRIDE CARBONICA
C02
ci-o-due
1 atomo di carbonio e
due atomi di ossigrno
GLUCOSIO
C6H1206
ci-sei-acca-dodici-o-sei
6 atomi di carbonio
12 atomi di idrogeno
6 atomi di ossigeno
ACQUA
H2O
accacue-o
2 atomi di idrogeno
1 atomo di ossigeno
CLORURO DI SODIO
NaCl
enne-a-ci-elle
1 atomo di sodio
1 atomo di cloro
MOLECOLA DELL'ACQUA - H2O
MOLECOLA DELL'ANIDRIDE CARBONICA - C02
MOLECOLA DELL'AMMONIACA - NH3
MOLECOLA DEL GLUCOSIO - C6H12O6
ELEMENTI E COMPOSTI
Osservando gli atomi che compongono una molecola possiamo distinguere tutte le sostanze in due grandi gruppi:
1.
LE MOLECOLE NEGLI ELEMENTI: Gli elementi sono sostanze la cui molecola è costituita da atomi tutti uguali tra loro. L'ossigeno
che respiriamo, per esempio, è un elemento, perché la sua molecola è formata da due atomi di ossigeno. Anche il rame è un
elemento, perché è costituito da molecole formate ognuna da un atomo di rame.
OSSIGENO - O2
2.
RAME - Cu
LE MOLECOLE NEI COMPOSTI: I composti sono sostanze la cui molecola è costituita da atomi tra loro diversi. Il sale da cucina
(o cloruro di sodio), in cui sono presenti atomi di cloro e atomi di sodio, è appunto un composto, e così l'ammoniaca, nella quale
sono legati un atomo di azoto e atomi di idrogeno e il carbonato di cobalto, in cui ci sono atomi di cobalto, carbonio e ossigeno.
CLORURO DI SODIO - Cl
CARBONATO DI COBALTO - CoCO3
UN PO' DI STORIA
Fin dall'antichità l'uomo si è chiesto quali fossero gli elementi fondamentali che costituivano tutto il mondo naturale. Che cosa poteva
osservare se non il vento che soffiava, l'acqua che dava la vita, la terra che faceva germogliare le piante, li fuoco che bruciava... ? Ecco,
questi erano gli elementi comuni della natura: l'aria, l'acqua, la terra e il fuoco. A questa concezione oppose le proprie idee il filosofo greco
Democrito, il primo che 2500 anni fa introdusse il termine atomo.
Secondo Democrito tutto è formato da atomi, particelle piccolissime diverse solo per forma e grandezza. Essi si muovono e si combinano
dando origine a tutte le cose, anche all'anima dell'uomo! Ma la teoria atomica della natura trovò molti oppositori, tra cui il grande filosofo
Aristotele, che ritornò alla concezione basata sui quattro elementi. La grandezza dei pensiero di Aristotele fu tale che le sue idee non
vennero quasi mai contestate, anche quando erano evidentemente sbagliate. E fu così che di atomi non si parlò più per quasi 2000 anni.
La materia si trasforma
La materia subisce continue trasformazioni . Le trasformazioni sono trasformazioni fisiche se
riguardano la modificazione del suo stato fisico, che può essere solido, liquido o aeriforme.
Stato solido- Le particelle sono vicine le une alle altre I corpi solidi possiedono forma e volume
propri .
Stato liquido- Le particelle hanno possibilità di scorrere ; i legami lasciano le particelle libere
di scorrere. I liquidi hanno volume proprio e assumono la forma del recipiente che li contiene.
Stato aeriforme Le particelle si muovono liberamente e tendono ad occupare tutto il volume
che hanno a disposizione. Gli aeriformi non hanno forma propria né volume proprio.
IL CALORE E LA TEMPERATURA
IL CALORE E' ENERGIA
A volte, dopo aver fatto il bagno in piscina oppure al mare, ci stendiamo al sole per riscaldarci: in breve tempo il calore del Sole ci avrà
asciugato il costume da bagno e i capelli.
Anche il calore di un termosifone può asciugare rapidamente una salvietta di spugna bagnata appoggiata su di esso. Si può perciò
concludere che il calore, sia quello del Sole sia quello di un termosifone, può compiere un lavoro. In fisica la capacità di compiere un lavoro è
chiamata energia. Ecco perché possiamo dire che:
Il calore è una particolare forma di energia, chiamata energia termica, che può essere trasmessa da un corpo a un altro.
LA QUANTITA' DI CALORE
All'interno di ogni corpo è contenuta una certa quantità di calore, che può essere notevole oppure piccolissima. Essa non deve essere
confusa con la temperatura del corpo che, come vedrai più avanti, è una grandezza del tutto diversa dal calore.
La quantità. di calore posseduta da un corpo è la sua capacità di compiere un lavoro più o meno grande: maggiore è la
quantità di calore che un corpo possiede, maggiore è il lavoro che esso può compiere.
Questo concetto è piuttosto complesso, ma lo potrai capire attraverso un semplice esempio. Immagina una pentola piena di salsa di
pomodoro che sta cuocendo sul fornello. Se accidentalmente tutta la salsa si rovesciasse sulle tue mani finiresti all'ospedale con gravissime
ustioni; ma se solo qualche goccia raggiungesse la mano, i danni sarebbero senz'altro lievi. Come mai la stessa salsa, che "scotta" tutta allo
stesso modo, produce effetti così diversi a seconda che essa raggiunga il corpo in grande quantità o in minima quantità? Perché poche gocce
di salsa possiedono poco calore, cioè poca energia termica, che può produrre poco lavoro, mentre tutta la salsa ne contiene molto di più e
può compiere molto lavoro (in questo caso gravissime ustioni alle mani).
Una piccola quantità di acqua bollente riesce a sciogliere solo una modesta quantità di un cubetto ghiaccio, mentre una maggiore quantità di
acqua, anche se a temperatura ambiente, riesce a sciogliere tutto il cubetto di ghiaccio perché contiene una maggiore quantità di calore
La poca quantità di calore posseduta dalle gocce si può spiegare con semplicità: se si deve scaldare sul fornello poca salsa si consuma poca
energia termica (si scalda in un attimo!) e dunque le gocce hanno assorbito poca energia e possono fare poco lavoro. Viceversa per scaldare
tutta la salsa si deve somministrare una maggiore quantità di calore, perché essa è formata da tantissime gocce; la salsa avrà assorbito
perciò molta energia termica e potrà dunque compiere molto lavoro.
IL CALORE SI PROPAGA
il calore ha la capacità di propagarsi perché l'energia termica può essere trasmessa da un corpo che ne possiede di più a un altro che ne
possiede in minore quantità. Questa trasmissione può avvenire in modi diversi: per conduzione, per convezione, per irraggiamento.
LA CONDUZIONE
Se abbiamo le mani fredde e prendiamo in mano una tazza di tè bollente, in breve
esse si riscaldano: il calore si è trasmesso dalla tazza alle nostre mani.
Quando un corpo si riscalda per essere stato messo a contatto con uno più
caldo si ha conduzione di calore.
Il passaggio di energia avviene perché le molecole del corpo più caldo possiedono
un più intenso moto di agitazione termica e urtando quelle del corpo meno caldo
con cui vengono a contatto, trasmettono loro parte dell'energia posseduta. In tal
modo le molecole del corpo meno caldo assorbono il calore, che fa aumentare la
loro velocità di agitazione, fino a quando le molecole di entrambi i corpi hanno tutte
la stessa velocità di agitazione: si è raggiunto l'equilibrio termico.
IL FERRO DA STIRO TRASMETTE IL CALORE ALLA
STOFFA PER CONDUZIONE
LA CONVEZIONE
Se accostiamo le mani a un termosifone, senza toccarlo, dopo un po' esse si
scaldano: l'aria ha trasportato il calore del termosifone fino alle nostre mani.
Quando l'energia termica viene trasportata da un corpo a un altro
attraverso il movimento di un mezzo liquido oppure gassoso si ha
convezione di calore.
Le molecole dell'aria assorbono calore, e cioè energia termica, dal termosifone e,
poiché aumenta il loro moto di agitazione, tendono a occupare uno spazio sempre
maggiore. In questo modo l'aria si dilata e diventa più leggera. Essa allora sale verso
l'alto, mentre l'aria in alto, più fredda, scende verso il basso e va a occupare lo
spazio lasciato libero. L'aria scesa dall'alto si riscalderà a sua volta e salirà,
richiamando altra aria. Pertanto all'interno della stanza l'aria si muove con
movimenti circolari, che prendono il nome di moti convettivi. Gli stessi moti
convettivi si possono osservare all'interno di un liquido, posto per esempio a
riscaldare su un fornello.
L'ARIA DI UNA STANZA SCALDATA PER
CONVEZIONE DA UN TERMOSIFONE SI MUOVE
GENERANDO MOTI CONVETTIVI
L'IRRAGGIAMENTO
Il calore può trasmettersi da un corpo all'altro non solo senza contatto diretto ma
anche se non vi è tra i due un mezzo liquido o gassoso. Si parla in questo caso di
irraggiamento.
Quando il calore si trasmette attraverso il vuoto si ha irraggiamento.
All'interno delle lampadine a incandescenza, per esempio, è stato ricavato il vuoto e
il calore del filamento si trasmette attraverso il vuoto e il vetro del bulbo,
scaldandolo. Anche il Sole riscalda per irraggiamento la superficie terrestre, in
quanto l'energia termica attraversa il vuoto interplanetario.
IL CALORE GIUNGE ALLA MANO PER
IRRAGGIAMENTO ATTRAVERSO IL VUOTO
IL CALORE E LA TEMPERATURA
LA TEMPERATURA
Nel linguaggio comune le parole calore e temperatura vengono spesso scambiate tra loro o sono utilizzate come se indicassero la stessa
cosa. In realtà esse rappresentano due concetti diversi.
Un semplice esempio ti permetterà di capire la fondamentale differenza tra queste due grandezze.
Immaginiamo di avere due recipienti perfettamente uguali, ma riempiti in modo diverso; uno con pochissima acqua, l'altro, invece, pieno fin
quasi all'orlo. Se li esponiamo al Sole in una calda giornata estiva e ne misuramo la temperatura dopo un certo tempo, osserviamo che la
temperatura della poca acqua del primo recipiente è molto più elevata di quella del secondo. Come si spiega questo fenomeno?
CALORE ASSORBITO E MOTO DI AGITAZIONE DELLE MOLECOLE
Il calore del Sole è stato fornito ai due recipienti in modo uguale e ha compiuto un lavoro: ha determinato un aumento del moto di agitazione
termica delle molecole dell'acqua. Ma nel recipiente con una maggiore quantità d'acqua ci sono più molecole che nel recipiente semivuoto.
Così ogni molecola del recipiente con più acqua ha avuto a disposizione minore energia di quella che ha potuto utilizzare ogni molecola del
recipiente con meno acqua.
La stessa quantità di energia termica fornita dal Sole si è "distribuita" in modo diverso nei due recipienti. Dove c'è meno acqua le molecole
hanno acquisito un moto di agitazione termica maggiore delle molecole del recipiente con più acqua: ognuna di esse, infatti, ha assorbito
maggior energia.
Si dice pertanto che:
La temperatura di un corpo è la misura del livello di agitazione termica posseduto dalle sue molecole.
Ecco allora perché la temperatura dell'acqua nel recipiente semivuoto è maggiore della temperatura dell'acqua del recipiente pieno.
IL TERMOMETRO
Lo strumento che ci permette di rilevare il livello di agitazione delle molecole di un corpo, e dunque la sua temperatura, è il termometro. Ci
sono molti tipi di termometri, per esempio quelli per rilevare la temperatura del nostro corpo, quelli per misurare la temperatura dell'aria o
quelli da laboratorio. Tutti comunque si basano sullo stesso principio: la DILATAZIONE TERMICA, che avviene nei liquidi e nei gas quando
vengono riscaldati. Un termometro è costituito da un'ampolla di vetro, il bulbo, che continua con un sottile capillare nel quale è stato fatto il
vuoto. Nel bulbo è contenuto mercurio, o un altro liquido colorato. Quando il liquido si riscalda, il moto di agitazione delle molecole aumenta
e fa sì che esse si allontanino fra loro. Di conseguenza il liquido si dilata e risale nel capillare, al quale è associata una scala graduata che
permette di leggere la temperatura semplicemente osservando il livello raggiunto dal liquido.
IL CALORE SPECIFICO
Non tutte le sostanze sottoposte al medesimo riscaldamento aumentano la loro temperatura allo stesso modo. Se forniamo per lo stesso
tempo la medesima energia termica a due quantità uguali di acqua e di sabbia, che inizialmente si trovavano alla stessa temperatura,
vedremo che la temperatura raggiunta dalla sabbia sarà più elevata di quella raggiunta dall'acqua. Ciò dipende dal fatto che nelle diverse
sostanze le molecole non hanno la stessa tendenza ad aumentare la loro velocità di agitazione: le sostanze hanno ciascuna un proprio
calore specifico. Più precisamente:
Il calore specifico è la quantità di calore necessaria per aumentare di 1 °C la temperatura di 1 g di quella sostanza.
IL CALORE E LA TEMPERATURA
LE UNITA' DI MISURA DEL CALORE E DELLA TEMPERATURA
Come ogni grandezza fisica, anche il calore e la temperatura hanno la
loro unità di misura.
IL GRADO CENTIGRADO
Mettendo un termometro a mercurio a contatto con il ghiaccio
fondente, alla PRESSIONE ATMOSFERICA che si ha a livello del
mare, si osserva che dopo un po' di tempo il livello del mercurio si
stabilizza in un certo punto. In corrispondenza di esso si segna, per
convenzione, il valore zero (0). Se successivamente si mette il
termometro a contatto con i vapori dell'acqua pura bollente, il livello
del mercurio sale rapidamente e si stabilizza in un altro punto, al quale
viene dato il valore cento (100). La differenza tra i due livelli viene
divisa in cento parti uguali, a ognuna delle quali viene dato il nome di
grado centigrado (simbolo °C).
Il grado è l'unità di misura della temperatura.
LA CALORIA
Utilizzando il termometro si determina anche l'unità di misura del
calore, la caloria (simbolo cal). Essa si definisce in questo modo:
1 caloria è la quantità di calore necessaria ad aumentare di 1
°C (da 14,5 °C a 15,5 °C ) la temperat. di 1 g di acqua pura.
IL CALORE E LA TEMPERATURA
SCALE TERMOMETRICHE
Le temperature del ghiaccio fondente e dell'acqua bollente furono utilizzate da Renato Renaldini nel 1694 come punti di riferimento per
graduare i termometri. Ma la divisione della scala in 100 parti fu proposta nel 1742 da Anders Celsius e da allora essa prende il nome di
scala centigrada o Celsius. Questa tuttavia non è l'unica scala di riferimento usata per la misura della temperatura: si utilizzano anche la
scala Réaumur (unità di misura grado Réaumur, simbolo °R), quella Fahrenheit (unità di misura grado Fahrenheit, simbolo F) e quella
Kelvin (unità di misura grado Kelvin, simbolo K), ognuna delle quali prende il nome dallo scienziato che l'ha ideata.
Nella scala Réaumur la temperatura di fusione del ghiaccio corrisponde allo 0, mentre quella di ebollizione dell'acqua è 80. L'intervallo è
dunque diviso in 80 parti e la scala prende anche il nome di scala ottantigrada.
La scala Fahrenheit è usata nei paesi anglosassoni e risulta divisa in 180 parti. AI ghiaccio fondente viene dato il valore 32 F, all'acqua
bollente corrispondono 212 F.
La scala Kelvin è l'unità di misura utilizzata nel SISTEMA
INTERNAZIONALE non fa riferimento a fenomeni di ebollizione o
solidificazione dell'acqua: il punto 0, detto zero assoluto, corrisponde
alla temperatura di un corpo le cui molecole siano assolutamente
immobili, prive cioè della pur minima vibrazione intorno a un punto. In
realtà nessun corpo può avere la temperatura di 0 K, in quanto in tutti
i corpi le molecole hanno sempre una vibrazione, seppur minima. In
questa scala lo zero assoluto corrisponde a -273 °C.
Le Scienze della Terra: generalità.
L’unicità del nostro pianeta
La Terra è il terzo di otto pianeti che orbitano, a distanze crescenti intorno al Sole, una fra circa 200
miliardi di stelle che popolano la Via Lattea. Come gli altri pianeti anche la Terra ebbe origine dal
materiale costituito da polvere e gas.
Che cos’ha di speciale il nostro pianeta per essere, a quanto finora risulta, il solo dove si è
sviluppata la vita?
Possiamo indicare una serie di fatti che testimoniano dell’unicità del nostro pianeta.
La Terra si distingue da tutti gli altri perché possiede una temperatura moderata che rende possibile
la presenza di grandi quantità di acqua allo stato liquido, la sostanza che è indispensabile per fare da
culla allo sviluppo della vita. Questa condizione dipende a sua volta da un altro fattore chiave: la
posizione della Terra rispetto al Sole.
La Terra dista dal Sole circa 150 milioni di chilometri : se il nostro pianeta fosse stato più vicino o
più lontano dalla stella Sole, nel primo caso sarebbe risultato troppo caldo, nel secondo caso molto
freddo. L’acqua sarebbe esistita sotto forma di vapore o in forma solida.
L’energia solare alimenta i processi biologici che garantiscono la continuità del mondo vivente .
Seguendo le vicende di una molecola d’acqua, possiamo compiere una ricognizione ideale che ci
permette di cogliere lo scambio di materiali tra le componenti del nostro pianeta: biosfera,
atmosfera, idrosfera e litosfera.
Pensiamo ad una molecola d’acqua immersa nella massa liquida del mare, l’idrosfera. Prima o poi,
a causa del riscaldamento solare, finirà per evaporare andando a far parte dell’atmosfera. Potrà,
magari dopo molto tempo, cadere al suolo, dissolvere o asportare frammenti di rocce (litosfera) e
andare infine in un fiume o in un lago, per concludere il suo viaggio in mare.
Ritornerà così a far parte dell’idrosfera.
La stessa molecola d’acqua potrebbe seguire un’altra strada: dopo essere caduta a terra, potrebbe
finire in un canale di irrigazione e da lì sul terreno di un campo coltivato. La radichetta di una
pianta potrebbe assorbire la molecola che verrebbe così incorporata nella cellula di una foglia ,
entrando a far parte della biosfera. Alla morte della foglia la molecola dell’acqua ritorna libera
nell’atmosfera , pronta a compiere un lungo viaggio in seno alla superficie terrestre, perché sospinta
dal vento. Lo stesso accade per la maggior parte degli atomi , protagonisti dei cicli biogeochimici.
L’energia del Sole: come si genera.
L’energia del Sole,come quella delle altre stelle, scaturisce da reazioni termonucleari. Si tratta di
processi in cui l’idrogeno , presente allo stato di plasma, si trasforma in elio. Questo processo è
causato dall’elevatissimo calore. Il Sole produce energia secondo questo meccanismo da circa 5
miliardi di anni;quando tale combustibile sarà esaurito, la nostra stella si estinguerà. Ciò avverrà tra
circa altri 5 miliardi di anni.
Meccanismo della fotosintesi
Energia solare
Acqua
Biossido di carbonio
Vegetali
Glucosio-Molecola ricca di energia
Ossigeno
Organismi e ambiente
Possiamo osservare e in microecosistemi(uno stagno, un lago) e in grandi ecosistemi (la foresta, la
prateria, l’oceano) , una struttura comune:
Una componente non vivente , terreno, acqua, elementi minerali, temperatura;
Una componente vivente , detta biocenòsi( dal greco bios= vita e koinòsis=unione), rappresenta gli
organismi viventi che interagiscono tra loro e con l’ambiente.
All’interno della biocenosi individuiamo tre ruoli principali svolti da categorie diverse di organismi:
I produttori;
I consumatori;
I decompositori.
Produttori
Sono i vegetali gli organismi in grado di fabbricare il cibo , cioè di costruire molecole complesse
ricche di energia, a partire da molecole semplici e povere di energia quali acqua e anidride
carbonica.
Gli organismi vegetali riescono a trasformare l’energia solare in energia chimica intrappolandola
nel glucosio, prodotto nel corso della fotosintesi clorofilliana insieme all’ossigeno.
Le molecole nutrienti più complesse, indispensabili alla sopravvivenza dei vegetali stessi ma anche
a quella degli altri organismi, si costruiscono a partire dagli organismi autotrofi(dal greco autòs =da
sé e trofè=nutrimento)
Sono autotrofi le piante terrestri e le alghe acquatiche che popolano i biomi acquatici.
Energia solare
Acqua
Biossido di carbonio
Vegetali
Glucosio-Molecola ricca di energia
Ossigeno
Consumatori
Sono organismi eterotrofi( dal greco èteros = (da altri) e trofè = nutrimento)
Si vedono costretti a consumare le sostanze nutrienti fabbricate dai produttori. Sono tipici
consumatori gli animali. Gli animali per estrarre l’energia contenute nelle sostanze prodotte dagli
organismi autotrofi, devono spezzarle . Il processo di smantellamento delle molecole nutrienti
viene chiamato respirazione cellulare . La respirazione cellulare, effettuata pure dai vegetali, porta
alla liberazione di energia chimica , indispensabile per funzioni vitali come il movimento, la
riproduzione, la risposta agli stimoli, nonché alla formazione di acqua e biossido di carbonio, come
prodotti di scarto(fotosintesi).
Glucosio
Sostanza ricca di energia
Ossigeno
Energia chimica
Animali
Acqua
Biossido di carbonio
Decompositori
I decompositori dipendono dalle sostanze nutritive elaborate dai produttori per le proprie esigenze
energetiche . Sono eterotrofi come i consumatori. Si tratta di organismi semplici, batteri e funghi,
presenti nel suolo e in grado di svolgere un ruolo sostanziale all’interno dell’ecosistema .
Attaccano la sostanza in decomposizione e di origine animale e di origine vegetale, riducendola a
composti semplici di nuovo utilizzabili per i produttori.
Questo è il processo continuo e lento di decomposizione della materia vivente e viene definito
mineralizzazione
I processi di organicazione e di mineralizzazione si sostengono a vicenda in quanto ciascuno di essi
ha bisogno dei prodotti elaborati dall’altro
All’interno dell’ecosistema viene garantita la circolazione della materia, ciclicamente riutilizzata .
Organicazione
Tra materia ed energia : i corpi celesti.
I principali ammassi di materia distinguibili nell’Universo sono:
le stelle, formate da gas che emettono luce derivante dall’enorme energia che si sviluppa grazie alla
fusione nucleare, attraverso la quale l’idrogeno si trasforma in elio. Durante la reazione nucleare la
materia diventa energia;
i pianeti sono ammassi di materia allo stato solido, liquido e gassoso. Al loro interno non vi sono
condizioni di temperatura e di pressione tali da innescare processi fusione nucleari.
Le stelle e i pianeti sono raggruppati in sistemi detti galassie. La nostra galassia è la Via Lattea.
Bibliografia
Aldo Rullini
Corso di Scienze della Terra
Atlas Editore
Elena Porzio
Scienze della Terra
Markes ED.