INTRODUZIONE ALLA CHIMICA
Le sostanze più semplici esistenti in natura sono gli ELEMENTI
Gli ELEMENTI non si scompongono in sostanze più semplici
né attraverso processi fisici
né attraverso processi chimici
Gli ELEMENTI si indicano con l’iniziale del nome latino
Ogni ELEMENTO ha caratteristiche proprie ed è diverso dagli altri
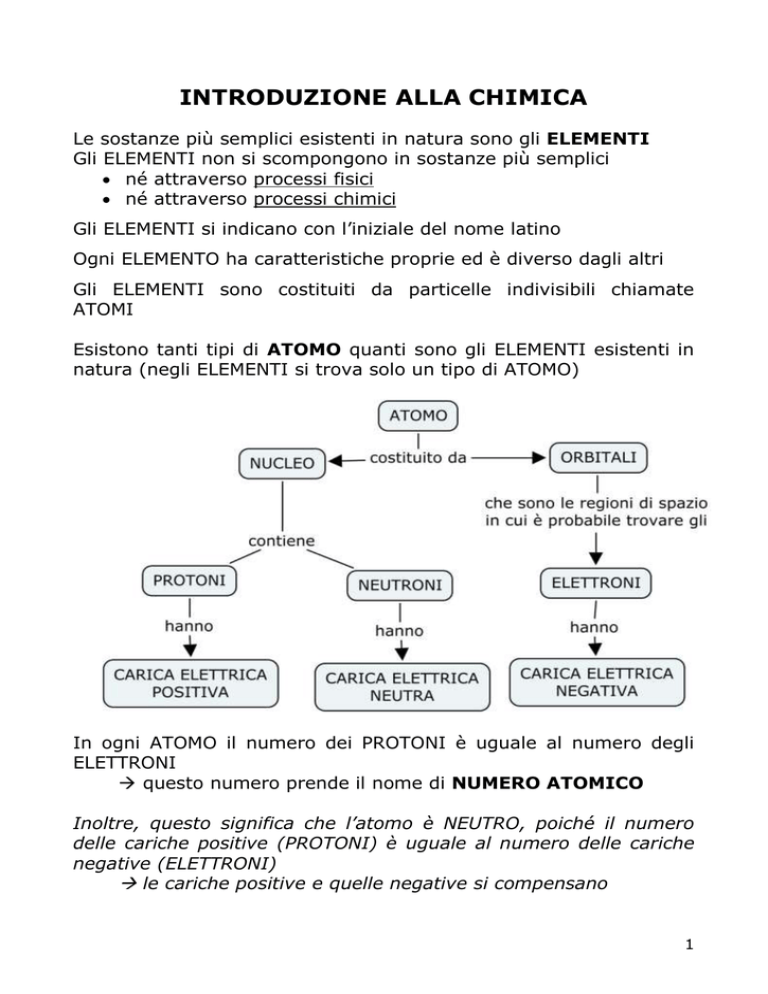
Gli ELEMENTI sono costituiti da particelle indivisibili chiamate
ATOMI
Esistono tanti tipi di ATOMO quanti sono gli ELEMENTI esistenti in
natura (negli ELEMENTI si trova solo un tipo di ATOMO)
In ogni ATOMO il numero dei PROTONI è uguale al numero degli
ELETTRONI
questo numero prende il nome di NUMERO ATOMICO
Inoltre, questo significa che l’atomo è NEUTRO, poiché il numero
delle cariche positive (PROTONI) è uguale al numero delle cariche
negative (ELETTRONI)
le cariche positive e quelle negative si compensano
1
Per ogni atomo esiste anche il NUMERO DI MASSA che
corrisponde alla somma dei PROTONI e dei NEUTRONI presenti nel
nucleo
ESEMPIO
_______NUMERO_ DI _ MASSA
O816________
NUMERO_ ATOMICO
O è il simbolo dell’ossigeno
8 è in numero di PROTONI, ma anche il numero di ELETTRONI
16 è la somma tra PROTONI e NEUTRONI presenti nel nucleo
Allora, come si calcola il numero di NEUTRONI?
NUMERO DI MASSA – NUMERO ATOMICO =
(protoni + neutroni) – (numero di protoni)= (numero di neutroni)
16 – 8 = 8
8 è il numero dei neutroni
Gli ATOMI si possono unire a formare le MOLECOLE
Una MOLECOLA è il più piccolo aggregato di ATOMI che caratterizza
una SOSTANZA
Negli ELEMENTI le MOLECOLE sono formate da ATOMI uguali
(della stessa specie)
Nei COMPOSTI le MOLECOLE sono formate da ATOMI diversi
(di specie diverse)
ESEMPIO 1
Cosa significa la scrittura 7O2 ?
Si tratta di 7 molecole di ossigeno, ciascuna delle quali è costituita
da 2 atomi di ossigeno (O)
Quanti atomi di ossigeno (O) ci saranno in totale? 7 x 2 = 14
ESEMPIO 2
Cosa significa la scrittura 3H2O ?
Si tratta di 3 molecole d’acqua, ciascuna delle quali è costituita da 2
atomi di idrogeno (H) e un atomo di ossigeno (O)
Quanti atomi di idrogeno (H) ci saranno in totale? 3 x 2 = 6
Quanti atomi di ossigeno (O) ci saranno in totale? 3 x 1 = 3
2
Gli ELEMENTI sono le sostanze di cui è formato un COMPOSTO
(cioè un COMPOSTO si può dividere in ELEMENTI, mentre gli
ELEMENTI non si possono ulteriormente decomporre)
Per decomporre un COMPOSTO negli ELEMENTI che lo
costituiscono, sono necessari procedimenti di tipo chimico (quelli di
tipo fisico non sono sufficienti)
LEGGI FONDAMENTALI DELLA CHIMICA
1. In una reazione chimica, la somma dei pesi delle sostanze che
reagiscono è sempre uguale alla somma dei pesi delle
sostanze che si formano
2. Gli elementi non si combinano a caso, ma secondo quantità
definite, seguendo delle precise proporzioni
ESEMPIO
35g di ferro (Fe) + 20g di zolfo (S) 55g di solfuro di ferro (FeS)
1) 35g + 20g = 55g
3
2) Se invece di 35g di ferro, si utilizzano 36 g, 1g di ferro non
reagirà: se aumenta la quantità di ferro deve aumentare anche
quella dello zolfo (secondo una precisa proporzione).
Così
70g di Fe + 40g di S 110g di FeS
MISCUGLI – Combinazioni di sostanze diverse che conservano le
loro proprietà e sono facilmente separabili con processi di tipo fisico
SOLUZIONI – Particolari MISCUGLI in cui le particelle delle sostanze
che vengono combinate, non sono più distinguibili (neanche al
microscopio)
Una SOLUZIONE è costituita da SOLVENTE e SOLUTO (il SOLUTO si
discioglie nel SOLVENTE).
Si chiama CONCENTRAZIONE di una SOLUZIONE, la quantità di
SOLUTO (in grammi) disciolta in 100g di SOLUZIONE
Una SOLUZIONE si dice SATURA quando, ad una certa temperatura,
contiene disciolta la massima quantità possibile di SOLUTO
(se si continua ad aggiungere SOLUTO, esso non si discioglie e
precipita sul fondo
prende così il nome di RESIDUO DI FONDO)
Tuttavia, aumentando la temperatura di una soluzione essa può
disciogliere una quantità maggiore di SOLUTO
4












