Epidemiologia e Profilassi dell'epatite B.
Evangelista Sagnelli, Nicola Coppola
Divisione di Malattie Infettive, A.O. San Sebastiano, Caserta
Dipartimento di Medicina Pubblica, Sezione di Malattie Infettive, Seconda Università di Napoli
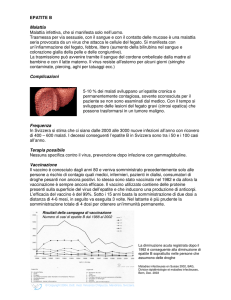
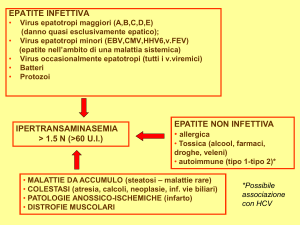
Le malattie croniche del fegato rappresentano da decenni uno dei più importanti problemi di sanità
pubblica. Con l’identificazione in tempi successivi del virus dell’epatite B (HBV), del virus dell’epatite
Delta (HDV) e del virus dell’epatite C (HCV) è apparso evidente che la maggior parte delle epatiti
croniche ha eziologia virale, e che vi sono differenze epidemiologiche, anche importanti, tra le diverse aree
geografiche. Ad esempio è noto che la cirrosi epatica, patologia a prevalente eziologia virale, è malattia
ampiamente diffusa in tutto il mondo, con tasso di letalità di 9,2 per 100.000 negli Stati Uniti e di 20,8 per
100.000 abitanti in Italia; in entrambi i paesi questa malattia costituisce la nona causa di morte (1-5).
Epidemiologia dell’infezione cronica da HBV
La diffusione mondiale dell' HBV è notevole, dal momento che sono stati stimati circa 300.000.000
portatori cronici di HBsAg, con differente livello di endemicità nelle varie aree geografiche: sono state
infatti distinte zone a bassa endemia (<2%), quali il Nord America e Europa centro-settentrionale, zone ad
endemia moderata (2-7%), quali i paesi del Bacino del Mediterraneo, e zone ad endemia elevata (≥ 8%),
come l’Africa ed il Sud-Est Asiatico (6). La prevalenza di portatori cronici di HBsAg è molto elevata in
alcune comunità isolate, come quelle eschimesi dell' Alaska ed aborigene dell' Australia, con prevalenza
nella popolazione generale anche superiori al 40% (7).
L' epatite acuta da HBV è più frequentemente sintomatica nell’adulto che nei bambini, nei quali
spesso la fase di citolisi acuta passa inosservata (8). La cronicizzazione si verifica con frequenza variabile
in relazione all’età dei pazienti: 90% nei neonati, 20-40% nei bambini e 3-5% negli adulti (8); nelle aree ad
endemia elevata l’infezione si verifica frequentemente in età infantile, e quindi con frequente
cronicizzazione, mentre nelle aree a bassa endemia si verifica più frequentemente in età adulta, quando la
cronicizzazione è rara. In Italia l’epatite acuta da HBV, data la diffusione dell’uso della vaccinazione
specifica, coinvolge quasi esclusivamente i soggetti giovani adulti.
L’infezione da HBV è trasmessa per via parenterale, sia apparente (trasfusioni di sangue ed emoderivati,
punture accidentali, interventi chirurgici ed odontoiatrici, scambio di siringhe tra tossicodipendenti,
tatuaggi, etc.) che inapparente (uso promiscuo di oggetti potenzialmente contaminati), per via maternofetale e per via sessuale (omo od eterosessuale).
La trasmissione di ' HBV medianteemoderivati è purtroppo ancora una realtà nei paesi che non effettuano
uno screening scrupoloso dei donatori. Per quanto concerne la trasmissione verticale, l' infezione si
trasmette esclusivamente durante il parto o nei contatti madre-figlio immediatamente successivi alla
nascita ed è più frequente quando la madre presenta un' infezione acuta nel terzo trimestre di gravidanza; si
registra una più elevata frequenza quando la madre presenta positività per HBeAg e/o per HBV-DNA nel
siero (9). Lo screening sierologico delle donne in gravidanza, la pratica della profilassi passivo-attiva nei
nati da quelle HBsAg positive e lo screening dei donatori di sangue, hanno notevolmente ridotto
rispettivamente il numero di casi a trasmissione verticale e post-trasfusionale.
La diffusione dell’infezione per via parenterale “ inapparente” è legata all’uso di strumentario medicale non
sterile, di oggetti acuminati e taglienti per praticare incisioni dei lobi auricolari o tatuaggi, nonchè di oggetti
condivisi nella pratica della tossicodipendenza. La trasmissione intrafamiliare mediante l' uso comune di
spazzolini, rasoi, forbici, pettini, etc, è frequente nelle aree iperendemiche, con precarie condizioni
igienico-sanitarie, in famiglie numerose e nell' età infantile (10). In genere nel personale sanitario la
prevalenza di portatori cronici di HBsAg è superiore a quella della popolazione generale, soprattutto per il
personale delle unità di dialisi, per i dentisti e per i chirurghi; la trasmissione si realizza più frequentemente
tramite punture o durante interventi chirurgici; la diffusione dell’infezione da chirurgo a paziente è invece
rara e si realizza solo in corso di interventi molto invasivi (11).
L' attività eterosessuale e ancor più quella omosessuale è un’importante via di trasmissione. Uno studio
multicentrico condotto negli Stati Uniti ha evidenziato che il 61% di 3816 omosessuali maschi presentava
markers di infezione pregressa o in atto da HBV (6% HBsAg, 52% HBsAb e 3% HBcAb) e che
l' infezione correlava con la durata dell' omosessualità e con il numero di contatti sessuali (12); la
percentuale di HBsAg e di HBsAb nella popolazione generale degli U.S.A. può essere stimata
rispettivamente intorno allo 0,3 % e al 5% (13).
La trasmissione perinatale dell’infezione da HBV in Italia non è particolarmente frequente, data la ridotta
prevalenza di donne HBsAg positive tra quelle in età fertile e di quelle HBeAg positive tra le portatrici
croniche di HBsAg. In passato invece, in condizioni epidemiologiche diverse, questa via di trasmissione è
stata più frequentemente operante. Di conseguenza è la trasmissione orizzontale, spesso intrafamiliare, a
giocare ancora un ruolo importante nelle infezioni dell’età infantile (5).
2
Un recente studio caso-controllo ha evidenziato che attualmente sono fattori di rischio indipendenti per
l’acquisizione dell’infezione da HBV la tossicodipendenza, la convivenza con portatori di HBsAg e gli
interventi chirurgici (14).
L’epidemiologia dell’infezione cronica da HBV è stata più estesamente studiata a partire dagli
anni 80 in Italia e Grecia (15-17). Questi paesi presentavano una prevalenza di portatori di HBsAg
superiore al 3%, e quindi più elevata di quella osservata nelle altre nazioni europee (~ 1%). In Italia la
distribuzione geografica dei casi non era però uniforme, e la prevalenza di portatori di HBsAg era
maggiore al Sud (5%) che non al Nord (< 3%) (15). Furono inoltre identificate aree geografiche di
iperendemicità sia al Nord che al Sud (Bergamo alto, Lodi alto, area metropolitana di Napoli, Afragola,
etc.) nelle quali la prevalenza di portatori di HBsAg era molto più elevata, anche superiore al 10% (18).
Dalla metà degli anni ‘80 si è verificata in alcuni paesi del bacino Mediterraneo quali Italia e
Grecia una riduzione dell’incidenza di epatiti da HBV, sia acute che croniche. Tale riduzione può
essere messa in relazione alle migliorate condizioni socio-sanitarie, alla riduzione del numero dei
componenti i nuclei familiari, ai mutati comportamenti di tossicodipendenti e omosessuali legati alle
campagne di prevenzione effettuate contro l' infezione da HIV e alla diffusione della vaccinazione
contro HBV. In Grecia uno studio condotto su reclute ha evidenziato una riduzione della percentuale
di portatori di HBsAg dal 3.9% allo 0.9% tra il 1973 ed il 1986 (19). In Italia l’incidenza di epatiti
acute da HBV si è ridotta da 12/100.000 abitanti del 1985 a 2/100.000 abitanti negli ultimi tempi
(SEIEVA). La prevalenza di portatori di HBsAg tra giovani adulti (donatori, reclute e donne
gravide) è passata dal 2.5-3.4% all’1.2-2% (20, 21). Questi dati, insieme all' estesa campagna di
vaccinazione attualmente in atto, fanno prevedere in Italia una ulteriore progressiva riduzione del
numero dei casi di epatite cronica e di cirrosi epatica da HBV.
Profilassi dell’epatite cronica da HBV
La profilassi specifica dell’infezione da HBV si avvale dell’uso di gamma-globuline iperimmuni
specifiche anti-HBV (profilassi passiva) e della vaccinazione (profilassi attiva).
Le gamma-globuline iperimmuni specifiche anti-HBV (HBIG) sono preparate a partire da plasma
proveniente da donatori opportunamente selezionati con alti titoli di anticorpi anti-HBs. La
immunoprofilassi passiva trova indicazione nei seguenti casi:
1. neonati da madre HBsAg positiva
2. soggetti con esposizione parenterale a materiale contaminato da sangue HBsAg positivo
3
In entrambi i casi la somministrazione di HBIG avverrà al più presto, comunque entro le prime 48 ore
dalla nascita o dall’esposizione parenterale, in associazione alla vaccinazione anti-HBV somministrata
entro una settimana in un sito d’inoculo diverso da quello usato per le HBIG.
Agli inizi degli anni 80 furono disponibili in Italia e nel mondo i vaccini anti-HBV detti di prima
generazione, plasma derivanti, ottenuti infatti da plasma di soggetti HBsAg positivi. Successivamente
furono disponibili vaccini ricombinanti ottenuti su larga scala grazie alle metodiche del DNA ricombinante
(22).
La strategia vaccinale adottata in Italia ed in vari paesi del mondo fu inizialmente quella di vaccinare solo i
soggetti a rischio di contrarre l’infezione: bambini nati da madre HBsAg positiva, conviventi di soggetti
HBsAg positivi, tossicodipendenti, soggetti con multipli partner sessuali, personale medico e paramedico,
militari.
L’aspetto più importante di questo programma di vaccinazione è stato l’immunizzazione dei nati da madre
HBsAg positiva, in considerazione dell’alto rischio per tali neonati di infettarsi alla nascita e quindi di
diventare portatori cronici del virus (nel 90% circa dei casi), aumentando così il serbatoio infettivo (23,24).
Nel 1990, dopo sei anni dall’inizio del programma di vaccinazione dei soggetti a rischio, la prevalenza dei
portatori di HBsAg nei militari di leva in Italia si manteneva ancora rilevante: 1,6% nel Nord del paese,
0,8% al Centro e 2% al Sud e nelle Isole (20). Si rendeva pertanto necessario intervenire con una strategia
vaccinale più efficace per ridurre sostanzialmente il serbatoio di portatori presenti nel nostro paese. Fu
proposta infatti di introdurre un programma di vaccinazione obbligatoria di massa anti-HBV ad
integrazione di quello già esistente per i soggetti a rischio, sulla base dei risultati ottenuti dalla vaccinazione
di massa a Taiwan ed in una cittadina dell’Italia meridionale, Afragola (25,26). In questa cittadina, in cui
agli inizi degli anni 80 era iniziata la vaccinazione di massa di tutti i nuovi nati, si era registrata una
considerevole riduzione dell’incidenza dei casi di epatite acuta, che era passata da circa 63 casi\100.000
abitanti nei 5 anni prima della vaccinazione ad 1 caso\100.000 abitanti negli ultimi 5 anni; inoltre la
prevalenza di portatori di HBsAg nella popolazione generale si era ridotta dal 13,4% nel 1978 al 3% del
1990, fino all’1,85% del 1999 (25,27). Sulla base di tali studi fu possibile nel 1991 promulgare la legge
(legge n° 165 del 27/05/1991) che rese obbligatoria la vaccinazione per tutti i nuovi nati nel loro primo
anno di vita e per tutti gli adolescenti nel corso del 12° anno di vita. L’obbligo per questa seconda classe di
età è limitato ai primi 12 anni di applicazione della legge che costituiscono il periodo di tempo necessario
ad ottenere “la saldatura immunitaria” dei soggetti di età compresa tra 0 e 24 anni; ciò si verificherà nel
2003. La vaccinazione si esegue inoculando tre dosi di vaccino con intervallo di 1 mese tra la I e la II dose
4
e di 5 mesi tra la II e la III dose; per i nuovi nati la immunizzazione si esegue con dosi pediatriche al III, V
e XI mese di vita contemporaneamente alle altre vaccinazioni obbligatorie (anti-poliomielite-difteritetetano). Il fatto che la strategia vaccinale adottata dall’Itala sia quella vincente è dimostrata anche dal fatto
che nei paesi che avevano adottato la strategia di vaccinare solo i soggetti a rischio si è verificato un
fallimento (28) e che altri 100 paesi hanno adottato la stessa strategia italiana (29-31).
5
Bibliografia
1. Trends in mortality from cirrhosis and alcoholism in the United States, 1945-1983. JAMA1986; 256:
3337-3338.
2. Dufour MC, Stinson Fs, Fe Caces M. Trends in cirrhosis morbidity and mortality: United States, 19791988. Semin Liver Dis 1993; 13: 109-125.
3. Capocaccia R, Farchi G. Mortality from liver cirrhosis in Italy: proportion associated with consumption
of alcohol. J Clin Epidemiol 1988; 41: 347-357.
4. Bellentani S, Tiribelli C, Saccoccio G et al. Prevalence of chronic liver disease in the general population
of Northern Italy: The Dionysos Study. Hepatology 1994; 20: 1442-1449.
5. Gaeta GB, Giusti G. Epidemiology of chronic viral hepatitis in the Mediterranean area: present status
and trends. Infection 1990; 18: 21-25.
6. Mast EE, Alter MJ. Epidemiology of viral hepatitis: an overview. Seminars in Virology 1992; 4: 273283.
7. Mc Mahon BJ, Rhoandes ER, Heyward WL, et al. A comprehensive programme to reduce the
incidence of hepatitis B virus infection and its sequelae in Alaskan natives. Lancet 1987; ii:1134-1142.
8. Galanti B, Nardiello S, Russo M: Epatite cronica da HBV: momenti influenti nella storia naturale. In
“Le epatiti croniche virali. Storia naturale e terapia”. Giusti G., Piccinino F., Galanti B., Gaeta G.B.
Eds. Masson Milano 1992. pag. 19-27.
9 Bortolotti F, Cadrobbi B, Crivellaro C, et al. Long-term outcome of chronic type B hepatitis in patients
who acquire hepatitis B infection in childhood. Gastroenterology 1990; 99: 805-813.
10. Davis LG, Weber DJ, Lemon SM. Horizontal transmission of hepatitis B virus. Lancet 1989; 1: 889897.
11. Welch J, Webster M, Tilzey AJ, et al. Hepatitis B infections after gynaecological surgery. Lancet
1989; 1:205-209.
12. Schreeder MT, Thompson SE, Hadler SC et al. Hepatitis B in homosexual men: prevalence of
infection and factors related to transmission. J Infect Dis, 1982; 146: 7-17.
13. Robinson WS. Hepatitis B virus and Hepatitis D virus. In: Mandell GL, Bennett JE, Dolin R.
Principles and Practice of Infectious Diseases. IV Edition, Churchull Livingtone Eds, 1995: 14061439.
14. Sagliocca L, Stroffolini T, Amoroso P et al. Risk factors for acute hepatitis B: a case control study.
Journal of Viral Hepatitis 1997; 4: 63-66.
6
15. Pasquini P, Khan HA, Pileggi D et al. Prevalence of hepatitis B markers in Italy. Am J Epidemiol
1983; 118: 699-709.
16. Giusti G, Galanti B, Gaeta GB, Piccinino F, Ruggiero G. HBsAg carriers among blood donors in
Italy: a retrospective survey of data from 189 blood banks. Hepato-Gastroenterol 1981; 28: 96-98.
17. Papaevangelou G. Epidemiology of hepatitis A and B. Infection 1987; 15: 221-227.
18. Utili R, Galanti B, Da Villa G et al. Hyperendemicity of viral hepatitis in the neapolitan area: an
epidemiological study. Boll Ist Sieroter Milan 1983; 62: 145-152.
19. Papaevangelou G, Roumeliotou-Karayannis A. Reduction of HBV infections and mass immunisation.
Lancet 1988; 1: 53-54.
20. D’Amelio R, Matricardi PM, Biselli R et al. Changing epidemiology of hepatitis B in Italy: Public
health implications. Am J Epidemiol 1992; 35: 1012-1018.
21. Giusti G, Gaeta GB, Russo M et al. HBsAg carriers among blood donors in Italy. A multicentre study
in 107 blood banks. Infection 1989; 17: 237-239.
22. Emini EA, Ellis RW, Miller MJ, et al. Production and immunlogical analysis of recombinant hepatitis
B vaccine. J Infect 1986; 13: 3-9.
23. Piazza M, Picciotto L, Villari R, et al. Hepatitis B immunization with a reduced number of doses in
newborn babies and children. Lancet 1985; i: 949-951.
24. Piazza M, Picciotto L, Villari R, et al. Tw doses hepatitis B immunization regimen for infants. Lancet
1985; ii: 1120-1121.
25. Da Villa G, Piazza M, Iorio R, et al. A pilot study of vaccination against Hepatitis B Virus suitable for
mass vaccination campaigns in hyperendemic areas. J Med Virol 1992; 36: 274-278.
26. Huang K, Lin S. Natiowide vaccination: a success story in Taiwan. Vaccine 2000; 18: 35-38.
27. Da Villa G, Sepe A. Pilot project of anti-HBV universal vaccination of newborns in a hyperendemic
area: results after 17 years. Antiviral Ther 2000; 5: 37.
28. Hoofnagle JH. Toward unversal vaccination against Hepatitis B Virus. N Engl J Med 1989; 321:
1301-1305.
29. Margolis HS, Coleman PJ, Brown RE, et al. Prevention of hepatitis B transmission by immunization.
An economic analysis of current recomandations. JAMA 1995; 274: 1201-1208.
30. Centers for Disease Control and Prevention. Hepatitis B Virus: a comprehensive strategy for
eliminating transmission in the United States through universal childhood vaccination. Recomandations
of the Advisory Committee on Immunization Practices (ACIP). MMWR 1996; 40: 1-19.
7
31. Van Damme P, Kane M, Meheus A. Integration of Hepatitis B vaccination into national immunization
programmes. BMJ 1997; 314: 1033-1037.
8