1. INTRODUZIONE
1.1 Angioplastica coronarica percutanea transluminale
L’angioplastica coronaria percutanea transluminale (PTCA) è una
metodica ampiamente utilizzata che consente di dilatare le arterie che
diffondono il sangue al cuore (arterie coronariche) nel caso che queste siano
totalmente
o
parzialmente
occluse
da
placche
aterosclerotiche.
L’angioplastica prevede l’utilizzo di un catetere a palloncino in grado di
provocare vasodilatazione e ristabilire il normale flusso sanguigno. E' una
procedura di rimodellamento meccanico della parete di un'arteria coronarica
in segmenti stenotici (ristretti). Il suo uso è oggi sempre più frequente, tanto
da
aver
notevolmente
ridotto
il
ricorso
alla
cardiochirurgia.
Nell’angioplastica tradizionale viene usato un catetere munito di un
palloncino in punta che viene introdotto in anestesia locale nell’arteria
femorale o radiale e spinto verso il cuore fino alla sede della stenosi. Quindi
si gonfia il palloncino fino al diametro della coronaria (da 2 a 5 mm)
dilatando così il vaso sanguigno ristretto (Fig. 1). L’angioplastica
tradizionale conduce alla dilatazione della stenosi con successo nella grande
maggioranza dei casi. Esiste però una piccola percentuale in cui, invece
della dilatazione si verifica l'occlusione acuta del vaso. In passato
l'occlusione acuta era spesso causa di complicanze quali infarto miocardico
acuto, by-pass aortocoronarico d'urgenza, decesso. Attualmente l'impianto
di protesi coronariche (stent) ha ridotto notevolmente queste complicanze.
1
Negli ultimi anni alla metodica di dilatazione sopra descritta, se ne
sono affiancate altre. Queste nuove metodiche permettono di trattare
restringimenti coronarici difficilmente aggredibili con il solo catetere a
palloncino. La scelta di quale metodica usare è essenzialmente tecnica e
lasciata all'esperienza dell'operatore. Lo stent coronarico è una protesi
metallica a forma di piccolo tubicino che, posizionata a livello del
restringimento, consente di allargarlo in maniera più efficace e duratura
rispetto all'angioplastica tradizionale. La protesi non va incontro a rigetto,
non provoca tumori e assolutamente non si sposta dopo che è stata
posizionata. Dopo 4-6 settimane la protesi è incorporata nella parete della
coronaria, viene cioè ricoperta dalle cellule della parete (endotelio) che la
isolano dal sangue. Fino a che questo processo non si completa è richiesto
l'uso di farmaci che rendono il sangue più fluido ed, in particolare, rendono
le piastrine meno attive. I farmaci che si usano con più frequenza sono
l’Aspirina e la Ticlopidina. L'impianto di stent può essere deciso
elettivamente, o per trattare una complicanza quale l'occlusione acuta o la
dissezione. In tutti questi casi il successo di impianto è molto alto. Il
continuo evolvere della ricerca tecnologica ha permesso la distribuzione sul
mercato di protesi di diverso tipo: a rilascio di farmaci, radioattive etc. La
scelta di queste dipende dall'esperienza dell'operatore e non può essere
definita sempre prima della procedura. Talvolta, per trattare delle lesioni
estese, sono necessarie più protesi. Particolari procedure sono le
angioplastiche con l’utilizzo del cutting balloon (un palloncino corredato di
2
lamelle che tagliuzzano le stenosi), l’aterectomia rotazionale (una fresa
simile a quella del dentista che con una punta ruotante dissolve la stenosi) e
la direzionale che con un sistema di lame permette di tagliare l’ostruzione e
aspirare il materiale.
1.2 Restenosi
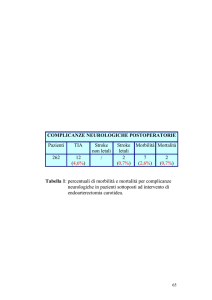
L’angioplastica è però complicata dalla restenosi, un processo di
cicatrizzazione esuberante nel punto trattato che può portare alla comparsa
di un nuovo restringimento dopo 2-6 mesi dal trattamento. La restenosi si
può verificare in circa il 30% dei casi dopo angioplastica tradizionale e dopo
aterectomia rotazionale o direzionale (Holmes et al., 1984; Serryus et al.,
1988; Califf et al., 1991). L'impianto di stent riduce questo rischio, che può
essere inferiore al 10% se sono trattati restringimenti brevi e in coronarie
principali. Comunque nessuna di queste metodiche può ridurre a zero il
rischio di restenosi. La comparsa di restenosi generalmente si manifesta
gradualmente con angina pectoris (dolore al petto) dopo 2 o 4 mesi e non
porta in genere a complicanze acute drammatiche. Spesso la restenosi dà
sintomi modesti o assenti. Per tale ragione il paziente deve sottoporsi a
periodici controlli cardiologici e a tutte le prove consigliate includendo
spesso una prova da sforzo dopo 3-6 mesi e soprattutto non deve
sottovalutare eventuali sintomi che compaiono nei mesi successivi alla
dimissione anche se con sintomatologia sfumata. Quando la restenosi si
manifesta può essere trattata con una nuova angioplastica o, in alcuni casi,
3
può essere richiesto un intervento cardiochirurgico. Il rischio di restenosi è
legato ad un processo di rimodellamento precoce (cicatrizzazione dopo
l'intervento) e quindi, una volta superato il periodo di rischio (6-8 mesi dopo
il trattamento) il buon risultato può essere considerato definitivo.
Nonostante i meccanismi fisiopatologici alla base della restenosi non
siano ancora del tutto chiariti, diverse evidenze sperimentali sia nell’uomo
che nell’animale suggeriscono che l’infiammazione svolge un ruolo centrale
in questo fenomeno (Schwartz et al., 2002; Welt et al., 2002). Il danno
vascolare conseguente alla procedura di rivascolarizzazione induce un
immediato e progressivo rilascio di fattori trombogenici, mitogeni, nonché
di
molecole
vasoattive
con
conseguente
aggregazione
piastrinica,
formazione di trombi e reazione infiammatoria con attivazione dei
macrofagi e delle cellule muscolari vasali lisce (VSMCs) (Ip et al., 1991;
Ferns et al., 1991; Welt et al., 2002). Questi eventi causano la produzione ed
il rilascio di fattori di crescita e di citochine che a loro volta sono segnale
per la loro stessa sintesi e rilascio dalle cellule infiammatorie (Clowes et al.,
1983; 1989). Conseguenza di tale meccanismo è la migrazione delle
VSMCs, dalla loro posizione usuale nella media dei vasi, nell’intima dove
vanno incontro ad un cambiamento nel fenotipo che causa la loro
proliferazione con formazione di una nuova struttura chiamata “neointima”
(Libby et al., 1992; Schwartz et al., 1992). Da questo punto di vista il
fenomeno della restenosi può essere considerato come una risposta
infiammatoria-proliferativa al danno vascolare (Schwartz., 1999).
4
Tuttavia, in questi ultimi anni diverse evidenze sperimentali mettono
in dubbio l’ipotesi che alla base del processo restenotico, che si osserva in
seguito
a
procedure
di
rivascolarizzazione
mediante
tecniche
di
caterizzazione quale è la PTCA, vi è una reazione proliferativa. L’ipotesi
attualmente più accreditata è che la causa della riduzione del lume vascolare
sia un fenomeno di rimodellamento vascolare “vascular remodelling”, che
contribuirebbe in maniera più significativa al fenomeno della restenosi
(Mintz et al., 1996; Kimura et al., 1997; Indolfi et al., 1999). Al contrario, è
stato dimostrato che il fenomeno della restenosi che si osserva dopo
impianto di stent non è dovuto a fenomeni di “remodelling” ma soprattutto a
proliferazione delle VMSCs con formazione di neointima (Indolfi et al.,
1999). Il “remodelling” è un complesso e ancora non ben chiaro processo
probabilmente dovuto ad uno squilibrio tra proliferazione cellulare e
apoptosi (Cho et al., 1997), ad una disregolazione tra produzione e
degradazione della matrice proteica (Coats et al., 1997), così come a
cambiamenti emodinamici nel flusso sanguigno (Davies, 1997; Ward et al.,
2001), tutti fenomeni che tendono a causare meccanismi compensatori del
diametro del vaso e del lume vascolare.
5