Determinazione sperimentale della costante di Joule
mediante calorimetro rotante
OBIETTIVO
1.
Studiare la trasformazione di lavoro meccanico in energia termica.
2.
Misurare quanti Joule sono necessari per aumentare di 1°C la temperatura di 1g di
acqua.
MATERIALE
Calorimetro rotante; Treccia di rame; Contagiri; Acqua; Termometro; Massa da 5 Kg;
Sostegni.
DISPOSITIVO SPERIMENTALE
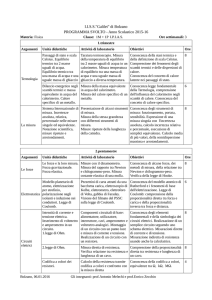
La parte centrale dell'apparecchiatura è un recipiente cavo di rame (calorimetro) entro il
quale può essere posta dell'acqua di quantità nota. Nel recipiente viene poi infilato,
attraverso una guarnizione a tenuta, un termometro per la determinazione delle
variazioni termiche subite dall'acqua. Il recipiente è montato orizzontalmente, e sulla
parete laterale è avvolto un nastro a treccia di rame vincolato, ad un capo, al basamento
mediante un'asta e una molla e, all'altro capo, termina con un anello in metallo utilizzato
per appendere la massa da 5 kg.
Il peso del corpo appeso non è casuale, ma deve uguagliare la forza d'attrito che si
sviluppa quando, mediante la manovella, il recipiente viene fatto ruotare con velocità
costante e non troppo elevata. L'equilibrio fra forza peso e forza di attrito è solitamente
assicurato da un opportuno numero di avvolgimenti del nastro.
Ad ogni giro della manovella la forza di attrito compie un lavoro meccanico che fa
aumentare la temperatura dell'acqua contenuta nel calorimetro e del calorimetro stesso
(compresa la treccia di rame avvolta attorno. Ci saranno altre dispersioni? discussione).
FORMULA PER LA DETERMINAZIONE DEL LAVORO
L = N·2πR·mg
N =
R
numero giri
= raggio del recipiente cilindrico di rame (calorimetro)
M =
massa appesa
G =
accelerazione di gravità terrestre
FORMULA PER LA DETERMINAZIONE DEL CALORE
Q = CsH2O·mH2O·(tfinale-tiniziale)+ Csrame ·mrame·(tfinale-tiniziale)
CsH2O = Calore specifico dell'acqua (1,00 kcal/kg°C)
mH2O = Massa di acqua all'interno del calorimetro
Csrame = Calore specifico del rame ( 0,0923 kcal/kg°C)
mrame = Massa del calorimetro e della treccia di rame
tiniziale = temperatura del sistema (acqua-calorimetro) prima di iniziare la rotazione
tfinale = temperatura del sistema (acqua-calorimetro) dopo N giri
PROCEDURA
1. Pesare il calorimetro di rame vuoto.
2. Riempire il calorimetro con semplice acqua del rubinetto e ripesare il calorimetro
pieno (questa seconda operazione ci permetterà di determinare la massa dell'acqua
all'interno del calorimetro per differenza fra i due valori).
3. Pesare la treccia di rame
4. Montare il dispositivo sperimentale come sopra descritto.
5. Ogni 100 giri fermarsi per leggere la temperatura (attendendo che il valore di
temperatura si stabilizzi ma senza attardarsi onde evitare errori sistematici dovuti alla
termalizzazione con l’ambiente). Ripetere l’operazione almeno 3 volte, fino a 300 giri.
6. Rilevare la temperatura iniziale e finale dopo ogni serie di giri.
7. Calcolare Lavoro, Calore e Costante di Joule.
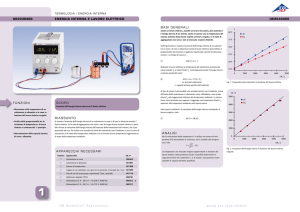
CALCOLI E TABELLE
Riportare i dati sperimentali relativi alle misure effettuate con differente numero di giri
tenendo conto dell’errore di misurazione.
-massa calorimetro vuoto = (107,98 ± 0,02) g
-massa calorimetro più acqua = (149,79 ± 0,02) g
-massa treccia di rame = (29,43 ± 0,02) g
-massa calorimetro più treccia = (137,41 ± 0,04) g
-temperatura sistema (acqua-calorimetro) iniziale = (21,9 ± 0,1) °C
-temperatura sistema (acqua-calorimetro) dopo 100 giri = (25,2 ± 0,1) °C
-temperatura sistema (acqua-calorimetro) dopo 200 giri = (28,2 ± 0,1) °C
-temperatura sistema (acqua-calorimetro) dopo 300 giri = (31,0 ± 0,1) °C
-diametro del calorimetro = (4,6 ± 0,1) cm
N giri Temperatura
(± 0,1°C)
L (kJ)
Q (kcal)
L/Q (J/cal)
0
21,9
-
-
-
100
25,2
0,7±0, 1
0,17 ± 0,01
4,1 ± 0,1
200
28,2
1,4 ± 0,1
0,34 ± 0,01
4,1 ± 0,1
300
31,0
2,1 ±0, 1
0,50 ± 0,01
4,2 ± 0,1
Commenta il risultato ottenuto.
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------COLI E TABELLE
CONCLUSIONI
1.
Il lavoro fatto dalle forze d’attrito provoca un aumento di temperatura infatti
questo processo fa aumentare l’energia cinetica media del moto delle molecole del
sistema acqua-calorimetro.
(Possiamo fare l’esempio dell’effetto che si genera quando sfreghiamo le mani tra loro. I
palmi mediamente sono alla stessa temperatura, quindi non c’è alcuna conduzione di
calore, ma, a causa delle varie imperfezioni e scabrosità della pelle, durante lo
sfregamento avvengono degli urti a livello microscopico. In seguito agli urti le parti
superficiali si mettono a vibrare, comunicando il moto di vibrazione alle molecole
adiacenti in entrambe le mani. Questo processo fa aumentare l’energia cinetica media del
moto delle molecole e, di conseguenza, la temperatura delle mani. In questo caso l’aver
fatto delle misure ci permette di effettuare un’analisi quantitativa del fenomeno che
stiamo studiando)
2.
L'incremento di temperatura è proporzionale al numero giri? Fare il grafico della
temperatura in funzione del numero di giri.
DOMANDE
1.
Il ritmo a cui girare influenza il risultato? Per rispondere si possono prendere in
considerazione i casi estremi.
2.
Quali misure dovresti fare per calcolare la frequenza rotatoria? e il periodo?
3.
Se si continuasse a girare la manovella la temperatura del calorimetro
continuerebbe ad aumentare?
4.
Come mai inizialmente la rotazione solleva il peso e poi non più?
5.
La forza di attrito rullo-fune e' distribuita lungo la superficie di contatto. Che
direzione ha?