La Leucemia Linfatica
Cronica
Guida per il Paziente
A cura di:
Unità di Ematologia e di Trapianto di Midollo Osseo
Istituto Nazionale per lo Studio a la Cura dei Tumori - Milano
INDICE
Introduzione ................................................................................................... 1
Che cosa è la Leucemia Linfatica Cronica...................................................... 1
I sintomi.......................................................................................................... 2
Da dove prende origine e come progredisce .................................................. 3
Come viene diagnosticata .............................................................................. 4
La prognosi .................................................................................................... 5
Come si cura la Leucemia Linfatica Cronica................................................... 5
La chemioterapia............................................................................................ 8
Il trapianto di midollo osseo autologo (autotrapianto) ..................................... 9
L'autotrapianto in pratica .............................................................................. 10
Il trapianto di midollo osseo allogenico (allotrapianto) .................................. 11
Il trapianto di midollo osseo allogenico (allotrapianto) in pratica ................... 12
Il trapianto di midollo osseo allogenico a ridotta intensità ............................. 13
Il trapianto di midollo osseo allogenico da donatore da banca...................... 14
La donazione di cellule staminali.................................................................. 15
Quando fare il trapianto di midollo osseo allogenico..................................... 15
La terapia del paziente in recidiva ................................................................ 15
La terapia di supporto................................................................................... 16
Le nuove terapie .......................................................................................... 17
Cosa offre la U.O. di Ematologia dell'Istituto Nazionale dei Tumori .............. 19
GLOSSARIO ................................................................................................ 21
La Leucemia Linfatica Cronica – Guida per il Paziente
Introduzione
La leucemia linfatica cronica (LLC) è una malattia del midollo osseo che colpisce in
prevalenza persone adulte ed anziane. L'invecchiamento della popolazione ha portato ad
un aumento del numero di casi di LLC, sensibilizzando i ricercatori ed i medici nei confronti
di questa malattia. Presso l'unità di Ematologia e Trapianto di Midollo Osseo Allogenico
dell'Istituto Nazionale dei Tumori di Milano trattiamo da anni con passione ed impegno la
LLC. Dal contatto quotidiano con il malato ci siamo resi conto che, al giorno d’oggi, esiste
una sempre maggiore consapevolezza della propria malattia rispetto al passato, che si
traduce in una crescente richiesta di informazioni da parte del paziente. In questo senso,
la diffusione di informazioni medico-scientifiche ad opera dei mezzi di comunicazione ha
facilitato l’ammalato nella comprensione della propria patologia. La grande disponibilità di
informazioni più o meno attendibili cui è possibile accedere può però creare confusione e
disorientare il paziente in una fase delicata della propria vita.
Da queste premesse nasce il nostro progetto di informare in maniera chiara e competente
i pazienti riguardo alla complessa problematica della LLC ed a questo scopo abbiamo
creato un sito concepito per dare delle risposte alle domande che il paziente più
comunemente si pone, o vorrebbe porre, al proprio medico curante.
Che cosa è la leucemia linfatica cronica
La leucemia linfatica cronica (LLC) è una patologia neoplastica del sistema linfatico
caratterizzata da un accumulo di linfociti nel sangue periferico, nel midollo osseo e negli
organi linfatici (linfonodi e milza). Rappresenta la forma di leucemia di più frequente
osservazione nel mondo occidentale ed è tipicamente una malattia dell’adulto anziano in
quanto l’età media di insorgenza è intorno ai 65 anni.
Nella maggior parte di casi (60%) il sospetto diagnostico viene posto in maniera
occasionale: sono pazienti in pieno benessere che presentano un aumento dei globuli
bianchi (leucocitosi) all’esame emocromocitometrico; questo riscontro è al giorno d’oggi
sempre più frequente per la diffusa abitudine di effettuare esami routinari di controllo. Nei
restanti casi la malattia viene diagnosticata per la comparsa di un aumento volumetrico di
uno o più linfonodi delle stazioni linfoghiandolari superficiali (collo, ascelle, inguine).
Inizialmente, non potendo escludere una forma infettiva, l’adenopatia viene sottoposta ad
un trattamento antibiotico mirato; nel caso in cui tale trattamento non sortisca alcun effetto
1
La Leucemia Linfatica Cronica – Guida per il Paziente
vengono effettuati ulteriori accertamenti, tra cui un emocromo, che mostra una alterazione
nella conta dei globuli bianchi e che di conseguenza indirizza verso un sospetto
diagnostico di patologia linfoproliferativa.
I sintomi
Circa nei 2/3 dei casi la diagnosi di leucemia linfatica cronica è casuale e, pertanto, in
questi pazienti la malattia decorre in maniera asintomatica. Questa quota di pazienti
presenta una sopravvivenza molto lunga, e pertanto negli stadi iniziali spesso non è
indicato iniziare un trattamento citoriduttivo. Nei pazienti sintomatici, la più frequente
modalità di presentazione è la comparsa di una adenopatia generalizzata: sono
interessate preferenzialmente le stazioni linfonodali del collo, delle ascelle o dell’inguine e i
linfonodi sono quasi sempre di consistenza non dura, non dolenti e senza tendenza a
confluire in pacchetti. Frequenti sono anche l’aumento di dimensioni della milza
(splenomegalia) e del fegato (epatomegalia).
Con il progredire della malattia possono comparire altri sintomi, che non sono caratteristici
della leucemia linfatica cronica ma sono comuni ad altre patologie linfoproliferative, e sono
conseguenti all’invasione del midollo osseo da parte di linfociti neoplastici: la stanchezza,
associata a pallore cutaneo e palpitazioni sono una conseguenza dell’anemia, mentre le
manifestazioni emorragiche sono secondarie alla riduzione delle piastrine.
Inoltre l’accumulo dei linfociti patologici ostacola la normale produzione da parte del
midollo osseo di linfociti e granulociti neutrofili, che sono le cellule deputate a difendere
l’organismo dai microrganismi patogeni; in questo modo si crea uno stato di
immunodeficienza che predispone l’individuo malato all’insorgenza di infezioni.
Infine in un 5% di pazienti la malattia si può manifestare sotto forma di fenomeni
autoimmuni, cioè produzione di anticorpi contro antigeni propri, in particolare antigeni di
globuli rossi e piastrine, dando origine a patologie quali l’anemia emolitica autoimmune, la
piastrinopenia autoimmune o più raramente l’associazione di entrambi (sindrome di
Fisher-Evans).
Pertanto l’approccio clinico ai pazienti con leucemia linfatica cronica deve mirare sia alla
valutazione dei segni clinici che esprimono l’accumulo dei linfociti neoplastici, così come
degli effetti correlati allo squilibrio immunologico che tale patologia determina e che sono
appunto rappresentati dalle infezioni e dalle complicanze autoimmuni.
2
La Leucemia Linfatica Cronica – Guida per il Paziente
Da dove prende origine e come progredisce
Nonostante negli ultimi anni siano stati fatti degli enormi passi avanti nella comprensione
dei meccanismi di funzionamento della cellula tumorale, sono ancora ignoti i fattori che
portano all'insorgenza dei tumori. La ricerca ha mostrato che la probabilità di ammalarsi di
un tumore è legata principalmente a due fattori:
- fattori ambientali.
- caratteristiche genetiche dell'individuo
Per quanto riguarda la LLC, a differenza di altri tipi di leucemia, la sua insorgenza non è
influenzata dall’esposizione a radiazioni ionizzanti e ad agenti chimici.
Viceversa, diversi studi hanno dimostrato la possibilità che fattori genetici o familiari
possano predisporre ad un più elevato rischio di sviluppare la malattia.
Infatti nei parenti di primo grado di pazienti affetti da LLC è stata osservata un’incidenza di
casi da 2 a 7 volte maggiore rispetto a quella osservata in una popolazione normale di
controllo.
Anche per la LLC, nonostante numerosi progressi compiuti negli ultimi anni, non sono
ancora stati definiti con certezza i meccanismi responsabili della trasformazione di un
linfocita normale in senso neoplastico. I linfociti sono cellule fondamentali del sistema
immunitario di un individuo; essi rappresentano le cosiddette “sentinelle” che in condizioni
normali sorvegliano costantemente l’organismo e sono pronti in ogni momento ad attivare
la risposta immune nei confronti di agenti patogeni, siano essi microorganismi o cellule
tumorali; si distinguono in B o T a seconda che la risposta immunitaria sia
prevalentemente anticorpo-mediata o cellulo-mediata. Nel caso della leucemia linfatica
cronica si verifica che uno di questi linfociti (nella maggior parte dei casi un linfocita B)
subisce una trasformazione in senso neoplastico e da’ origine ad un clone linfocitario, cioè
una popolazione di cellule tutte uguali tra loro e che presentano 2 caratteristiche peculiari:
1) non rispondono più agli stimoli fisiologici
2) hanno perso la capacità di andare incontro ad apoptosi, cioè la morte programmata
della cellula.
In questo modo i linfociti neoplastici continuano a dividersi e ad accumularsi nel sangue
periferico, nel midollo osseo (figura 1), negli organi linfatici (linfonodi e milza) e talora negli
organi extralinfatici.
3
La Leucemia Linfatica Cronica – Guida per il Paziente
Come viene diagnosticata
Nei 2/3 dei casi la diagnosi di LLC è casuale ed avviene in seguito al riscontro di un
aumento della conta assoluta dei linfociti (osservato alla formula leucocitaria) durante
l'esecuzione di normali esami del sangue di controllo. E’ ragionevole porre il sospetto di
malattia linfoproliferativa leucemica in presenza di un incremento del numero di linfociti nel
sangue periferico superiore a 4.000/mmc; successivamente l’esame morfologico, cioè
l’osservazione dello striscio di sangue periferico al microscopio ottico (figura 2), integrato
dall’immunofenotipo (figura 3), che valuta la co-espressione di antigeni caratteristici delle
cellule leucemiche, consentono di formulare la diagnosi definitiva di LLC e di distinguerla
dalle linfocitosi reattive benigne.
Nel rimanente 30% dei casi la malattia viene scoperta in seguito alla comparsa di uno o
più linfonodi ingrossati di volume, che persistono nonostante un trattamento antibiotico;
meno frequentemente una storia di infezioni recidivanti induce il medico curante a
sottoporre il proprio paziente ad una serie di esami laboratoristici di controllo, tra cui un
emocromo.
Infine in una piccola percentuale di pazienti il sospetto di LLC può derivare dal riscontro di
un’anemia o una piastrinopenia.
Una volta che si ha il sospetto di LLC è necessario quindi eseguire una serie di
accertamenti che servono a formulare una diagnosi di certezza e a capire il grado di
estensione della malattia. Più precisamente è indicato richiedere:
- esame emocromocitometrico
- dosaggio delle immunoglobuline
- test di Coombs e ricerca anticorpi antipiastrine
- tipizzazione linfocitaria su sangue periferico
- TAC collo, torace, addome superiore ed inferiore
- aspirato midollare e biopsia ossea.
La biopsia linfonodale può essere di utilità diagnostica quando la tipizzazione linfocitaria
su sangue periferico non è chiaramente indicativa di LLC; diventa invece indispensabile
quando il quadro clinico è suggestivo per una trasformazione della malattia in una forma
più aggressiva (sindrome di Richter).
4
La Leucemia Linfatica Cronica – Guida per il Paziente
La prognosi
Da punto di vista prognostico la LLC presenta un decorso molto eterogeneo. Alcuni
soggetti infatti mostrano un andamento estremamente indolente, che non richiede terapia
per più di 10 anni, mentre altri soggetti possono andare incontro ad una crescita del clone
leucemico relativamente rapida con una sopravvivenza di pochi anni.
Diventa quindi di fondamentale importanza essere a conoscenza già alla diagnosi di fattori
prognostici che possano predire l’evolutività nel tempo della malattia.
I fattori prognostici tradizionali sono principalmente rappresentati da:
- stadio clinico, che riflette la massa tumorale
- tempo di raddoppiamento dei linfociti
- dosaggio della beta2microglobulina
- dosaggio della lattico deidrogenasi (LDH)
Nell’ultimo decennio importanti contributi alla ricerca in campo diagnostico sono stati
portati grazie all’applicazione di nuove tecniche di immunologia, citogenetica e biologia
molecolare; in particolare i seguenti parametri di laboratorio:
-elevata espressione dell’antigene CD38 sulle cellule leucemiche
-delezioni (cioè la mancanza di una piccola parte) dei cromosomi 11 e 17
-assenza di mutazioni somatiche a carico dei geni che codificano per una porzione delle
immunoglobuline delle cellule leucemiche
risultano essere associati ad una prognosi sfavorevole, rappresentano cioè fattori predittivi
di scarsa risposta alle terapie convenzionali.
In definitiva, grazie all’apporto di queste nuove tecniche, abbiamo oggi a disposizione un
pannello completo di parametri clinici e di laboratorio che ci permettono di suddividire i
pazienti in differenti gruppi di rischio, e quindi di impostare il programma terapeutico più
appropriato sulla scorta di questi parametri prognostici (figura 4).
Come si cura la Leucemia Linfatica Cronica
La LLC è una malattia tumorale che viene curata con la chemioterapia. Per molti anni il
trattamento è stato basato essenzialmente sull’impiego di farmaci chemioterapici per
bocca; questi farmaci permettono un controllo palliativo dei sintomi, una risposta transitoria
in una certa percentuale di pazienti senza però avere alcun impatto obiettivo sulla
sopravvivenza.
5
La Leucemia Linfatica Cronica – Guida per il Paziente
Questi risultati non sono stati migliorati in maniera significativa da regimi terapeutici che
comprendevano
la
somministrazione
contemporanea
di
più
farmaci
(regimi
polichemioterapici). Negli ultimi anni, nuovi agenti terapeutici come gli analoghi delle
purine sono stati introdotti nell’armamentario terapeutico con promettenti risultati
nell’induzione della risposta.
In questo scenario, caratterizzato dall’assenza di un trattamento convenzionale curativo, si
è fatta sempre più concreta la possibilità di sottoporre determinate categorie di pazienti
con LLC a nuovi approcci terapeutici: tra questi la procedura che ha avuto maggior
successo è stato il trapianto di midollo osseo. Tuttavia in questa malattia le procedure di
trapianto non sono state finora applicate in maniera estensiva, ma riservate a casi
selezionati nell’ambito di protocolli sperimentali di ricerca; questo per diversi motivi:
1. la maggior parte dei pazienti ha un’età avanzata (> 65 anni) e non è in grado di
tollerare la tossicità associata ad una chemioterapia molto intensiva (la cosiddetta
chemioterapia di condizionamento ad alte dosi).
2. molti pazienti possono avere una lunga sopravvivenza anche con la terapia
convenzionale.
3.
In realtà circa il 40% dei pazienti ha un’età inferiore a 60 anni e presenta, generalmente,
una condizione clinica complessiva che consente la somministrazione di farmaci
chemioterapici ad alto dosaggio senza riportare effetti tossici di grado elevato. Questi
pazienti, che hanno una lunga aspettativa di vita, devono essere sicuramente considerati
candidabili per un programma terapeutico curativo che preveda il trapianto di midollo
osseo.
Il trapianto di midollo osseo autologo, detto anche autotrapianto, consente di ottenere
percentuali di remissioni complete nell’ordine del 50-80% dei casi, contro il 3-5% della
chemioterapia per bocca, che attualmente è ancora considerata il trattamento standard
della LLC. La remissione completa, ossia la scomparsa dei segni di malattia, rappresenta
un importante traguardo, dal momento che il paziente in remissione completa ha un
miglioramento della qualità di vita e della sopravvivenza. Tuttavia, nel corso degli anni si è
notato che, per quanto l’autotrapianto di midollo osseo abbia migliorato l’aspettativa di vita,
la malattia ricompare nella gran parte dei casi trattati. Si è quindi cercato di migliorare i
risultati clinici facendo ricorso al trapianto di midollo osseo allogenico, dal momento che
aveva mostrato una buona efficacia nel trattamento di altri tumori ematologici. I dati iniziali
relativi all’impiego del trapianto di midollo osseo allogenico sono stati piuttosto
6
La Leucemia Linfatica Cronica – Guida per il Paziente
insoddisfacenti, a causa dell’elevata mortalità peri-trapiantologica. Dal 1998 in poi il
miglioramento delle tecniche di trapianto e l’impiego di questa terapia in pazienti con
malattia meno avanzata ha consentito di ottenere risultati molto incoraggianti. In
particolare si è osservato un elevato numero di remissioni complete, di durata mediamente
più lunga rispetto a quelle ottenute dopo autotrapianto di midollo. Negli ultimi anni sono
state sviluppate strategie innovative di trapianto che hanno permesso di ottenere un
numero elevato di remissioni complete durature a fronte di una mortalità estremamente
ridotta. Inoltre con il trapianto allogenico è possibile ottenere la remissione molecolare
della maIattia, che sta ad indicare l’ottenimento della scomparsa del clone leucemico,
dimostrata mediante indagini molto sensibili di biologia molecolare; tutto ciò ovviamente si
traduce in un incremento del periodo di sopravvivenza libera da malattia rispetto ai
pazienti che ottengono soltanto la remissione a livello morfologico.
A questo vasto panorama di armi terapeutiche si sono aggiunti recentemente nuovi
farmaci indirizzati verso bersagli specifici dei linfociti leucemici; tra questi gli anticorpi
monoclonali (anti-CD52 e anti-CD20) hanno dimostrato di essere molto efficaci, sia da soli
che in combinazione con la chemioterapia, nel trattamento di pazienti con malattia in
ricaduta o resistente alle terapie convenzionali.
Da questa breve descrizione si comprende quindi come la terapia della LLC sia
estremamente varia; infatti i progressi ottenuti negli ultimi anni grazie alla ricerca
scientifica hanno drasticamente cambiato la filosofia terapeutica della LLC, che per molti
anni è stata basata sulla somministrazione empirica di farmaci chemioterapici per bocca.
Attualmente la scelta del tipo di trattamento viene personalizzata, prendendo in
considerazione diversi parametri, e più precisamente i fattori prognostici (clinici e genetici),
l’età del paziente, la disponibilità di un donatore di midollo ed il tipo di risposta ottenuta con
i primi cicli di chemioterapia.
7
La Leucemia Linfatica Cronica – Guida per il Paziente
La chemioterapia
I pazienti con malattia in fase iniziale e clinicamente stabile, non presentano indicazione
ad iniziare subito un trattamento chemioterapico. Questa strategia di comportamento è
infatti basata su due evidenze cliniche:
1) i pazienti in fase iniziale e con malattia stabile hanno le stesse aspettative di vita di
soggetti normali senza LLC
2) un precoce trattamento con la chemioterapia convenzionale (clorambucile) ritarda la
progressione della malattia ma non allunga la sopravvivenza (report di uno studio condotto
da un gruppo cooperativo francese su più di 600 pazienti).
Pertanto i pazienti che alla diagnosi presentano:
1. linfocitosi < 40-50.000/mmc,
2. meno di 3 sedi linfatiche interessate,
3. assenza di sintomi correlati alla malattia
possono essere monitorati nel tempo con periodiche visite ed esami del sangue; in questi
casi è infatti indicato un atteggiamento osservazionale (dall’inglese “wait and see”). Invece
nei pazienti che si presentino in stadio clinico avanzato o qualora compaiano segni di
progressione clinica è indicato iniziare un trattamento chemioterapico.
La chemioterapia standard consiste nella somministrazione di un farmaco per bocca, il
Clorambucile: questo farmaco è stato adoperato in numerosi schemi di trattamento con
un ampio range di dosi. Questo tipo di terapia è estremamente ben tollerato, non dà
nausea, non fa cadere i capelli, non richiede il ricovero ospedaliero in quanto le medicine
vengono assunte a casa. L’unico problema è rappresentato dal fatto che Il Clorambucile
può dare una modesta tossicità a livello del midollo osseo. Le risposte si attestano tra il
30% e il 70% dei pazienti alla diagnosi; di questi solo una piccola parte (<5%) ha una
remissione completa.
Dai primi anni ’80 è stato introdotto un nuovo farmaco, la Fludarabina, un analogo delle
purine che agisce inibendo la sintesi del DNA delle cellule leucemiche. La Fludarabina
induce remissioni complete circa nel 30% dei pazienti non precedentemente trattati con
una quota di risposte complessive che si attesta oltre il 70% e con una sopravvivenza
mediana di circa 5 anni. Anche la Fludarabina è un farmaco ben tollerato, in quanto non
provoca nausea, non determina alopecia e solitamente viene infuso in regime di DayHospital in un’ora; lo schema terapeutico più usato prevede la somministrazione
8
La Leucemia Linfatica Cronica – Guida per il Paziente
giornaliera del farmaco per 3 o 5 giorni consecutivi al mese. Numerosi trials clinici sono
stati condotti per dimostrare l’efficacia di questo farmaco rispetto al clorambucil o ai regimi
polichemioterapici: questi studi nel loro complesso hanno mostrato un vantaggio per la
fludarabina in termini di percentuale di remissioni complete, di durata della remissione e
un trend positivo in termini di durata della sopravvivenza globale.
Attualmente la Fludarabina è disponibile anche come farmaco per bocca ed è quindi facile
prevedere che gli studi clinici futuri saranno volti a valutare l’efficacia e la sicurezza della
formulazione orale.
Il trapianto di midollo osseo autologo (autotrapianto)
Come dicevamo in precedenza, nonostante la LLC sia tipicamente una malattia dell’adulto
anziano, almeno il 40% dei pazienti ha un’età inferiore a 60 anni e si presenta in buone
condizioni generali; in questi pazienti è lecito pertanto pensare ad un trattamento
terapeutico potenzialmente curativo, attraverso l’intensificazione della dose dei farmaci
chemioterapici. Esiste infatti una correlazione diretta tra dosaggio del farmaco
chemioterapico e risposta della malattia, ossia più farmaco si somministra e maggiore è la
distruzione delle cellule malate. Tuttavia, gli effetti collaterali della chemioterapia
impediscono di raggiungere dosi troppo elevate. Gli organi hanno una sensibilità differente
all'azione dei chemioterapici e si può immaginare che esista una scala che vede nel
gradino più basso il midollo osseo. Quindi, il maggior limite alla crescita di dosaggio dei
chemioterapici è rappresentato proprio dalla tossicità midollare. Qualora fosse possibile
ovviare ai problemi della tossicità midollare, al gradino successivo si incontrerebbe la
tossicità intestinale, e così via. In effetti, il trapianto di midollo osseo autologo ha
consentito di superare il limite imposto dalla tossicità midollare. Questo importante
traguardo è stato reso possibile dal riconoscimento, all'interno del midollo osseo, di
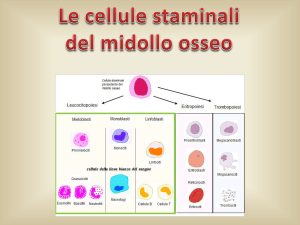
particolari cellule, chiamate cellule staminali, che, se iniettate in sufficiente quantità, sono
in grado di rigenerare dal nulla un nuovo midollo. Si comportano quindi come dei veri e
propri semi, che, opportunamente coltivati, possono ricreare una normale funzione
midollare. L'impiego delle cellule staminali è alla base del trapianto di midollo osseo
autologo. Inizialmente le cellule staminali venivano prelevate direttamente dal midollo, con
una procedura chiamata espianto di midollo. Successivamente si è scoperto che, con
opportuni accorgimenti, ossia associando un particolare tipo di farmaco chemioterapico
con una medicina che stimola il midollo, è possibile osservare il rilascio di tali cellule dal
midollo al sangue circolante e quindi è possibile prelevarle direttamente dalle vene delle
9
La Leucemia Linfatica Cronica – Guida per il Paziente
braccia, con una procedura chiamata leucaferesi. Grazie alla leucaferesi è possibile
raccogliere un gran numero di cellule staminali periferiche di buona qualità, sufficienti per
effettuare la procedura di autotrapianto. Le cellule staminali, sia raccolte dal midollo che
prelevate dalle vene delle braccia, vengono poi congelate e possono essere conservate
per oltre un decennio. Per diversi anni, attraverso metodiche di laboratorio, è stato fatto il
tentativo di ripulire le cellule staminali dalle cellule neoplastiche contaminanti (purging),
nella speranza che questo potesse ridurre il numero di recidive dopo autotrapianto. In
realtà, per quanto affascinante sul piano teorico, la metodica di purificazione del midollo
(purging in vitro) non ha dato i risultati sperati ed è stata soppiantata dal cosiddetto
“purging in vivo”: tale procedura, che consiste nella somministrazione di anticorpi
monoclonali nella fase immediatamente precedente la raccolta di cellule staminali, ha lo
scopo di “ripulire” il sangue circolante dai linfociti tumorali, in maniera tale da ottenere
leucaferesi il meno possibile contaminate e di conseguenza reinfondere, nella fase di
autotrapianto, soltanto cellule staminali sane. Questo trattamento sembra molto
promettente e solitamente viene effettuato solo in centri specialistici.
Per quel che riguarda i risultati, grazie all’autotrapianto di cellule staminali è possibile
ottenere una percentuale di remissioni complete valutabile intorno al 50-80%. La durata
mediana delle risposte è di circa 5 anni. La mortalità associata al trapianto è inferiore al
5%. Attualmente molte aspettative sono riposte nel trapianto autologo effettuato insieme al
purging in vivo, cioè con anticorpi monoclonali; essendo tuttavia una procedura in fase di
studio iniziale, non si conoscono ancora i dati a lungo termine.
L'autotrapianto in pratica
Nel caso in cui il paziente sia stato avviato ad un programma terapeutico che preveda
l'autotrapianto
di
cellule
staminali,
vengono
inizialmente
effettuati
alcuni
cicli
chemioterapici, che hanno lo scopo di abbattere il numero delle cellule tumorali.
Successivamente si somministra un farmaco, chiamato Ciclofosfamide, in associazione al
fattore di crescita leucocitario (somministrato a domicilio per via sottocutanea); tale
combinazione promuove il rilascio dal midollo al sangue circolante di un gran numero di
cellule staminali, che vengono così raccolte e congelate. La fase finale del trattamento
prevede quindi l'autotrapianto di cellule staminali periferiche.
Tale fase consiste nella somministrazione endovenosa di uno o più farmaci chemioterapici
ad alto dosaggio. A distanza di 24 ore si infondono dal catetere venoso centrale le cellule
10
La Leucemia Linfatica Cronica – Guida per il Paziente
staminali precedentemente raccolte e criopreservate. Dopo 4-5 giorni si verifica la discesa
dei valori dei globuli bianchi, dei globuli rossi e delle piastrine, con conseguente rischio di
comparsa di febbre ed eventuale necessità di eseguire delle trasfusioni di emoderivati. A
distanza di 10-12 giorni dalla reinfusione delle cellule staminali si ha la ripresa delle
normale funzione midollare, con recupero dei valori di globuli bianchi, globuli rossi e
piastrine; dopo aver ottenuto la piena ricostituzione midollare, il paziente può essere
dimesso. La degenza media del ricovero per autotrapianto è di circa 14 giorni. Va
segnalato come gli eventuali problemi che insorgono durante il ricovero (es. febbre, che
richiede l'impiego endovenoso di antibiotici), si risolvano con la ricrescita del nuovo
midollo. In termini temporali, dalla diagnosi alla conclusione delle terapie passa un
intervallo di tempo variabile tra 5 e 6 mesi, infatti: circa 4 mesi sono richiesti per i cicli
chemioterapici preparatori all’autotrapianto, poi vi sono 2-3 settimane di pausa, ed infine il
periodo dell'autotrapianto, che dura circa 2 settimane.
In termini di degenza, nella prima fase il paziente può eseguire la chemioterapia in Day
Hospital o da ricoverato, con degenza di 4 giorni per ciclo (3-4 cicli). La Ciclofosfamide
viene somministrata in regime di ricovero, con una degenza media di 3 giorni. La
leucaferesi viene eseguita in regime ambulatoriale. L’autotrapianto di cellule staminali
richiede una degenza di 14 giorni.
Il trapianto di midollo osseo allogenico (allotrapianto)
Nonostante il buon controllo della malattia che ottiene l'autotrapianto di midollo osseo, la
gran parte dei pazienti è destinata a recidivare nell'arco di tempo di alcuni anni. Con lo
scopo di migliorare questi risultati, è stato introdotto nel trattamento della LLC il trapianto
di midollo osseo allogenico o allotrapianto di midollo. In effetti i dati iniziali relativi
all’impiego di questo tipo di procedura hanno dimostrato che il trapianto allogenico è in
grado di indurre una remissione completa duratura anche nei pazienti refrattari ai
trattamenti convenzionali. Il trapianto di midollo osseo allogenico deve la sua elevata
attività terapeutica non tanto all'azione dei farmaci chemioterapici, ma al fatto che agisce
come una vera e propria immunoterapia adottiva, ossia il sistema immunitario sano del
donatore aggredisce e distrugge le cellule malate del paziente, esercitando un'azione
efficace e prolungata nel tempo. Infatti, l'allotrapianto non si limita a sostituire il midollo
osseo del paziente con quello di un donatore sano ma comporta anche il trasferimento di
un nuovo sistema immunitario dal donatore al ricevente. Dal momento che il sistema
immunitario di un individuo, una volta trapiantato in un altro soggetto, può provocare dei
11
La Leucemia Linfatica Cronica – Guida per il Paziente
danni gravissimi (conseguenti al conflitto immunitario che si genera nell’ospite), è
necessario che il livello di compatibilità nella coppia donatore-ricevente sia il più elevato
possibile. Il grado di compatibilità tra fratelli viene valutato con l'analisi dei geni del sistema
HLA ed il trapianto è possibile solo in presenza di un elevato livello di uguaglianza tra
donatore e ricevente.
Uno studio di registro effettuato negli anni ’90 mostra che la curva di sopravvivenza di
circa 50 pazienti sottoposti ad allotrapianto presenta un “plateau” del 40% a 5 anni: cio’ sta
a significare che questa quota di pazienti, vivi e in remissione completa, sono
verosimilmente guariti dalla malattia. Questo studio è considerato come una pietra miliare
della terapia della LLC, in quanto per la prima volta si poteva dimostrare un trattamento in
grado di offrire la guarigione a pazienti giovani affetti da questa malattia. Il prezzo da
pagare però è stato rappresentato da una mortalità associata al trattamento che oscilla tra
il 25 e il 40%, quindi molto più elevata rispetto all'autotrapianto.
Recenti progressi della pratica trapiantologica hanno permesso di sviluppare una nuova
procedura di trapianto caratterizzata da una uguale efficacia rispetto al trapianto
convenzionale ma gravati da una tossicità ed una mortalità molto inferiori. Questa nuova
strategia di trapianto viene chiamata trapianto di midollo osseo allogenico a ridotta
intensità.
Il trapianto di midollo osseo allogenico (allotrapianto) in pratica
Il trapianto si articola in tre differenti fasi. Dopo avere posizionato un catetere venoso
centrale ha inizio la prima fase, che consiste nella somministrazione di farmaci
chemioterapici ed immunosoppressori (Ciclosporina), con lo scopo di preparare il paziente
a ricevere le cellule staminali del donatore. A seconda dei farmaci utilizzati questa fase
dura dai 2 ai 6 giorni, è generalmente ben tollerata e una modesta nausea rappresenta il
disturbo principale. Con l'infusione delle cellule staminali del donatore ha inizio la seconda
fase, la cui durata è di 10-18 giorni. In questo periodo compaiono i disturbi legati al
mancato funzionamento del midollo osseo: il midollo del ricevente è stato distrutto ed il
midollo del donatore è ancora troppo giovane per produrre le cellule del sangue. In questo
periodo si può avere l'insorgenza di febbre ed è necessario trasfondere globuli rossi e
piastrine. Complessivamente questo è il periodo più delicato, che termina quando il nuovo
midollo ricomincia a funzionare. Con la ripresa della funzione midollare ha inizio la terza
12
La Leucemia Linfatica Cronica – Guida per il Paziente
fase, caratterizzata principalmente dall'adattamento del nuovo sistema immunitario
nell'organismo del ricevente. In questo periodo il paziente vive a casa propria e si deve
sottoporre a frequenti controlli ambulatoriali. Il rischio principale di questo periodo è la
comparsa della malattia da trapianto contro l'ospite (GVHD è l'acronimo di uso comune in
inglese). La malattia da trapianto contro l'ospite origina dall'attivazione del sistema
immunitario del donatore nei confronti del ricevente ed è caratterizzata da alterazioni
cutanee, intestinali e disturbi al fegato. Qualora compaia la malattia da trapianto contro
l'ospite, evento che si verifica nel 40-50% dei casi, è necessario aumentare le terapie
immunosoppressive. In questo modo la gran parte dei casi si risolve, anche se la malattia
da trapianto contro l'ospite rappresenta una complicanza potenzialmente molto grave se
non risponde alla terapia. La terza fase del trapianto è inoltre caratterizzata da un
aumentato rischio infettivo, soprattutto nei confronti di infezioni virali. Frequentemente si
ha la riattivazione di un virus latente nell'organismo di ciascuno di noi: il Citomegalovirus.
La riattivazione del Citomegalovirus viene controllata con successo grazie a specifici
farmaci antivirali. A distanza di 4-9 mesi dal trapianto il sistema immunitario del donatore si
adatta all'organismo del ricevente ed è allora possibile sospendere completamente tutti i
farmaci. Si raggiunge così l'obiettivo dell'allotrapianto che è quello di eliminare
completamente la malattia, permettendo al paziente di tornare ad una vita normale senza
dover più assumere farmaci. In alcuni casi, tuttavia, si può avere una cronicizzazione della
malattia da trapianto contro l'ospite, per cui è necessario proseguire le terapie
immunosoppressive per un lungo periodo di tempo.
Il trapianto di midollo osseo allogenico a ridotta intensità (non mieloablativo)
Fino a pochi anni fa era opinione comune che la chemioterapia di preparazione al
trapianto allogenico, il cosiddetto regime di condizionamento, fosse un presupposto
indispensabile per distruggere le cellule tumorali dell’ospite e per fare spazio fisicamente
al nuovo midollo che veniva trapiantato. Questa visione relativamente semplicistica non
teneva conto del ruolo fondamentale che riveste il sistema immunitario del donatore; infatti
la dimostrazione dell’attività svolta dalle cellule immunocompetenti del donatore, infuse
con il trapianto, per il controllo e l’eradicazione delle cellule tumorali residue dell’ospite, ha
portato in questi ultimi anni ad un nuovo e affascinante concetto di allotrapianto con
riduzione di intensità dei protocolli di condizionamento, il cosiddetto allotrapianto a ridotta
intensità. E' un particolare tipo di trapianto caratterizzato dalla somministrazione di farmaci
ad attività prevalentemente immunosoppressiva e con una tossicità d’organo trascurabile,
o comunque ridotta rispetto ai regimi di condizionamento convenzionali. Lo scopo è quello
13
La Leucemia Linfatica Cronica – Guida per il Paziente
di permettere ugualmente un buon attecchimento delle cellule staminali allogeniche del
donatore, con un duplice risultato:
1) ridurre i rischi di tossicità e quindi di mortalità associata al trapianto
2) mantenere una buona efficacia terapeutica sulla patologia tumorale.
I dati più recenti mostrano come il trapianto di midollo osseo allogenico non mieloablativo
abbia sostanzialmente raggiunto questi obiettivi ed il suo impiego sta entrando nella
routine di numerosi centri ematologici di avanguardia. In effetti in questi ultimi anni la
procedura di allotrapianto a ridotta intensità è stata sempre più utilizzata, soprattutto in
considerazione dei minori effetti collaterali rispetto al trapianto allogenico convenzionale;
riducendo le complicanze legate alla procedura trapiantologica può quindi essere offerta
una possibilità di cura anche a pazienti anziani e pazienti più giovani con patologie
concomitanti (co-morbidità) per i quali il trapianto allogenico convenzionale può risultare
fortemente controindicato.
Il breve periodo di osservazione non ci consente di affermare che questa procedura darà a
lungo termine i risultati del trapianto allogenico convenzionale; al momento comunque
rappresenta un’opzione promettente per il trattamento di alcune neoplasie ematologiche
come la LLC, i linfomi ed il mieloma multiplo.
Il trapianto di midollo osseo allogenico da donatore da banca
Per ragioni genetiche, solo un terzo dei pazienti che hanno fratelli o sorelle possiede un
donatore familiare compatibile e può pertanto ricevere un trapianto di midollo osseo
allogenico. Nei rimanenti casi, qualora fosse presente l'indicazione ad un trapianto
allogenico, è possibile ricercare un donatore HLA identico nei Registri Internazionali dei
donatori di midollo osseo. Solo pazienti con determinate caratteristiche e con età inferiore
a 55 anni possono accedere ai Registri Internazionali dei donatori di midollo osseo.
Una volta individuato un potenziale donatore, evento che si verifica nel 50-70% dei casi,
può essere eseguito il trapianto, che, sostanzialmente, è del tutto simile a quanto già
descritto. Va tuttavia ricordato che nel caso di trapianto da donatore da banca esiste un
rischio più elevato di malattia da trapianto contro l'ospite, motivo per cui viene mantenuto
un maggiore livello di immunosoppressione. La ricerca del donatore richiede come minimo
un periodo di tempo variabile tra i 3 e i 6 mesi, pertanto la possibilità di utilizzare questa
opzione va considerata per tempo.
14
La Leucemia Linfatica Cronica – Guida per il Paziente
La donazione di cellule staminali
L'identificazione del potenziale donatore di cellule staminali viene eseguita mediante
l'analisi dell'HLA, con un banale prelievo di sangue al paziente ed ai suoi fratelli e sorelle.
Solo se l'HLA è uguale il rischio che si verifichino reazioni immunologiche incontrollate è
basso e pertanto il trapianto può essere fatto. I genitori non sono quasi mai HLA identici ai
figli e pertanto molto raramente vengono presi in considerazione per la donazione.
All'individuazione di un fratello o sorella HLA identici fa seguito una serie di esami volti a
valutare lo stato di salute del potenziale donatore e quindi la sua idoneità alla raccolta di
cellule staminali. In questo senso vengono eseguiti gli esami di legge che vengono
prescritti per chi dona sangue a tutela del ricevente e del donatore stesso. Solo una volta
che sia stato individuato un fratello o una sorella HLA identici al paziente e che sia stato
confermato lo stato di buona salute del potenziale donatore, si può procedere alla raccolta
delle cellule staminali. La donazione può essere fatta mediante espianto di midollo osseo
o tramite leucaferesi da sangue periferico.
Quando fare il trapianto di midollo osseo allogenico
L'indicazione all'esecuzione di un trapianto di midollo osseo allogenico dipende da
numerosi fattori. Innanzitutto l'età del paziente svolge un ruolo determinante, dal momento
che l'allotrapianto convenzionale ha come limite i 55 anni di età ed il trapianto non
mieloablativo i 65 anni. Va inoltre ricordato che, senza trapianto di midollo osseo
allogenico, la malattia è destinata quasi inevitabilmente a recidivare e pertanto i soggetti
giovani, con una lunga aspettativa di vita, sono i candidati ideali per questo tipo di
trapianto. La scelta dipende inoltre dalle caratteristiche di aggressività della malattia, dalla
risposta ai trattamenti e, non ultimo, dalla volontà del paziente, che deve essere
adeguatamente informato sui rischi e sui benefici della procedura. Solo da un'attenta
analisi di questi fattori può scaturire la decisione più adeguata per il paziente.
La terapia del paziente in recidiva
La LLC è una patologia cronica, che inizialmente risponde bene alle terapie ma che tende
a ripresentarsi nel tempo. Per questo motivo le recidive sono frequenti e, talora, di difficile
trattamento, poiché le cellule che ricompaiono sono normalmente meno sensibili ai
chemioterapici e di conseguenza ad ogni ricaduta è necessario modificare il tipo di
trattamento. E’ fondamentale quindi avere a disposizione un ampio ventaglio di
opportunità terapeutiche da utilizzare durante il decorso della malattia; fra questi
15
La Leucemia Linfatica Cronica – Guida per il Paziente
sicuramente la Fludarabina rappresenta il tipo di trattamento più efficace nelle ricadute
dopo terapia convenzionale con Clorambucile; la Fludarabina nei pazienti in ricaduta è
infatti in grado di ottenere una risposta globale del 60%, con circa un 15-20% di
remissione completa; il vantaggio di questo farmaco inoltre è rappresentato dal fatto che
può essere riutilizzato nell’indurre una nuova risposta nei pazienti ricaduti ma ancora
chemiosensibili.
Nei casi di LLC con prevalente interessamento linfonodale sono stati utilizzati con discreto
successo regimi polichemioterapici, di cui il ciclo CHOP rappresenta il capostipite; da un
recente
studio
randomizzato
francese
però
non
sembra
che
gli
schemi
di
polichemioterapia abbiano avuto un impatto significativo sulla sopravvivenza dei pazienti
con LLC.
Attualmente l’utilizzo prevalente dei farmaci chemioterapici avviene sotto forma di cicli
preparatori all’autotrapianto di midollo; tale utilizzo ha il duplice scopo di ridurre il più
possibile la massa tumorale e di permettere la raccolta delle cellule staminali che verranno
reinfuse nella fase finale del programma.
Attualmente nuovi impulsi alla ricerca in campo clinico sono stati suscitati dall’introduzione
degli anticorpi monoclonali (vedi paragrafo “Nuove terapie”), da soli o in combinazione con
la chemioterapia. Tali farmaci hanno infatti permesso di ottenere risposte anche complete
in pazienti pluritrattati.
Come si può evincere da queste righe non abbiamo a disposizione al momento un
approccio terapeutico standard in grado di garantire la guarigione dei pazienti affetti da
LLC; disponiamo però di numerosi farmaci che non solo sono in grado di tenere sotto
controllo il clone leucemico, ma permettono di ottenere in una elevata percentuale di casi
la remissione completa. E’ auspicabile pertanto che un approccio “palliativo” della LLC sia
in futuro soppiantato da protocolli clinici che utilizzano combinazioni di questi farmaci e di
altri nuovi composti attualmente in via di sperimentazione; l’obiettivo è infatti quello di
superare i meccanismi di resistenza delle cellule leucemiche nell’ottica di modificare la
storia naturale della malattia. Il fine ultimo è poter guarire o quanto meno ottenere
remissioni durature anche nei pazienti con malattia ricaduta.
La terapia di supporto
I nuovi regimi terapeutici e il miglioramento delle prospettive di vita hanno reso sempre più
importante la terapia di supporto nelle neoplasie ematologiche; in particolare nella LLC la
16
La Leucemia Linfatica Cronica – Guida per il Paziente
terapia di supporto deve essere modulata in rapporto alle specifiche complicanze che
possono presentarsi nel corso della malattia o durante i trattamenti chemioterapici, e sono
rappresentate sostanzialmente dalle citopenie e dalle infezioni.
La neutropenia, cioè la riduzione della conta di granulociti neutrofili, viene superata
attraverso la somministrazione sottocutanea del fattore di crescita granulocitario, un
farmaco che agisce stimolando il midollo osseo a produrre rapidamente e a rilasciare nel
sangue periferico i granulociti neutrofili, che sono le cellule principalmente coinvolte nella
risposta agli agenti infettivi.
Inoltre è fondamentale associare alle terapie di supporto un’adeguata profilassi infettiva
mediante l'impiego di farmaci ad azione antivirale ed antibatterica.
L’anemia invece, associata alla progressiva sostituzione del midollo da parte dei linfociti
leucemici o ai prolungati trattamenti chemioterapici, può essere corretta attraverso
l’iniezione periodica per via sottocutanea di eritropoietina o attraverso le trasfusioni.
Infine l’ipogammaglobulinemia, cioè la riduzione del numero di anticorpi naturali,
responsabile dell’immunodepressione associata alla malattia e quindi delle complicanze
infettive ricorrenti, viene solitamente corretta dalla somministrazione mensile di
immunoglobuline per via endovenosa.
.
Le nuove terapie
Recentemente la terapia della LLC ha avuto un ulteriore impulso dall’introduzione degli
anticorpi monoclonali; l’anticorpo che ha avuto finora maggior risalto è l’Alemtuzumab, una
proteina diretta contro l’antigene CD52, che è espresso ad alta densità su tutti i linfociti.
Viene somministrato per via endovenosa della durata di 2 ore, a dosi crescenti; non
presenta gli effetti collaterali della chemioterapia e questo è un grosso vantaggio per il
paziente, che pertanto non si ritrova a combattere quotidianamente con la nausea,
l’inappetenza, la stanchezza, la neutropenia, l’aspetto esteriore modificato dalla perdita dei
capelli. Essendo però un’immunoglobulina, può rendersi responsabile delle reazioni
avverse caratteristiche delle somministrazioni di proteine eterologhe, le più comuni delle
quali sono il rialzo termico accompagnato da brividi di freddo e una reazione orticarioide
caratterizzata da rash cutaneo; queste reazioni solitamente scompaiono dopo le prime
infusioni, per cui la somministrazione dell’anticorpo può essere effettuata in regime di DayHospital. Recentemente uno studio clinico internazionale ne ha anche dimostrato la
sicurezza nella somministrazione domiciliare per via sottocutanea, con ulteriori vantaggi
17
La Leucemia Linfatica Cronica – Guida per il Paziente
per il paziente, che pertanto non viene obbligato a ripetuti accessi ospedalieri durante il
trattamento con l’Alemtuzumab.
Per quanto riguarda gli effetti terapeutici, dopo una serie di studi pilota, volti a stabilire la
dose ottimale e la tossicità, sono stati condotti trials clinici per valutare l’efficacia
dell’Alemtuzumab, inizialmente in pazienti a cattiva prognosi, in recidiva o resistenti a
trattamenti con la Fludarabina; il trattamento ha evidenziato una risposta obiettiva in più
del 30% dei pazienti e ha contribuito a prolungare la durata della sopravvivenza.
I tentativi attuali sono pertanto rivolti all’introduzione dell’Alemtuzumab nel trattamento di
prima linea della LLC, specialmente dopo aver ottenuto uno stato di malattia minima
residua dopo terapia con fludarabina. Gli obiettivi di questi studi sono quelli di determinare
se l’aggiunta del Campath alla chemioterapia possa migliorare in maniera significativa le
percentuali di remissioni complete e la durata complessiva della sopravvivenza.
Gli altri scopi delle sperimentazioni attuali comprendono l’utilizzo dell’Alemtuzumab
nell’ambito di programmi che prevedano il trapianto autologo come agente per il purging o
per il trattamento della malattia minima residua dopo autotrapianto.
Un altro farmaco attualmente utilizzato nel trattamento della LLC è il Rituximab, un
anticorpo monoclonale diretto contro l’antigene CD20; sulla scorta della significativa
attività del Rituximab somministrato alla dose di 375 mg/m² settimanalmente (per 4
settimane) nel linfomi a basso grado di malignità, molti gruppi di ricerca hanno esplorato il
suo uso nella LLC. Le risposte ottenute, come singolo agente terapeutico, non sono state
così entusiasmanti come nei linfomi, verosimilmente per la bassa espressione
dell’antigene CD20 sui linfociti leucemici, mentre invece risultati favorevoli si sono
osservati in associazione alla chemioterapia; in effetti la combinazione del Rituximab con
la Fludarabina ha consentito di incrementare il tasso di Remissioni Complete, che
attualmente si attesta intorno al 50-60%.
In considerazione dei risultati promettenti è auspicabile pertanto che il Rituximab,
nonostante non possieda ancora l’indicazione ministeriale, possa in futuro essere
considerato come parte integrante del trattamento standard della LLC.
La profonda e protratta riduzione delle conte dei linfociti nel sangue periferico è invece la
ragione principale delle complicanze infettive precoci e tardive evidenziate nei pazienti
trattati con anticorpi monoclonali. Tra gli eventi infettivi più frequenti vanno segnalati quelli
di natura virale, in particolare il Citomegalovirus o da germi opportunisti quali lo
18
La Leucemia Linfatica Cronica – Guida per il Paziente
Pneumocystis Carinii. La regolare profilassi dei pazienti con farmaci antivirali (acyclovir) e
con cotrimoxazolo ha ridotto notevomente i rischi infettivi e quindi la tossicità associata alla
somministrazione degli anticorpi monoclonali.
Cosa offre l’U.O. di Ematologia dell'Istituto Nazionale dei Tumori di Milano
L'Unità di Ematologia e di Trapianto di Midollo Osseo dell'Istituto Nazionale Tumori di
Milano è particolarmente attiva nel trattamento della LLC. La terapia viene
personalizzata in base alle caratteristiche prognostiche della malattia e, a questo
proposito, l'Istituto offre un pannello completo di indagini, tra cui l'analisi citogenetica, la
FISH e le analisi di biologia molecolare sui geni delle immunoglobuline. Per quel che
riguarda la terapia, l'Istituto offre tutto lo spettro dei trattamenti disponibili, che spaziano
dalla chemioterapia convenzionale fino al trapianto di midollo osseo allogenico da
donatore da banca. Esiste inoltre un protocollo sperimentale di trapianto dedicato ai
pazienti ricaduti che hanno un familiare solo parzialmente identico a livello dei geni
dell'HLA.
Nei pazienti che sono candidati all'autotrapianto di midollo osseo l’obiettivo attuale è quello
di eliminare, o quanto meno ridurre il più possibile la contaminazione tumorale delle
raccolte di cellule staminali; per questo motivo sono in fase di attuazione protocolli clinici
che prevedono la mobilizzazione e la raccolta di cellule staminali periferiche sottoposte
alla procedura di purging in vivo con anticorpi monoclonali (anti-CD52 e anti-CD20).
Relativamente al trapianto di midollo osseo allogenico, vengono utilizzati differenti regimi
trapiantologici, spaziando dai protocolli convenzionali alle modalità più innovative che
prevedono l'impiego di regimi di condizionamento ben tollerati. Anche in questo caso, la
scelta del tipo di allotrapianto viene fatta in base alle caratteristiche della malattia di
ciascun paziente. Inoltre, l'impiego di protocolli innovativi che prevedono l'uso di nuovi
anticorpi per diminuire il rischio di malattia da trapianto contro l'ospite ha permesso di
ridurre l'incidenza di questa grave complicanza.
La pratica clinica è supportata da un laboratorio di ricerca la cui attività ha ricadute dirette
per il paziente, in primo luogo per quel che riguarda l'analisi molecolare per la ricerca del
DNA delle cellule malate (genomi tumorali), sia sui campioni di midollo che sulle
leucaferesi. E’ attualmente possibile infatti studiare in modo seriale e quantitativo la
malattia grazie ad una tecnica di biologia molecolare denominata “real-time PCR”. Essa si
avvale di sonde fluorescenti per marcare geni tumore specifici e consente di determinare il
numero esatto di genomi tumorali sulla base del confronto della quantità di fluorescenza
19
La Leucemia Linfatica Cronica – Guida per il Paziente
presente nel campione con quella rilevata in un sistema di riferimento contenente diluizioni
scalari del gene bersaglio.
Questa metodica rappresenta un progresso rispetto alla PCR tradizionale in quanto
permette non solo di rilevare una eventuale ripresa della malattia già a livello molecolare,
(quando cioè la malattia non è ancora visibile con gli esami strumentali di routine) ma
anche di seguirne l’andamento nel tempo; ciò consente di effettuare interventi terapeutici
mirati molto precoci, con sostanziali benefici sia in termini di risultati ottenuti che di
tossicità da terapia.
Infine, vengono garantiti tempi rapidi di accesso alle strutture ambulatoriali e di ricovero.
20
La Leucemia Linfatica Cronica – Guida per il Paziente
GLOSSARIO
Anticorpo
Gli anticorpi sono proteine prodotte dalle plasmacellule e sono deputati alla protezione
dell’individuo nei confronti di microbi quali batteri, funghi e virus. Gli anticorpi sono
distinguibili in 3 classi: classe A (IgA), classe G (IgG), classe M (IgM). Normalmente la
ripartizione delle varie classi anticorpali nel siero è la seguente: IgG 75%, IgA 15%, IgM
10%. Per quanto gli anticorpi di una singola classe siano molto simili, ciascun anticorpo
presenta una ben determinata specificità per un singolo tipo di microbo. In corso di LLC i
linfociti neoplastici si presentano anergici, cioè sono incapaci di produrre anticorpi efficaci
per combattere le infezioni provocate dai microrganismi patogeni.
Anticorpi monoclonali
Gli anticorpi monoclonali sono proteine prodotte in laboratorio, frutto della ricerca nel
campo dell’ingegneria genetica; più precisamente sono immunoglobuline umanizzate, e
cioè proteine animali modificate in laboratorio in maniera tale da renderle il più possibile
simili a quelle umane (minimizzando in questo modo i possibili effetti collaterali associati
alla loro infusione nell’organismo umano), ma nello stesso tempo mantengono una
diversità antigenica rispetto alle immunoglobuline umane. Gli anticorpi monoclonali sono in
grado di legarsi a bersagli specifici (in questo caso determinati antigeni espressi dai
linfociti); il complesso anticorpo-antigene-linfocita viene quindi riconosciuto come estraneo
dal sistema immunitario e attaccato provocando la morte della cellula (apoptosi).
Aspirato midollare
L’aspirato midollare è un esame che permette di ottenere un campione di sangue
midollare per analisi di vario tipo (morfologia, citogenetica, immunofenotipo, biologia
molecolare). Il prelievo del midollo viene eseguito in regime ambulatoriale, previa
anestesia locale, dalla cresta iliaca posteriore, all’incirca al margine superiore del gluteo.
In tutto la procedura ha una durata di circa 10-15 minuti, ma il tempo effettivamente
richiesto per la biopsia (inserimento dell’ago e aspirazione) è di 1 minuto. Se eseguito da
mani esperte, l’aspirato midollare non comporta un particolare dolore; l’unico momento in
cui è facile che il paziente avverta fastidio è rappresentato dall’aspirazione del midollo, una
fase che dura 10-30 secondi al massimo. L’intensità del dolore avvertito con l’aspirato
midollare è sicuramente inferiore a quello causato da un’estrazione dentaria. L’aspirato
midollare non lascia esiti e, dopo qualche minuto dal termine della manovra, il paziente
può camminare ed andare a casa. Di frequente, assieme all’aspirato midollare viene
eseguita la biopsia ossea. E’ importante che il paziente avverta il medico se è a
conoscenza di essere allergico agli anestetici locali.
Beta2microglobulina
Le plasmacellule producono e rilasciano in circolo la beta2microglobulina. Spesso, in
corso di LLC, i livelli sierici di beta2microglobulina sono più elevati rispetto al normale e si
è visto come i livelli sierici di beta2microglobulina siano un importante indicatore
dell’evolutività della malattia. Va ricordato tuttavia che l'esame non è assolutamente
specifico, poiché la beta2microglobulina viene prodotta anche da altri tipi cellulari ed i suoi
livelli possono aumentare in alcune condizioni fisiologiche come accade, ad esempio,
durante le infezioni.
21
La Leucemia Linfatica Cronica – Guida per il Paziente
Biopsia ossea
La biopsia ossea è una procedura che consente di prelevare dal bacino un piccolo cilindro
di osso, del diametro di pochi millimetri e della lunghezza di 1.5-2 cm. Il prelievo di osso
viene utilizzato per l’indagine istologica del midollo, che consente di osservare il midollo
osseo all’interno del tessuto osseo. Questo esame fornisce informazioni aggiuntive
all’indagine morfologica effettuata sul sangue midollare da aspirato. Il prelievo dell’osso
viene effettuato dalla cresta iliaca posteriore, all’incirca al margine superiore del gluteo. In
tutto la procedura ha la durata di circa 10-15 minuti, ma il tempo effettivamente richiesto
per la biopsia (inserimento dell’ago e recupero del prelievo) è di 1 minuto. La procedura
viene effettuata in regime ambulatoriale ed in anestesia locale. Se eseguita da mani
esperte, la biopsia ossea non comporta un particolare dolore; l’unico momento in cui è
possibile che il paziente avverta fastidio è rappresentato dall’estrazione della carota
ossea. L’intensità del dolore avvertito con la biopsia ossea è sicuramente inferiore a quello
causato da un’estrazione dentaria. La biopsia midollare non lascia esiti, eccetto una
cicatrice cutanea di 2-3 mm di diametro nel punto d’inserzione dell’ago. Dopo qualche
minuto dal termine della manovra, il paziente può camminare ed andare a casa. La biopsia
ossea viene frequentemente eseguita in concomitanza con l’aspirato midollare. Prima di
iniziare la procedura, e importante che il paziente avverta il medico se è a conoscenza di
essere allergico agli anestetici locali.
Catetere venoso centrale
Il catetere venoso centrale è costituito da un sottile tubicino di materiale plastico che,
passando attraverso la cute, viene posizionato all'interno di una grossa vena. Il catetere
venoso centrale permette quindi di somministrare con tranquillità farmaci irritanti, che, se
infusi per una vena del braccio, potrebbero dare origine a disturbi. Inoltre, una volta che
sia stato posizionato un catetere venoso centrale, è possibile mantenere a riposo tutte le
vene del paziente, dal momento che il catetere viene utilizzato sia per i prelievi che per le
terapie. Il posizionamento del catetere deve essere eseguito da mani esperte e
normalmente la procedura è effettuata dall'anestesista in regime di ricovero. Il catetere
può essere posizionato nella vena succlavia, ossia nella regione anteriore della spalla,
oppure nella vena giugulare, ossia nella regione laterale del collo, oppure in vena
femorale, ossia alla radice della coscia. La procedura di posizionamento dura circa 20
minuti, avviene in anestesia locale ed è scarsamente dolorosa. In una piccola percentuale
di casi si possono verificare delle complicanze, la principale delle quali è il pneumotorace,
cioè la comparsa di aria nel cavo pleurico. Qualora si verifichi un pneumotorace, si
rendono necessari particolari accorgimenti per rimuovere l'aria dal cavo pleurico.
Tralasciando i problemi da posizionamento, in verità assai rari, il principale inconveniente
dei cateteri venosi centrali è rappresentato dalle infezioni. La presenza di un tramite
attraverso la cute favorisce il passaggio di batteri dall'esterno ai tessuti profondi, favorendo
così l'insorgenza di infezioni. Le infezioni rappresentano infatti la principale causa di
rimozione dei cateteri venosi centrali. Mediamente un catetere venoso centrale permane in
sede per circa un mese. E' possibile utilizzare particolari tipi di cateteri studiati per durare
diversi mesi se non anni. Questi cateteri sono chiamati "tipo Groshong" oppure "port-acath" e, grazie a specifici accorgimenti, che peraltro ne rendono più difficoltoso il
posizionamento, hanno un rischio di infezione molto basso.
Cellule staminali
Le cellule staminali rappresentano i progenitori di tutte le cellule emopoietiche e, se
presenti in quantità adeguata, sono in grado di rigenerare ex novo un nuovo midollo
22
La Leucemia Linfatica Cronica – Guida per il Paziente
osseo. Le cellule staminali costituiscono una piccola frazione di tutte le cellule del midollo
osseo e possono essere prelevate per eseguire procedure di autotrapianto o allotrapianto.
Il prelievo può avvenire direttamente dal midollo osseo, con la procedura dell'espianto, o
prelevate dal sangue periferico con la leucaferesi.
Chemioterapia
La chemioterapia consiste nella somministrazione di farmaci antitumorali detti
chemioterapici. Esiste una grande varietà di farmaci chemioterapici e ciascuna classe di
questi composti è caratterizzata da specifiche caratteristiche. In generale i chemioterapici
vengono somministrati per via endovenosa e presentano una tossicità a breve termine ed
una tossicità a medio termine. La tossicità a breve termine consiste principalmente nella
comparsa di nausea e vomito. Attualmente sono disponibili dei farmaci estremamente
efficaci nel controllare questo disturbo, tuttavia esiste una variabilità individuale nella
sensibilità a questo effetto collaterale ed in alcuni casi, pur impiegando le terapie più
appropriate, non è possibile eliminarlo completamente. La tossicità a medio termine è
espressione del particolare meccanismo d'azione dei chemioterapici. Questi farmaci,
infatti, agiscono in generale colpendo la cellula tumorale non in quanto tale, ma in quanto
cellula che si suddivide rapidamente. Questo fa sì che i chemioterapici siano attivi non
solo nei confronti delle cellule tumorali, ma anche verso tutte le cellule dell'organismo che
si riproducono rapidamente e, quindi:
- midollo osseo
- cute
- mucose.
La tossicità a carico del midollo osseo consiste nella mancata produzione di globuli
bianchi, globuli rossi e piastrine per un periodo di tempo variabile a seconda dell'intensità
della chemioterapia effettuata. La carenza dei globuli bianchi favorisce l'insorgenza di
infezioni, la carenza di globuli rossi favorisce la comparsa di stanchezza e la carenza di
piastrine favorisce la comparsa di emorragie. In generale, la possibilità di potere
trasfondere globuli rossi e piastrine permette di ovviare ai disturbi dovuti alla mancanza di
queste componenti del sangue. Solitamente i globuli rossi vengono trasfusi quando i valori
di emoglobina sono inferiori a 8 gr/dL e le piastrine vengono trasfuse quando sono inferiori
a 10-15.000/mm3. Non è pratica abituale trasfondere i globuli bianchi e l'unico modo per
accelerarne il recupero spontaneo è costituito dalla somministrazione del fattore di crescita
leucocitario. Tuttavia, per un periodo di tempo variabile in relazione all'intensità della
chemioterapia, è possibile che i valori di globuli bianchi siano inferiori ai 500/mm3, livello al
di sotto del quale l'organismo presenta un rischio infettivo elevato. Per questo motivo le
infezioni rappresentano la principale complicanza in corso di chemioterapia.
La tossicità cutanea da chemioterapici si esprime principalmente nella caduta dei capelli e
dei peli (alopecia). Va detto che non tutti i cicli comportano questo effetto collaterale e che,
comunque, a distanza di qualche mese dal termine della chemioterapia, si ha la completa
ricrescita dei peli e dei capelli.
La tossicità alle mucose del tratto gastroenterico configura il quadro clinico denominato
mucosite, che è caratterizzato dalla presenza di dolore al cavo orale ed all'esofago, con
l'eventuale comparsa di aree di disepitelizzazione (perdita del rivestimento mucoso), e
dalla presenza di dolore intestinale e diarrea. L'intensità della mucosite è estremamente
variabile e, nella maggior parte dei cicli chemioterapici utilizzati per il trattamento della
LLC, non costituisce un reale problema. Nei casi più gravi di mucosite, quando il paziente
è impossibilitato ad alimentarsi per bocca, si ricorre alla nutrizione parenterale, ossia alla
somministrazione di nutrienti per via endovenosa.
23
La Leucemia Linfatica Cronica – Guida per il Paziente
Va infine fatto un cenno alla possibilità che i farmaci chemioterapici possano interferire con
la funzione delle ovaie. Le terapie ad alte dosi in particolare possono indurre sterilità con
perdita della funzione ovarica e, quindi, determinare l'insorgenza di menopausa. In questi
casi è pratica comune iniziare la terapia ormonale sostitutiva, in genere al termine dei cicli
di chemioterapia.
Citogenetica
L’esame citogenetico consente di visualizzare i cromosomi delle cellule del midollo.
Questo esame viene eseguito alla diagnosi a partire da sangue ottenuto mediante aspirato
midollare. La citogenetica fornisce importanti informazioni prognostiche. In particolare le
alterazioni a carico dei cromosomi 11 e 17 hanno un significato prognostico sfavorevole.
Queste informazione, integrate con quelle ricavate dagli altri esami, servono a valutare il
grado di aggressività della malattia e, quindi, aiutano il medico nella decisione terapeutica.
Citomegalovirus
Il Citomegalovirus è un virus estremamente diffuso nella popolazione italiana, in quanto il
90% degli individui ha avuto nella sua vita un contatto con questo agente patogeno.
L'infezione da Citomegalovirus determina un quadro clinico di tipo simil-influenzale ma la
principale caratteristica di questo virus è che, con la risoluzione della sintomatologia, si ha
la sua permanenza in forma latente nei globuli bianchi. In condizioni normali, il virus
rimane quiescente nell'organismo senza dare origine ad alcun disturbo. Nel caso di una
riduzione delle difese immunitarie si può avere una ripresa dell'attività proliferativa del
virus, non più controllato da un sistema immunitario efficiente. Questo evento accade nel
60% dei casi dopo allotrapianto di midollo osseo. Se non vengono iniziate per tempo le
cure adeguate, il Citomegalovirus è in grado di determinare una malattia che, in alcuni
casi, può essere letale. Fortunatamente esiste la possibilità di eseguire un monitoraggio
della ripresa dell'attività proliferativa virale, grazie ad un semplice esame del sangue.
Questo monitoraggio viene eseguito di routine due volte alla settimana nei primi 6 mesi
dopo trapianto. La terapia della riattivazione dell'infezione da Citomegalovirus consiste
nell'infusione di farmaci antivirali per via endovenosa. Solitamente è possibile
somministrare i farmaci in regime ambulatoriale o di Day Hospital per 5 giorni alla
settimana e la durata del trattamento è di circa un mese. Nella quasi totalità dei casi è
possibile ottenere la risoluzione dell'infezione virale prima che appaiano i sintomi della
malattia da Citomegalovirus. La riattivazione dell'infezione da Citomegalovirus rappresenta
quindi un evento comune dopo allotrapianto di midollo osseo, ma normalmente non si
traduce in un incremento della mortalità.
Esami del sangue
Gli esami del sangue che vengono eseguiti in caso di sospetto di Leucemia Linfatica
cronica normalmente comprendono:
- emocromo
- uricemia
- dosaggio IgG, IgA, IgM
- beta2microglobulina
- LDH
- Test di Coombs
- Ricerca anticorpi antipiastrine
24
La Leucemia Linfatica Cronica – Guida per il Paziente
Espianto di midollo osseo
L'espianto di midollo osseo è una procedura che consiste nel prelevare dal bacino una
quantità di sangue midollare, ricco in cellule staminali, in grado di rigenerare una nuova
emopoiesi una volta che siano state eseguite chemioterapie ad alte dosi con distruzione
totale del vecchio midollo. L'espianto di midollo viene eseguito in anestesia totale e,
tramite speciali aghi, viene aspirata una quantità di circa 800 cc di sangue midollare dalla
cresta iliaca posteriore superiore, ossia dal margine superiore della porzione posteriore del
bacino. La durata dell'espianto è di circa un'ora. La quantità di sangue prelevata è tale da
richiedere una trasfusione di globuli rossi al termine della procedura. Nel caso si tratti di un
donatore sano si ricorre normalmente a globuli rossi autologhi precedentemente
predepositati, al fine di evitare i rischi, sia pur remoti, da trasfusione.
In passato l'espianto di midollo osseo rappresentava la metodica di scelta per il prelievo di
cellule staminali in caso di autotrapianto. Attualmente nella gran parte di questi casi si
ricorre al prelievo di cellule staminali del sangue periferico. Per quel che riguarda la
donazione di midollo osseo dal donatore da banca, la procedura di prelievo di cellule
staminali viene ancora fatta mediante l'espianto di midollo.
Fattore di crescita granulocitario
Il fattore di crescita granulocitario è un farmaco in grado di stimolare i progenitori midollari
a produrre i globuli bianchi. In questo modo è possibile ridurre il periodo di maggiore
esposizione alle infezioni e, quindi, la tossicità da chemioterapia. Il fattore di crescita
granulocitario è una sostanza liquida che si somministra con una iniezione per via
sottocutanea una volta al giorno. Normalmente la somministrazione del fattore di crescita
viene sospesa una volta che i globuli bianchi hanno raggiunto un valore normale. Un'altra
importante funzione del fattore di crescita è quella di stimolare il passaggio delle cellule
staminali dal midollo al sangue periferico, dove possono poi essere raccolte mediante
procedure di leucaferesi.
FISH
La FISH (fluorescence in situ hybridization, ossia ibridazione in situ fluorescente) è una
nuova tecnica di citogenetica molecolare attraverso cui è possibile identificare tratti di
cromosoma rilevando anomalie piccolissime anche a carico di un singolo gene con
l’utilizzo di sonde fluorescenti (frammenti di DNA creati artificialmente e complementari a
sequenze cromosoma-specifiche). Attualmente la FISH si sta rivelando un’indagine
diagnostica di estrema utilità in campo oncoematologico, in quanto la maggior parte delle
neoplasie ematologiche presenta alterazioni genetiche o cromosomiche che sono
evidenziabili con la FISH; in particolare nella LLC lo studio citogenetico sulle cellule
tumorali ha lo scopo di identificare determinate anomalie cromosomiche che sono
associate ad una prognosi sfavorevole, cioè le delezioni del cromosoma 11, 17 e le
anomalie complesse.
HLA
Per poter eseguire un trapianto di midollo osseo allogenico è necessario un elevato grado
di compatibilità tra donatore e ricevente. Il grado di compatibilità tra i sistemi immunitari di
due individui viene determinato in base all'analisi dell'HLA. La valutazione dell'HLA viene
effettuata con un semplice esame del sangue e viene eseguita tra il paziente ed i suoi
fratelli e/o sorelle. La probabilità che due fratelli siano HLA identici è del 25%, e più alto è il
numero di fratelli e/o sorelle del paziente, più alta è la probabilità di trovarne uno HLA
25
La Leucemia Linfatica Cronica – Guida per il Paziente
identico. In genere l'allotrapianto di midollo osseo è possibile solo quando esista un grado
di identità assoluta tra donatore e ricevente, mentre solo in casi selezionati, ricorrendo a
particolari accorgimenti nel programma di immunosoppressione, è possibile eseguire un
allotrapianto in presenza di piccole differenze dell'HLA. I genitori ed i figli del paziente non
vengono abitualmente tipizzati, in quanto il loro grado di identità a livello dell'HLA è solo
del 50%, insufficiente per poter eseguire un trapianto convenzionale.
Leucaferesi
La leucaferesi è una procedura che permette di raccogliere cellule staminali emopoietiche
dalle vene delle braccia. In condizioni normali le cellule staminali si trovano nel midollo
osseo e per prelevarne una quantità sufficiente per un autotrapianto è necessario ricorrere
alla procedura dell'espianto di midollo. Grazie all'uso del fattore di crescita granulocitario è
possibile spostare le cellule staminali dal midollo osseo al sangue periferico. In questo
modo, ossia dopo un adeguato periodo di stimolazione del midollo con fattore di crescita
granulocitario, facendo ricorso alla procedura della leucaferesi è possibile prelevare cellule
staminali in grande quantità. La leucaferesi viene eseguita applicando un ago nella vena di
un braccio del paziente o del donatore; attraverso questo ago viene aspirata una certa
quantità di sangue che passa all'interno di una macchina, chiamata separatore cellulare. Il
separatore cellulare divide le cellule staminali dalle rimanenti componenti del sangue
sfruttando la forza centrifuga. Le cellule staminali vengono raccolte in una sacca sterile,
mentre la parte scartata viene reinfusa al paziente o al donatore attraverso un ago posto
nella vena dell'altro braccio. La procedura della leucaferesi ha la durata di circa 3-4 ore ed
è del tutto analoga a quanto avviene per la donazione di piastrine o di plasma. Qualora
non sia possibile raccogliere il quantitativo desiderato di cellule, si può ripetere la
procedura il giorno successivo. Grazie alla leucaferesi è possibile raccogliere una grande
quantità di cellule staminali, sufficiente per eseguire 1 o più trapianti. Rispetto alle cellule
staminali prelevate con l'espianto, quelle ottenute mediante leucaferesi permettono una
ricostituzione ematopoietica più rapida e pertanto sono preferibili.
Malattia da trapianto contro l’ospite
La malattia da trapianto contro l'ospite, o GVHD (dall'inglese graft-versus-host disease),
rappresenta la complicanza più comune del trapianto di midollo osseo allogenico e se ne
riconosce una forma acuta, che insorge entro i primi 100 giorni dopo il trapianto, ed una
forma cronica, che inizia dopo i 100 giorni. La probabilità che dopo trapianto compaia
GVHD, sia nella forma acuta che in quella cronica, è all'incirca del 50%. Questo disturbo
origina dalle differenze che esistono a livello dei meccanismi di riconoscimento del sé dei
sistemi immunitari del donatore e del ricevente. In corso di GVHD il sistema immunitario
del donatore riconosce come estranei i tessuti del ricevente e li attacca, determinando un
quadro clinico caratterizzato principalmente da eritema cutaneo, diarrea e disturbi del
fegato. Nella forma cronica, accanto a queste manifestazioni si possono avere disturbi
polmonari, secchezza agli occhi ed al cavo orale. La severità del quadro clinico della
GVHD viene graduata in base ad un punteggio da 1 a 4 per la forma acuta, mentre la
forma cronica si suddivide in "limitata" ed "estesa". La GVHD rappresenta una
complicanza potenzialmente fatale dell'allotrapianto e vengono effettuati molti sforzi per
prevenirla. La profilassi della GVHD consiste nella terapia immunosoppressiva, che viene
iniziata qualche giorno prima dell'allotrapianto e che, in seguito, viene proseguita per 4-8
mesi. Solitamente l'immunosoppressione viene eseguita con Ciclosporina, un farmaco che
può essere somministrato sia per via endovenosa, e questo di solito accade durante il
ricovero per trapianto, sia per bocca, come avviene dopo la dimissione del paziente. La
26
La Leucemia Linfatica Cronica – Guida per il Paziente
controparte positiva della GVHD è rappresentata dall'attacco da parte del sistema
immunitario del donatore delle cellule malate rimaste nel corpo del paziente dopo la
chemioterapia. Questo fenomeno, chiamato in inglese graft-versus-tumor, è infatti il
principale responsabile dell'elevata capacità curativa dell'allotrapianto. Il risultato finale
dell'allotrapianto dipende, in definitiva, da un sottile equilibrio tra l'azione tossica del
sistema immunitario del donatore, espressa clinicamente dalla GVHD, e dall'azione
antitumorale dello stesso, costituita dall'effetto graft-versus-tumor.
Purging
L'autotrapianto di midollo rappresenta uno dei trattamenti in grado di garantire un elevato
tasso di remissioni complete, tuttavia il numero di recidive a distanza di tempo dal
trapianto è elevato. Una delle possibili cause che concorrono alla ripresa di malattia dopo
questa terapia è rappresentato dalla possibilità che le cellule staminali che si infondono al
momento dell'autotrapianto siano contaminate da cellule tumorali. Allo scopo di ridurre il
rischio di recidiva si è cercato di ripulire (in inglese purging) le cellule da infondere
dall'eventuale quota di cellule tumorali residue. Inizialmente sono state sperimentate le
cosiddette metodiche di purging in vitro, che consistono nell’eliminazione, attraverso
procedure di laboratorio, delle cellule tumorali dalla componente di cellule staminali che
verranno poi reinfuse; tale metodica però si è dimostrata costosa e con pochi benefici
clinici, in quanto a tutt’oggi non è ancora stata dimostrata la sua superiorità rispetto alle
procedure “purging-free”; pertanto è stata progressivamente sostituita dal purging in vivo,
che consiste nella somministrazione di anticorpi monoclonali (anti-CD20 o anti-CD52)
nella fase immediatamente precedente la leucaferesi, in modo tale da ottenere raccolte di
cellule staminali purificate dalla componente tumorale.
Remissione completa
Per remissione completa s’intende la scomparsa dei segni clinici e laboratoristici di
malattia. In sostanza, quando un paziente è in remissione completa non sono più presenti
segni di attività della malattia nell’organismo. Qualora sia possibile individuare il marcatore
molecolare dei linfociti leucemici, cosa che accade per il 70% dei pazienti, si può ricercare
la presenza di cellule tumorali residue nell’organismo con un grado di sensibilità che è di
circa mille volte superiore rispetto alle metodiche di indagine convenzionali (cioè esami del
sangue, morfologia dell'aspirato midollare e istologia della biopsia ossea). La negatività
del marcatore molecolare viene chiamata remissione molecolare. Il raggiungimento di una
remissione molecolare ha una grande importanza nel predire la possibilità di vivere per un
lungo periodo senza ripresa di malattia. Esistono casi in cui la chemioterapia è stata
efficace ma non ha permesso di far scomparire del tutto i segni di malattia: si parla allora
di raggiungimento di una remissione parziale. La valutazione dello stato di remissione
viene eseguita normalmente al termine delle chemioterapie.
Remissione molecolare
I linfociti della LLC sono provvisti di un marcatore molecolare, ossia di una specifica
"etichetta" a livello del DNA, che permette di rintracciare la presenza di una piccola
quantità di cellule malate in mezzo ad un grande numero di cellule sane. Non tutti i
pazienti affetti da LLC hanno un marcatore molecolare ben riconoscibile. Con le metodiche
attuali è possibile individuare il marcatore molecolare circa nel 70% dei casi e, solo in
questi pazienti, è possibile riconoscere la presenza di una cellula tumorale tra 10000-
27
La Leucemia Linfatica Cronica – Guida per il Paziente
100000 cellule sane. Questa elevata sensibilità rappresenta un ulteriore progresso rispetto
alle metodiche d'indagine tradizionale, che consentono di individuare solo una cellula
malata tra 100 cellule sane. L'analisi molecolare è particolarmente utile nella valutazione
dei pazienti che sono stati sottoposti a trapianto di midollo osseo allogenico, in quanto, in
questo contesto il riscontro di una negatività molecolare consente di identificare una
popolazione di pazienti a bassissimo rischio di ricaduta. Inoltre, la comparsa di una
positività molecolare dopo un periodo prolungato di negatività molecolare permette di
prevedere con un largo margine di anticipo una ricaduta clinica e, in linea teorica,
consente di iniziare precocemente le terapie appropriate, aumentandone la probabilità di
successo e riducendo i rischi per il paziente.
Tossicità midollare
I farmaci chemioterapici colpiscono le cellule tumorali non in quanto cellule malate, ma in
quanto cellule rapidamente proliferanti. Questo meccanismo d'azione fa sì che, oltre alle
cellule tumorali, i chemioterapici colpiscano anche le altre cellule dell'organismo che sono
provviste di un'elevata attività proliferativa. In particolare le cellule del midollo osseo sono
particolarmente esposte all'azione dei chemioterapici ed uno degli effetti collaterali più
comuni di queste terapie è proprio rappresentato dalla tossicità midollare, che, in alcuni
casi, può limitare la dose di farmaco che è possibile somministrare. La tossicità al midollo
osseo consiste nella mancata produzione di globuli bianchi, globuli rossi e piastrine per un
periodo di tempo variabile a seconda dell'intensità della chemioterapia effettuata. La
carenza dei globuli bianchi favorisce l'insorgenza di infezioni, la carenza di globuli rossi
favorisce la comparsa di stanchezza e la carenza di piastrine favorisce la comparsa di
emorragie. In generale, la possibilità di potere trasfondere globuli rossi e piastrine
permette di ovviare ai disturbi dovuti alla mancanza di queste componenti del sangue.
Solitamente i globuli rossi vengono trasfusi quando i valori di emoglobina sono inferiori agli
8 gr/dL e le piastrine vengono trasfuse quando sono inferiori alle 10000/mm3. Non è
pratica abituale trasfondere i globuli bianchi e l'unico modo per accelerare il recupero
spontaneo è costituito dalla somministrazione di fattore di crescita. Tuttavia, per un
periodo di tempo variabile in relazione all'intensità della chemioterapia, è possibile che i
valori di globuli bianchi siano inferiori ai 500/mm3, livello al di sotto del quale l'organismo è
più esposto alle infezioni. Le infezioni rappresentano infatti il principale problema in corso
di chemioterapia.
28