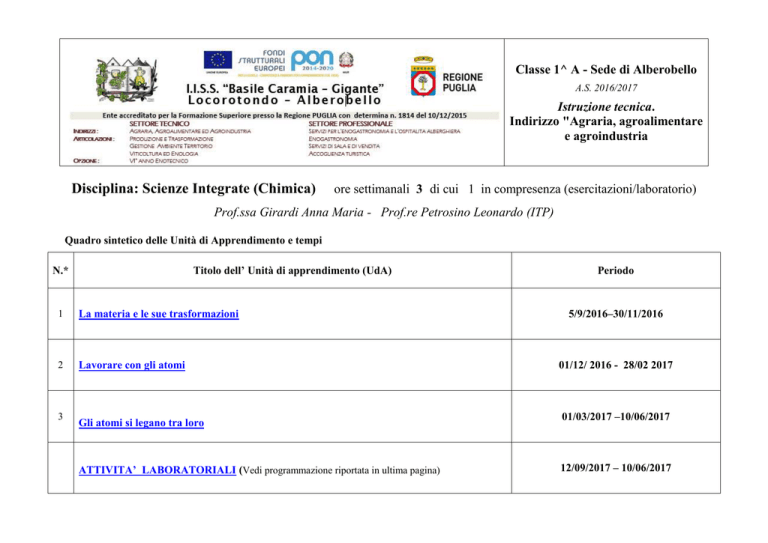
Classe 1^ A - Sede di Alberobello
A.S. 2016/2017
Istruzione tecnica.
Indirizzo "Agraria, agroalimentare
e agroindustria
Disciplina: Scienze Integrate (Chimica)
ore settimanali 3 di cui 1 in compresenza (esercitazioni/laboratorio)
Prof.ssa Girardi Anna Maria - Prof.re Petrosino Leonardo (ITP)
Quadro sintetico delle Unità di Apprendimento e tempi
Titolo dell’ Unità di apprendimento (UdA)
N.*
1
La materia e le sue trasformazioni
2
Lavorare con gli atomi
3
Gli atomi si legano tra loro
ATTIVITA’ LABORATORIALI (Vedi programmazione riportata in ultima pagina)
Periodo
5/9/2016–30/11/2016
01/12/ 2016 - 28/02 2017
01/03/2017 –10/06/2017
12/09/2017 – 10/06/2017
UdA 1 – Titolo: La materia e le sue trasformazioni
Progettazione Macro
Competenza/e
Osservare,descrivere e
analizzare fenomeni
appartenenti alla realtà
naturale e artificiale e
riconoscere nelle varie
forme i concetti di sistema
e di complessità.
Abilità
Conoscenze
Eseguire semplici misure dirette ed
indirette.
Discipline
concorrenti
Misure e grandezze
Stati fisici della materia e passaggi di
stato
Distinguere le grandezze estensive da
quelle intensive
I gas: modello particellare e teoria
cinetica
Progettare semplici investigazioni
Trasformazioni chimiche della materia:
elementi e composti; legge dei rapporti
Descrivere la differenza tra
trasformazione chimica e trasformazione ponderali di combinazione
fisica
Strumenti di misura: vetreria e bilance.
Fisica
Registrare i dati sperimentali
Distinguere un elemento da un composto Miscugli omogenei ed eterogenei
Osservare, descrivere e
analizzare quantitativamente e
qualitativamente alcune
proprietà macroscopiche della
materia
Disciplina
di
riferimento
Applicare le leggi ponderali della
materia
Distinguere tra miscuglio omogeneo e
miscuglio eterogeneo
2
Chimica
Scienze
della Terra
e biologia
Scienze e
tecnologie
applicate
UdA 1 – Titolo: La materia e le sue trasformazioni
Progettazione Micro
Compito assegnato agli studenti
Processo di lavoro
n.
Titolo
Contesto
Attività docente
Metodologia
Prestazioni studenti
Guida gli studenti alla
comprensione e all’applicazione
delle unità di misura delle
grandezze fisiche
Lezione dialogata ed
esperienze di laboratorio
Prende appunti; scrive sintesi; espone
oralmente; riconosce gli strumenti di misura
del laboratorio di chimica
1
Misure e grandezze.
Strumenti di misura
Aula e
laboratorio
di chimica
2
Stati fisici della
materia
Aula e
laboratorio
di chimica
Guida gli studenti nella
comprensione e nella
osservazione degli stati fisici della
materia e dei passaggi di stato
Lezione dialogata ed
esperienze di laboratorio
Prende appunti; scrive sintesi; espone
oralmente; esegue esperienze in laboratorio;
elabora dati e costruisce grafici
3
Modello particellare e
teoria cinetica dei gas
Aula e
Illustra alcune leggi fondamentali
laboratorio dei gas e le utilizza per prevedere
di chimica il loro comportamento
Lezione dialogata ed
esperienze di laboratorio
Prende appunti; scrive sintesi; espone
oralmente; esegue esperienze di laboratorio
4
Trasformazioni
chimiche e leggi dei
rapporti ponderali
Aula e
Illustra le leggi dei rapporti
laboratorio ponderali e le applica in
di chimica laboratorio
Lezione dialogata ed
esperienze di laboratorio
Prende appunti; scrive sintesi; espone
oralmente; esegue esperienze di laboratorio
5
Elementi e composti.
Miscugli omogenei ed
eterogenei
Aula e
Guida all’identificazione di un
laboratorio elemento, di un composto e di un
di chimica miscuglio
Lezione dialogata ed
esperienze di laboratorio
Prende appunti; scrive sintesi; espone
oralmente; esegue esperienze di laboratorio
Modalità di accertamento delle abilità e delle conoscenze dell’UdA
Le verifiche verranno realizzate con:
- interrogazioni (individuali, programmate ed estemporanee); -prove oggettive (somministrate contemporaneamente a tutta la classe); - redazione di elaborati (individuali);prove pratiche tese all’accertamento non solo di capacità manuale, ma anche di una acquisita metodologia di lavoro.
3
UdA 2 –Titolo: Lavorare con gli atomi
Progettazione Macro
Competenza/e
Abilità
Osservare,descrivere
e
analizzare
fenomeni appartenenti alla realtà
naturale e artificiale e riconoscere nelle
varie forme i concetti di sistema e di
complessità.
Utilizzare la quantità chimica come ponte tra
le particelle microscopiche e i sistemi
macroscopici .
Conoscenze
Identificare le diverse
specie chimiche sulla base
degli elementi costitutivi;
risolvere calcoli con le
moli;
utilizzare la mole per
esprimere
la
concentrazione
di
soluzioni;
Modello atomico di
Dalton;
prepara
soluzioni
a
concentrazione
molare
nota;
calcoli con le moli;
definire il significato di
reazione chimica;
riconoscere i fenomeni che
si manifestano in alcune
reazioni chimiche;
eseguire pesate molari.
4
Disciplina di
riferimento
Discipline
concorrenti
i composti e le leggi della
chimica;
gli isotopi degli elementi;
la massa atomica;
unità di misura dei
chimici;
relazione tra mole, massa e Chimica
volume di gas;
sostanze in soluzione : la
concentrazione molare;
equazioni chimiche,
bilanciamento e calcoli
stechiometrici.
Scienze e
tecnologie
applicate
UdA 2 –Titolo: Lavorare con gli atomi
Progettazione Micro
n.
Titolo
1
Le prime
teorie sulla
struttura
atomica
Contesto
Attività docente
Metodologia
Prestazioni studenti
Aula e LIM
Illustra il modello atomico di Dalton e guida
gli studenti alla conoscenza delle particelle
subatomiche e alle relative connessioni.
Lezione
dialogata ed
esperienze di
laboratorio
Prende appunti; rappresenta con disegni; scrive
sintesi; espone oralmente;
2
L’unità di
misura dei
chimici: la
mole
Aula e
laboratorio di
chimica
Guida gli studenti a comprendere il passaggio
dai grammi alle moli e viceversa e le applica
nel laboratorio.
Lezione
dialogata ed
esperienze di
laboratorio
Prende appunti; scrive sintesi; espone oralmente;
esegue pesate molari in laboratorio; prepara
soluzioni; converte le unità di misura.
3
Le equazioni
chimiche
Aula e
laboratorio di
chimica
Illustra i fenomeni connessi alle reazioni
chimiche con esperimenti di laboratorio e
guida all’utilizzo della mole come unità di
misura.
Lezione
dialogata ed
esperienze di
laboratorio
Prende appunti; scrive sintesi; espone oralmente;
esegue esperienze di laboratorio
Modalità di accertamento delle abilità e delle conoscenze dell’UdA
Le verifiche verranno realizzate con:
- interrogazioni (individuali, programmate ed estemporanee);
- prove oggettive (somministrate contemporaneamente a tutta la classe);
- redazione di elaborati (individuali).
5
UdA 3 – Titolo: Gli atomi si legano tra loro
Progettazione Macro
Competenza/e
Abilità
Osservare,descrivere e analizzare
fenomeni appartenenti alla realtà
naturale e artificiale e riconoscere
nelle varie forme i concetti di
sistema e di complessità.
Ricavare attraverso la struttura
elettronica a livelli e con l’ausilio
della tavola periodica, la formula
chimica corretta ed il nome dei
composti inorganici.
Conoscenze
spiegare come attraverso lo studio delle
energie di ionizzazione è possibile
costruire il modello a gusci;
Discutere lo sviluppo storico del concetto
di periodicità;
Essere in grado di spiegare la relazione fra
struttura elettronica e posizione degli
elementi sulla tavola periodica;
Descrivere le principali proprietà
periodiche che confermano la struttura a
strati dell’atomo;
Scrivere correttamente la formula chimica;
Classificare i composti chimici in base ai
costituenti e alle proprietà chimiche;
Attribuire il nome ad un composto
applicando le regole della nomenclatura
classica e IUPAC.
6
Disciplina
di
riferimento
Discipline
concorrenti
Chimica
Fisica
- L’atomo di Bohr e i livelli
energetici degli elettroni;
- configurazione elettronica e tavola
periodica;
- periodicità delle proprietà atomiche;
- capacità di combinarsi degli atomi;
-nomenclatura tradizionale e IUPAC
dei composti.
UdA 3 – Titolo: Gli atomi si legano tra loro
Progettazione Micro
n.
1
2
3
Titolo
La moderna
teoria atomica
La tavola
periodica
Contesto
Aula e LIM,
laboratorio di
chimica
Aula e
LIM
La nomenclatura
Aula e LIM
dei composti
Attività docente
Metodologia
Prestazioni studenti
Illustra il modello atomico di Bohr e
guida gli studenti alla costruzione delle
struttura elettronica dei principali
elementi.
Metodo induttivo e deduttivo.
Didattica Breve: approccio soprattutto
concettuale. Tecniche didattiche: brevi
lezioni frontali, studio guidato.
Prende appunti; rappresenta
con disegni; scrive sintesi;
espone oralmente;
Spiega la relazione tra struttura
elettronica e la posizione degli elementi
sulla tavola periodica. Descrive le
principali proprietà periodiche che
confermano la struttura a strati
dell’atomo.
Metodo induttivo e deduttivo.
Didattica Breve: approccio soprattutto
concettuale. Tecniche didattiche: brevi
lezioni frontali, studio guidato.
Prende appunti; rappresenta
con disegni; scrive sintesi;
espone oralmente;
Illustra le regole della nomenclatura
IUPAC e tradizionale per scrivere le
formule dei composti e guida alla
comprensione ed applicazione delle
suddette regole.
Metodo induttivo e deduttivo.
Didattica Breve: approccio soprattutto
concettuale. Tecniche didattiche: brevi
lezioni frontali, studio guidato.
Prende appunti; rappresenta
con disegni; scrive sintesi;
espone oralmente;
Modalità di accertamento delle abilità e delle conoscenze dell’UdA
Le verifiche verranno realizzate con:
- interrogazioni (individuali, programmate ed estemporanee);
- prove oggettive (somministrate contemporaneamente a tutta la classe);
- redazione di elaborati (individuali).
7
Unità didattica laboratoriale
N.
obiettivi
Modulo di riferimento
1°
La materia e le sue
trasformazioni
2°
Lavorare con gli atomi
Gli atomi si legano tra loro
3°
Periodo*
Riconoscere l’attrezzatura e gli strumenti; avere rispetto delle norme di sicurezza
in laboratorio.
Misurare la massa e il volume di corpi solidi e liquidi .
Determinare la densità.
Misurare la temperatura .
Applicare le diverse tecniche di separazione dei miscugli:
SET - NOV
o filtrazione; evaporazione del solvente; cristallizzazione del solfato rameico.
o Distillazione; decantazione; centrifugazione .
o Cromatografia su carta.
Distinguere i miscugli dai composti (zolfo e ferro: da miscuglio a composto)
video da internet sulle sostanze pure e miscugli.
Preparazione di un nuovo materiale.
Riconoscere i fenomeni che si osservano nelle reazioni chimiche (sviluppo di gas,
cambiamento di colore, formazione di precipitati).
Applicare la conservazione della massa nelle reazioni chimiche.
Verificare la legge delle proporzioni costanti.
NOV - FEB
Contare per moli: pesate molari.
Saggi alla fiamma
Vedere una videocassetta sul sistema periodico; video da internet sulla formazione
dei legami.
MAR-GIUG
Preparare soluzioni a titolo noto.
Verificare la variazione della solubilità di una sostanza al variare della
temperatura. video da internet sulla solubilizzazione dei soluti.
TOTALE ORE DI ESERCITAZIONE
8
Ore
12
11
10
33
9









