89
Attualità
Recenti Prog Med 2013; 104: 89-92
La malattia di Paget: a proposito di nuove strategie terapeutiche
Massimo D’Amore1, Sabrina Lisi2, Margherita Sisto2, Anna Valentina De Marino1
Riassunto. Il morbo di Paget è un’osteopatia, ad eziologia
sconosciuta, caratterizzata da alterazione focale del rimodellamento osseo in cui la normale architettura viene sostituita da un tessuto osseo non organizzato, con tendenza alla deformità. La diagnosi è posta nella maggior parte dei casi in maniera del tutto casuale, in quanto solo il 5% dei pazienti accusa dolore urente a livello dei segmenti ossei coinvolti. Accanto all’utilizzo di farmaci anti-riassorbitivi come i
bisfosfonati e la calcitonina, appare razionale, tenendo presente la patogenesi della malattia, l’utilizzo di denosumab
e tocilizumab sia per inibire (con il primo) il RANKL e quindi l’osteoclastosi, sia per inibire (con il secondo) l’interleuchina-6 responsabile del dolore.
Paget’s disease of bone: new therapeutic strategies.
Parole chiave. Denosumab, malattia di Paget, tocilizumab.
Key words. Denosumab, Paget’s disease, tocilizumab.
Introduzione
Eziopatogenesi
Il morbo di Paget, descritto per la prima volta
da sir James Paget nel 1877, è un’osteopatia caratterizzata da un’alterazione focale del rimodellamento osseo in cui la normale architettura viene
sostituita da un tessuto osseo non organizzato, con
tendenza alla deformità1.
I dati epidemiologici disponibili a riguardo della malattia sono assai variabili nelle diverse aree
geografiche: in Europa la prevalenza della malattia è maggiore in Inghilterra (intorno al 5%) e minore nell’area mediterranea. In Italia la prevalenza delle forme sintomatiche è valutata attorno
all’1%. È per lo più diagnosticata in soggetti di età
>50 anni, con un’incidenza che aumenta con l’età,
e presenta una maggiore prevalenza nel sesso maschile con un rapporto di 2:1.
Gran parte dei soggetti con malattia di Paget
sono del tutto asintomatici: solamente il 5% di essi accusa dolore urente a livello delle ossa coinvolte. Nella maggior parte dei casi la diagnosi è posta
in maniera del tutto casuale, a seguito di indagini
radiografiche ed ematochimiche programmate per
altri motivi2.
L’eziologia è tuttora sconosciuta. Numerosi
studi epidemiologici suggeriscono una predisposizione familiare nel 15-30% dei pazienti. È stato
calcolato che i familiari di primo grado di pazienti affetti da osteopatia pagetica hanno una probabilità di sviluppare la malattia 7 volte maggiore
rispetto ai pazienti con familiarità negativa. La
modalità di trasmissione è autosomica dominante con penetranza incompleta per la presenza di
pochi individui affetti. I risultati genetici, ottenuti
dall’analisi di linkage in alcune famiglie pagetiche, hanno identificato un locus nel braccio lungo
del cromosoma 18 (18q21-22). Il possibile gene a
livello di questa regione cromosomica potrebbe essere il gene codificante il RANK, il recettore per il
RANK ligando (RANKL), coinvolto nel turnover
osseo.
È noto che gli osteoclasti pagetici presentano
una risposta esuberante a stimoli che abitualmente inducono la loro differenziazione e attivazione:
ciò è stato evidenziato prima di tutto con il
RANKL, cioè con la molecola che è fisiologicamente deputata a controllare l’osteoclastogenesi3.
Summary. Paget’s disease of bone is a chronic disorder
of unknown etiology that can result in enlarged and misshapen bones. The excessive breakdown and formation
of bone tissue cause affected bones to weaken, resulting
in pain, misshapen bones, fractures, and arthritis in the
joints. In most cases the diagnosis is achieved casually,
as only 5% of patients develop burning pain at the level
of affected bones. As regards therapy, the use of anti-reabsorbing drugs, such as bisphosphonates and calcitonin, appears reasonable. Given the disease pathogenesis, the administration of denosumab and tocilizumab
may be a valuable alternative to inhibit RANK expression,
and thus osteoclast formation, and interleukin-6 production.
1Sezione di Reumatologia, Dipartimento Interdisciplinare di Medicina, Policlinico, Bari; 2Dipartimento di Scienze Mediche di Base,
Università Aldo Moro, Bari.
Pervenuto il 19 settembre 2012.
90
Recenti Progressi in Medicina, 104 (3), marzo 2013
Il RANKL è una proteina transmembrana prodotta dagli osteoblasti e dai loro precursori stromali. Questa proteina agisce dopo connessione con il
RANK, suo specifico recettore presente nei preosteoclasti e negli osteoclasti maturi. Tale interazione dà luogo all’attivazione degli osteoclasti maturi, la differenziazione dei precursori degli osteoclasti. Gli osteoblasti producono anche un inibitore
del RANKL chiamato osteoprotegerina che agisce
come falso recettore. In condizioni che favoriscono
il riassorbimento osseo, l’osteoprotegerina è soppressa e quindi il RANK si lega al suo recettore, favorendo l’attività riassorbitiva degli osteoclasti4-6.
Contraddittori sono risultati gli studi sul coinvolgimento del sistema di istocompatibilità HLA.
Recenti osservazioni hanno evidenziato la presenza
di mutazioni del gene del sequestroma 1 (SQSTM1)
a livello del locus cromosomico 5q35 nel 10-15% dei
pazienti affetti da Paget sporadico e nel 30-40% dei
pazienti affetti da Paget familiare. L’SQSTM1 codifica una proteina p62 importante nell’osteoclastogenesi. Questa mutazione danneggia la capacità
della proteina p62 di veicolare le proteine legate all’ubiquitina per essere degradate, causando un aumento dell’osteoclastogenesi ed una predisposizione alla malattia7.
L’eterogeneità genetica è dimostrata dal rilievo
di altre regioni cromosomiche, sottolineando la probabilità che più geni siano coinvolti nell’osteopatia
pagetica. Oltre all’eziologia genetica, occorre sottolineare un’ipotetica eziologia virale supportata sin
dagli anni ’70 dal riscontro di inclusi simil-virali negli osteoclasti dell’osso pagetico. Questi inclusi ricordano i capsidi virali della famiglia dei paramixovirus (virus del morbillo e del cimurro canino)8.
Particelle virali suggestive del nucleocapside dei
paramixovirus sono state riscontrate nel citoplasma e nel nucleo degli osteoclasti. Sono stati identificati, inoltre, elementi di trascrizione genomica
del virus del morbillo nelle unità cellulari formanti colonie granulocitarie e monocitarie, nei preosteoclasti e in cellule mononucleate periferiche di
pazienti affetti da questa malattia. L’ipotesi più
probabile è che il virus abbia come bersaglio l’osteoblasto e successivamente colpisca l’osteoclasto, anche se le componenti virali sono state riscontrate in
quest’ultimo e recentemente anche negli osteoblasti e negli osteociti. L’RNA virale, inoltre, stimola
la produzione di interleuchina-6 da parte delle cellule infettate. Questa citochina viene prodotta in
grandi quantità dagli osteoblasti, stimola il reclutamento degli osteoclasti e il riassorbimento osseo
ed è in parte responsabile del dolore9.
Infine occorre segnalare come una dieta priva
di calcio e l’esecuzione di movimenti meccanici ripetitivi possano fungere da trigger per l’insorgenza della malattia10.
Fisiopatologia
A seguito di un difetto degli osteoclasti, aumentati per numero, per quantità dei nuclei, per cellu-
la e dimensioni, si riscontra un aumentato riassorbimento osseo cui fa seguito un’esuberante neoformazione.
Nel Paget si possono distinguere tre fasi: I fase
(fase osteolitica) caratterizzata da un aumento del
riassorbimento osseo e della vascolarizzazione delle ossa coinvolte; II fase (fase osteosintetica) caratterizzata da un aumento con anomala neoformazione ossea; III fase (fase sclerotica) in cui l’osso riccamente vascolarizzato è sede di un aumento
dell’attività metabolica, ma con scarsa efficienza
biomeccanica.
Le alterazioni dell’osso pagetico determinano:
compressione delle strutture che decorrono al suo
interno; tendenza dell’osso a deformarsi; aumento
del rischio di fratture (fratture a pezzo di gesso);
osteoartrosi secondaria.
All’esame istologico l’osso pagetico assume un
aspetto disordinato, una vera e propria follia metabolica della matrice, assumendo il classico aspetto a mosaico definito “woven bone”.
Clinica
La malattia può manifestarsi con lesioni a carico di un solo segmento osseo (monostotica) oppure,
più frequentemente, a livello di più ossa (oligostotica e poliostotica) con interessamento in modo particolare della colonna lombare, del bacino e del femore, ma con possibile coinvolgimento, in maniera
asimmetrica, di ogni altro segmento scheletrico.
La sintomatologia, presente peraltro in una minoranza dei soggetti pagetici, è rappresentata da
dolore aspecifico legato a vari fattori: stiramento
periostale, presenza di fratture complete e/o incomplete (fissurazione ossea), aumento della vascolarizzazione delle lesioni pagetiche, stiramento
delle terminazioni nervose ed aumento dell’interleuchina-6.
Clinicamente si riscontrano le deformazioni
scheletriche localizzate a livello: del cranio (protuberanza delle bozze frontali); degli arti, del volto,
della tibia (con la tipica deformazione a sciabola).
L’ingrossamento delle ossa craniche può causare: ipoacusia monolaterale per costrizione dell’ottavo nervo cranico, alterazioni del visus e dei muscoli estrinseci dell’occhio per costrizione del secondo e sesto nervo, cefalea, sindromi cerebellari;
disturbi cognitivi; compressione del tronco encefalico con conseguente idrocefalo, ipertensione endocranica ed edema papillare, facies leonina ed incremento volumetrico del cranio (leontiasi ossea).
L’interessamento dei corpi vertebrali può causare compressione sul midollo e/o sulle radici nervose. Tale interessamento può comportare disturbi sfinteriali, alterazione del trofismo muscolare
parestesie, alterazioni motorie, fino nei casi più
gravi a paraplegia e tetraparesi.
L’interessamento degli arti può provocare disturbi della deambulazione, disturbi dovuti ad
un’accentuata curvatura di una tibia o del femore
con conseguente zoppia.
M. D’Amore et al.: La malattia di Paget: a proposito di nuove strategie terapeutiche
Le complicanze possono essere frequenti e gravi.
Nel paziente pagetico si possono riscontrare le
fratture del tipo a pezzo di gesso che possono richiedere anche interventi chirurgici. L’ipervascolarizzazione dell’osso pagetico rende calda la cute
sovrastante e nei casi di un interessamento poliostotico l’aumento del flusso ematico e le anastomosi artero-venose determinano uno scompenso
cardiaco ad alta gittata. I pazienti pagetici possono presentare anche calcificazioni vascolari e valvolari.
La complicanza più temibile è la degenerazione
sarcomatosa (osteosarcoma, fibrosarcoma e condrosarcoma), che avviene in meno dell’1% dei pazienti. Essa si manifesta raramente prima dei 70
anni e deve essere sospettata nei pazienti nei quali si riscontri un repentino aumento della fosfatasi
alcalina, del dolore e del volume dell’osso colpito1,2.
Tra le altre complicanze occorre sottolineare
l’iperuricemia e la gotta secondaria all’incremento
del turnover degli acidi nucleici nei siti di attiva
proliferazione pagetica11.
Esami strumentali
Gli esami radiografici sono un indispensabile
strumento per la diagnosi e permettono non solo di
individuare fratture e deformazioni ossee, ma anche i diversi stadi della malattia.
Nella prima fase (fase osteolitica) si può riscontrare un’osteoporosi circoscritta ben evidente a livello della teca cranica; nella seconda fase (osteosintetica) accanto alle aree osteolitiche si notano
aree di aumentata opacità dando il classico aspetto a mosaico; nella terza fase (osteosclerotica) si riscontra un aumento diffuso della densità, determinando un quadro di eburneazione molto simile
al linfoma di Hodgkin12.
In conclusione, si osserva radiologicamente: iperostosi più o meno estesa, ipertrofia dei fasci trabecolari il cui orientamento è diretto solo parzialmente lungo le linee di forza; ampi spazi radiotrasparenti interposti a tessuto osteoide (aspetto sfumato delle trabecole), aree osteosclerotiche.
Nella variante poliostotica, i segmenti più colpiti sono il bacino, il cranio e le vertebre. La tibia
e il bacino e più raramente un singolo corpo vertebrale (“vertebra d’avorio”) sono coinvolte nella variante monostotica13.
Anche la scintigrafia ossea con tecnezio-99 polifosfonato è utile per evidenziare l’attività di malattia, ma non è specifica.
Esami di laboratorio
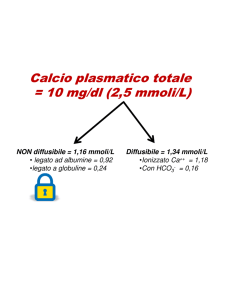
Da un punto di vista biochimico, l’aumento del
riassorbimento comporta un incremento dell’escrezione urinaria di idrossiprolina, N-telopeptide, carbossitelopptide e della fosfatasi acida tartrato-resistente, mentre l’aumentata attività osteoblastica si manifesta con un incremento della fo-
sfatasi alcalina e dell’osteocalcina. Il calcio e il fosforo sono nella norma. È possibile il riscontro di
elevati livelli di calcemia, nel caso di una prolungata immobilizzazione o, in caso di un coesistente
iperparatiroidismo primitivo, quest’ultima associazione è ritenuta casuale.
Gli esami di laboratorio sono fondamentali, perché ci permettono non solo di monitorare la malattia ma anche di comprendere la sua severità.
Diagnosi differenziale
La diagnosi differenziale è essenziale. In presenza di una lesione osteolitica, bisogna escludere una neoplasia; nei casi dubbi, con l’impiego
della tomografia computerizzata, della risonanza magnetica ed eventualmente di una biopsia
ossea.
Le malattie che debbono essere escluse sono:
1. emangioma vertebrale: generalmente solitario caratterizzato da un aumento della trabecolatura verticale con risparmio degli archi neurali e
dei piatti vertebrali;
2. neoplasie quali mieloma, linfoma, tumore a
cellule giganti, sarcomi e tumori bruni;
3. sarcoidosi generalmente associata a ipercalcemia e ipercalciuria, anemia, ipoalbuminemia e
aumento della VES;
4. osteomielite;
5. fratture osteoporotiche;
6. displasia fibrosa, che si presenta generalmente nell’infanzia con fratture e deformità delle
ossa lunghe;
7. metastasi ossee da neoplasia mammaria, polmonare, prostatica e pancreatica;
8. mielosclerosi;
9. osteodistrofia renale.
Terapia
È ovvio che una malattia sostenuta in primis
da un’anomala ed eccessiva attività osteoclastica
si giovi di farmaci anti-riassorbitivi come la calcitonina e i bisfosfonati, che hanno come obiettivo
primario quello di indurre la remissione dell’iperosteoclastosi14,15.
Valutando la patogenesi del Paget, appare razionale l’utilizzo del denosumab, un anticorpo monoclonale umano di tipo IgG2 prodotto in una linea cellulare di mammifero (CHO) mediante tecnologia del DNA ricombinante. Il farmaco è diretto contro il RANKL, al quale si lega con elevata affinità e specificità, previene l’attivazione del suo
recettore RANK, presente sulla superficie degli
osteoclasti e dei loro precursori. Il blocco dell’interazione tra RANKL e RANK inibisce la formazione, la funzionalità e la sopravvivenza degli osteoclasti, riducendo in tal modo il riassorbimento osseo, sia a livello corticale che trabecolare.
91
92
Recenti Progressi in Medicina, 104 (3), marzo 2013
In studi preclinici sulla qualità ossea condotti
in scimmie trattate a lungo termine con denosumab, la riduzione del turnover osseo si è accompagnata ad un miglioramento della resistenza ossea e ad una normale istologia. I livelli di calcio
erano transitoriamente diminuiti, mentre quelli
dell’ormone paratiroideo erano temporaneamente aumentati nelle scimmie ovariectomizzate trattate con denosumab. Attualmente questo farmaco
è impiegato nel trattamento dell’osteoporosi postmenopausale ad alto rischio di fratture, negli
uomini con cancro alla prostata e carcinoma
mammario.
Tuttavia, in letteratura sono presenti casistiche
che evidenziano l’efficacia di questo farmaco nel
trattamento del Paget16-19.
L’opzione terapeutica ideale sarebbe poter eliminare il dolore osseo, normalizzare la fosfatasi alcalina totale con remissione prolungata, guarire le
lesioni osteolitiche radiografiche e prevenire le recidive e complicanze20.
Occorre sottolineare, infine, l’agevole accesso alla terapia (una siringa pre-riempita per via sottocute ogni 6 mesi) e quindi la disponibilità psicologica da parte del paziente.
Il problema è la durata della trattamento, l’intervallo tra una somministrazione e la successiva
e la quantità di principio attivo da somministrare ogni volta.
Altro dato da valutare è il dolore: esso potrebbe essere trattato con analgesici puri. A tal proposito, appare razionale l’utilizzo del tocilizumab
(un anti-IL6), anticorpo monoclonale in grado di
legarsi all’interleuchina-6, coinvolta nella genesi
del dolore nel Paget20.
Bibliografia
1. Todesco S, Gambari PF. Malattie reumatiche. Milano: McGraw-Hill 2002: 451-3.
2. Isaia G, Grosso I, Casalis S. Clinica e terapia della
malattia di Paget. GIDM 2001; 21: 161-70.
Indirizzo per la corrispondenza:
Prof. Massimo D’Amore
Policlinico
Università Aldo Moro
Dipartimento Interdisciplinare di Medicina
Piazza Giulio Cesare, 11
70124 Bari
E-mail: [email protected]
3. Filipponi P, Cristallini S, Policani G. Bifosfonati e
Paget. Up-to-date 2005. Yearbook 2005; 2: 9-17.
4. Hardman JG, LiGoodman Gilman A. Le basi farmacologiche della terapia. Milano: McGraw-Hill, 2003.
5. Kobayashi Y, Udagawa N, Takahashi N. Action of
RANKL and OPG for osteoclastogenesis. Crit Rev
Eukaryot Gene Expr 2009; 19: 61-72.
6. Whyte MP. Paget’s disease of bone and genetic disorders of RANKL/OPG/RANK/NF-kappaB signaling Ann NY Acad Sci 2006; 1068: 143-64.
7. Kurihara N, Hiruma Y, Zhou H, Subler MA, Dempster DW, Singer FR, et al. Mutation of the sequestosome 1 (p62) gene increases osteoclastogenesis
but does not induce Paget disease. J Clin Invest
2007; 117: 133-42.
8. Albanese C, Passariello R. Osteoporosi e malattie
metaboliche dell’osso: clinica e diagnostica. Milano:
Springer-Verlag 2009.
9. Cotran RS, Kuman V. Le basi patologiche delle malattie. Padova: Piccin 2000.
10. Ralston SH, Langston AL, Reid IR. Pathogenesis
and management of Paget’s disease of bone. Lancet
2008; 372: 155-63.
11. Giordano N, Perpignano G, Nuti R. Compendio di
reumatologia. Milano: Elsevier Masson 2008.
12. Rugarli C. Medicina interna sistematica. Milano:
Masson 2002.
13. Cittadini G. Diagnostica per immagini e radioterapia. Genova: ECIG 2003.
14. Cubdy T, Reid IR. Reprint: Paget’s disease of bone.
Clin Biochem 2012; 45: 970-5.
15. Langston AL, Ralston SH. Management of Paget’s
disease of bone. Rheumatology 2004; 43: 955-9.
16. Schwarz P, Rasmussen AQ, Kvist TM, Andersen UB,
Jørgensen NR. Paget’s disease of the bone after treatment with denosumab: a case report. Bone 2012;
50: 1023-5.
17. Hirao M, Hashimoto J. Denosumab as the potent
therapeutic agent against Paget’s disease of bone.
Clin Calcium 2011; 21: 1231-8.
18. Chung PY, Van Hul W. Paget’s disease of bone: evidence for complex pathogenetic interaction. Semin
Arthritis Rheum 2012; 41: 619-41.
19. Romas E. Clinical application of RANK-ligand inhibition. Intern Med J 2009; 39: 110-6.
20. Michou L, Brown JP. Emerging strategies and therapies for treatment of Paget’s disease of bone. Drug
Des Devel Ther 2011; 5: 225-39.








![[CB - 0] CLUB3/RUBRICHE/PAGINE 12](http://s1.studylibit.com/store/data/007569004_1-f7f65c9452ecce982001bb4786c6cba5-300x300.png)