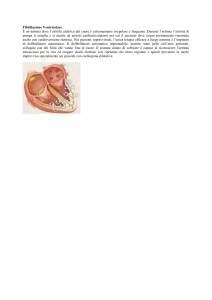
Capitolo 23 • Aritmie e sincopi
207
Capitolo 23
Aritmie e sincopi
L’ aritmia è parte della storia “naturale” di molte cardiopatie congenite e del
loro trattamento chirurgico. La perdita del ritmo sinusale è una delle cause più frequenti di ospedalizzazione. Sfortunatamente in questo gruppo di
pazienti le aritmie sono spesso difficili da identificare (una aritmia atriale
lenta da rientro può superficialmente apparire come un ritmo sinusale) e
sono associate a una significativa morbilità, resistenza alla terapia e difficoltà al trattamento in elettrofisiologia. Si aggiunga poi che il sintomo delle palpitazioni può trasformare un giovane adulto nel pieno della propria
attività lavorativa in qualcuno incapace di portare avanti il proprio lavoro
o di rendersi funzionalmente indipendente all’interno di una comunità.
I disturbi del ritmo sopraventricolari rappresentano le aritmie più
comuni in questo gruppo di pazienti. In un cuore funzionalmente compromesso un’aritmia sopraventricolare rapida può avere effetti devastanti
quanto una tachicardia ventricolare. In particolare, un flutter atriale può
essere condotto 1:1 e può essere causa di collasso cardiovascolare in questa popolazione relativamente giovane di pazienti. In termini pratici, è
assolutamente fondamentale che tutti i soggetti ad alto rischio siano con
regolarità sottoposti a un ECG a 12 derivazioni al fine di identificare precocemente i flutter atriali lenti non sintomatici.
Invece di citare la miriade di aritmie che possono essere riscontrate in
questa popolazione di pazienti, ci focalizzeremo dal punto di vista pratico
sul trattamento di alcune tra le forme più frequenti (vedi Tabella 23.1).
Flutter atipico (tachicardia intra-atriale da rientro)
Il flutter atipico o più comunemente tachicardia intra-atriale da rientro è
una causa comune di aritmia e palpitazioni nei pazienti precedentemente
sottoposti a chirurgia atriale. Precedenti interventi chirurgici e stiramenti
dell’atrio sono il substrato per lo sviluppo di circuiti multipli attorno alle
barriere elettriche delle linee di sutura e delle cicatrici. Queste palpitazioni sono frequenti e sono spesso causa di numerosi ricoveri ospedalieri. In
fase acuta la cardioversione farmacologica è raramente coronata da successo e spesso questi pazienti richiedono la cardioversione elettrica.
L’amiodarone e i beta-bloccanti sono i farmaci più frequentemente utilizzati. Altre forme di terapia preventiva come il pacing atriale o il defi-
208 Cardiopatie congenite
Tabella 23.1
Ritmo
Anatomia tipica
Commenti
Flutter atriale
atipico
(rientro intraatriale)
Mustard, Senning,
Fontan (vecchie
tecniche)
Chirurgia del difetto
interatriale (DIA)
Spesso ricorrente e richiede ripetute cardioversioni elettriche
Limitate opzioni farmacologiche se associate
con ridotta funzionalità ventricolare
Frequenti circuiti multipli quando mappati in
elettrofisiologia (esistenza di flutter atriali tipici
istmo-dipendenti)
Un flutter refrattario può costituire un’indicazione per ripetere l’intervento di Fontan
Vie accessorie
Tipicamente nell’anomalia di Ebstein della
valvola tricuspide
Possono terminare con la somministrazione
intravenosa di adenosina in pronto soccorso
L’ablazione transcatetere è il trattamento di
scelta
Fibrillazione
atriale
DIA specialmente nei
pazienti più anziani
Può persistere o svilupparsi nonostante la correzione del DIA, specialmente nei pazienti sottoposti a trattamento chirurgico dopo i 40 anni
Può presentare altre comorbilità: ipertensione, disfunzione ventricolare sinistra
Tachicardia
ventricolare
Disfunzione miocardia
Scompenso del
ventricolo sistemico
Tetralogia di Fallot
Correzione del difetto
interventricolare
Nella tetralogia di Fallot un QRS >180 ms è
fattore di rischio
Identificare eventuali difetti emodinamici
residui
Considerare l’eventuale impianto di un defibrillatore intracardiaco
Considerare l’eventuale ablazione
Si può presentare come morte improvvisa
brillatore atriale possono ridurre il numero degli episodi acuti ma raramente eliminano del tutto il problema. A differenza delle forme tradizionali di flutter, queste onde flutter possono essere lente e disomogenee.
Talvolta sono difficili da identificare, in particolare quando il ritmo atriale è lento. Alcuni circuiti da rientro intra-atriale possono non essere istmodipendenti e possono richiedere alcune tra le più moderne tecniche di
mappaggio per guidare l’ablazione.
Tachicardia ventricolare
La tachicardia ventricolare (TV) colpisce in prevalenza pazienti precedentemente sottoposti a ventricolotomia (correzione di difetto interventricolare
e/o tetralogia di Fallot con tecniche chirurgiche ora in disuso), pazienti con
Capitolo 23 • Aritmie e sincopi
209
tetralogia di Fallot accompagnata da insufficienza polmonare severa e insufficienza ventricolare destra, e pazienti con disfunzione del ventricolo sistemico (pazienti con cuore univentricolare, Fontan e ventricolo destro sistemico). La stratificazione del rischio è estremamente difficile in questo gruppo di pazienti ma una durata del QRS prolungata è stata dimostrata essere
un marker di rischio per improvvisa TV e morte cardiaca improvvisa, almeno nel gruppo dei pazienti con tetralogia di Fallot. Il significato di una TV
non persistente all’Holter o durante test da sforzo è meno chiara. Una precisa identificazione del quadro emodinamico di questi pazienti è parte integrante del trattamento delle aritmie e della modificazione del rischio.
Indipendentemente da tutto, comunque, le aritmie possono ricomparire a
distanza. Il defibrillatore automatico intracardiaco ha un ruolo importante
in questi pazienti. Le indicazioni per l’impianto del defibrillatore intracardiaco tuttavia non sono ancora chiare ma tale terapia è da considerarsi
comunque salva vita per molti di questi pazienti. La programmazione di
queste apparecchiature richiede una cura estrema in quanto in questi pazienti si possono spesso associare aritmie sopraventricolari. Questi pazienti devono essere gestiti da elettrofisiologi con conoscenze di cardiopatie congenite.
Aritmie atriali e difetto interatriale
Il flutter atriale e la fibrillazione atriale sono comunemente associati ai difetti interatriali (DIA). La correzione precoce (prima dei 40 anni di vita) riduce il rischio di palpitazioni ma non lo elimina completamente. Lo stiramento della parete atriale, la fibrosi atriale destra e il tessuto delle vene polmonari rappresentano dei substrati aritmogenici. A breve termine, circa i due terzi dei pazienti con flutter atriale parossistico o fibrillazione prima della chiusura del difetto interatriale miglioreranno clinicamente al trattamento chirurgico. Tuttavia le aritmie possono ripresentarsi dopo lungo tempo, specialmente nei pazienti più anziani. L’approccio corrente è quello di combinare la
chiusura chirurgica del DIA con una procedura MAZE. In corso di chiusura
transcatetere del DIA invece, l’ablazione delle vene polmonari può diventare
parte della terapia standard. In questa ottica, è importante che il problema
venga accuratamente valutato prima della chiusura del difetto, prima cioè di
interrompere l’accesso diretto all’atrio sinistro per l’elettrofisiologo.
I pazienti congeniti con un’aritmia: terapia d’emergenza
1. Identificare le compromissioni emodinamiche: eseguire manovre rianimatorie se
necessario. Se continua l’ipotensione considerare una cardioversione elettrica
urgente.
2. Valutare l’aritmia nel contesto della lesione e delle precedenti terapie. Una complessa tachicardia spesso non è ventricolare in questa situazione. Consultare tempestivamente lo specialista di riferimento. L’aritmia può essere un problema
ricorrente ben conosciuto dal cardiologo del paziente.
210 Cardiopatie congenite
3. Valutare la terapia anticoagulante e la sua efficacia (controllare un recente INR).
4. I pazienti ad alto rischio non dovrebbero rimanere per lungo tempo in aritmia. I
pazienti con fisiologia di Fontan e quelli con una sofferenza ventricolare dovrebbero essere immediatamente sottoposti a cardioversione. Una ecografia transesofagea può rendersi utile al fine di valutare la presenza di trombi intracardiaci se
l’INR è <2,5 (evitare una ventilazione a pressione positiva in pazienti con Fontan in
quanto possibile causa di effetti deleteri su tale particolare circolazione).
5. Cercare di evitare i farmaci antiaritmici che siano anche isotropi negativi in pazienti con scarsa emodinamica. Evitare l’utilizzo contemporaneo di più farmaci.Valutare
l’intervallo QT e cercare di evitare farmaci pro-aritmici.
6. Nel predisporre il trattamento con farmaci anti-aritmici o la cardioversione elettrica formulare un piano di azione nell’eventualità che il paziente diventi bradicardico.Valutare se: il pacing transvenoso è possibile/necessario; esiste un accesso venoso sicuro, ecc.
7. Consultare tempestivamente lo specialista di riferimento. Per portare un esempio, se è noto che il paziente è soggetto a frequenti episodi di aritmia si potrà valutare la possibilità di un’immediata ablazione transcatetere.
8. Valutare la prevenzione: substrato anatomico, chirurgia emodinamica, farmaci,
ablazione, dispositivi.
9. Ponderare bene se trasferire un paziente con grave tachicardia a un’altra unità.
Spesso è preferibile trattare questi pazienti con un consulto attraverso telefono/fax,
per poi trasferirli una volta che la stabilità emodinamica sia stata raggiunta.
Flutter atriale atipico in medicina d’urgenza
• La cardioversione farmacologica è raramente efficace.
• Valutare una cardioversione elettrica precoce (stesso giorno) per i soggetti ad alto
rischio.
• I farmaci di uso più frequente sono l’amiodarone, il beta-bloccante per via endovenosa e il diltiazem per via endovenosa.
• Ricordarsi dell’anticoagulazione.
• Ecocardiografia transesofagea al fine di valutare i trombi.
Prevenzione
Reintervento
Un esempio tipico è rappresentato da un paziente con un circuito di Fontan
ostruito e un atrio destro del diametro di 11 cm. Nessun tipo di trattamento
farmacologico o di intervento transcatetere garantirà il ritorno e il mantenimento del ritmo sinusale. Se c’è indicazione al trattamento chirurgico per
lesioni emodinamiche residue, valutare un intervento elettrofisiologico nel
caso in cui siano associate palpitazioni (procedura MAZE chirurgica).
Perché cercare di mantenere il ritmo sinusale in questi pazienti?
• Controllo dei sintomi (ottimizzando l’emodinamica).
• Miglioramento della funzione cardiaca e dell’attività fisica.
Capitolo 23 • Aritmie e sincopi
211
• Ridotto rischio tromboembolico (in particolar modo nei soggetti con Fontan).
• Miglioramento emodinamico; i pazienti possono essere dipendenti dal riempimento atriale e dalla sincronicità atrioventricolare (es.: cardiomiopatia ipertrofica
ostruttiva).
• Il controllo della frequenza cardiaca è spesso difficile in questi giovani pazienti.
• La conversione al ritmo sinusale è spesso più facile da ottenere se ricercata precocemente.
• Potenziali benefici nella sopravvivenza (es.: pazienti con Mustard).
Terapia farmacologica
Prescrivere farmaci anti-aritmici può essere difficile in questo gruppo di
pazienti. Questo è particolarmente vero nei pazienti più compromessi e
con la peggiore funzionalità ventricolare. Oltre a ciò, la terapia farmacologia potrebbe protrarsi per svariate decadi con possibili complicanze, come
i disordini della tiroide nella terapia a lungo termine con amiodarone. I
risultati terapeutici dell’utilizzo del dofetalide non sono ancora stati identificati in questo gruppo di pazienti.
Fattori da considerare prima della prescrizione di farmaci anti-aritmici
• La terapia può essere necessaria per lungo tempo.
• Questi pazienti possono essere a rischio per una disfunzione del seno e del nodo
atrioventricolare.
• I pazienti possono avere difetti di conduzione e prolungati intervalli QRS e QT, con
possibili effetti pro-aritmici.
• I farmaci inotropici negativi sono scarsamente tollerati nei casi di ventricoli unici.
• La gravidanza va tenuta in considerazione nei pazienti di sesso femminile.
• In realtà i farmaci più comunemente utilizzati in questa popolazione di pazienti
sono l’amiodarone e i beta-bloccanti, incluso il sotalolo.
Tecniche ablative
Le tecnologie ablative migliorano costantemente. Le nuove tecniche di
mappatura (es.: sistema CARTO) e i nuovi cateteri che consentono bruciature più profonde e più precise rappresentano i due progressi più
importanti per questi pazienti, che tuttavia rimangono pazienti difficili per
i problemi di accesso, i circuiti multipli e le pareti atriali particolarmente
spesse. Nondimeno per la maggior parte dei pazienti un’ablazione riuscita ha sicuramente un enorme impatto sulla qualità della vita e dovrebbe
essere sempre presa in considerazione.
Dispositivi per il pacing
I dispositivi per il pacing esercitano un ruolo crescente nei pazienti con
cardiopatia congenita. Vanno ovviamente maneggiati da esperti del settore. Accessi difficoltosi, shunt residui (con rischio di embolia paradossa) e
212 Cardiopatie congenite
connessioni atrio-polmonari possono rappresentare un’indicazione per il
pacing epicardico. Defibrillatori atriali, defibrillatori ventricolari e sistemi
di pacing biventricolari sono tutti esempi di nuove modalità di crescente e
importante impatto nel trattamento di questi pazienti. Restano da definire le indicazioni relative, il timing e i risultati a lungo termine.
Sincope
La sincope è un sintomo preoccupante in questo gruppo di pazienti, in particolare nei pazienti cianotici e nei pazienti con ipertensione polmonare.
Nei pazienti giovani possono comunque presentarsi forme benigne, come
le sincopi vasovagali posturali o le sincopi gestazionali precoci in corso di
gravidanza. In ogni caso, la sincope merita sempre grande attenzione.
Cause cardiovascolari di sincopi in pazienti con cardiopatia congenita
• Tachiaritmia (i sintomi dipendono dalla frequenza cardiaca e dal substrato emodinamico).
• Malattia del nodo del seno o del nodo atrioventricolare.
• Malattia tromboembolica polmonare.
• Ridotta portata cardiaca da lesione ostruttiva (es.: condotto).
• Cianosi severa.
• Ostruzione acuta di una protesi valvolare (trombosi).
• Dissezione, rottura dell’aorta.
• Ischemia.
• Ipotensione farmaco-dipendente, soprattutto di tipo posturale.
• Stimolo vasovagale.
• Benigna.
Per identificare le anomalie anatomiche o elettriche è necessario sottoporre i pazienti a una serie di esami di base (ecocardiografia, ECG 12 derivazioni e Holter 24 ore).
Nota: nell’ambito di un sospetto di tromboembolia polmonare, esistono molte insidie interpretative nell’angio-TC e nello studio del rapporto ventilazione perfusione, in
special modo per i pazienti con shunt e anastomosi sistemico-polmonare.
È una buona norma, e dovrebbe sempre essere ricordato ai pazienti adulti con cardiopatia congenita, conservare una copia di un ECG a riposo nella cartella dei documenti
medici personali.