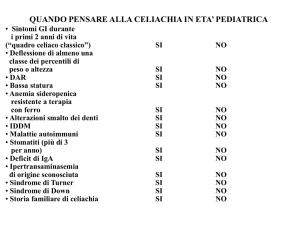
Celiachia News 7
Antonio Carroccio—Divisione di Medicina Interna, Policlinico Universitario di Palermo
Valutazione degli anticorpi anti-endomisio nella coltura di
tessuto duodenale: un nuovo strumento diagnostico per la
celiachia
Da molti anni la diagnostica della malattia celiaca si avvale della valutazione di anticorpi
specifici presenti nel siero dei pazienti ed indicativi di una probabile condizione di celiachia.
Infatti, l'avere osservato che i pazienti celiaci producono anticorpi sia verso componenti dei
cereali (anticorpi anti-gliadina AGA-), sia verso matrici proteiche dei tessuti (anticorpi antireticulina, anticorpi anti-endomisio EmA-, etc) ha determinato il grande vantaggio di potere
preselezionare i pazienti che hanno un'alta probabilità di essere affetti da celiachia e che, quindi,
devono essere sottoposti ad una biopsia intestinale per valutare lo stato dei villi.
Dunque, l'iter diagnostico della celiachia inizia da un semplice prelievo di sangue che tende a
cercare nel siero del paziente gli AGA, gli EmA o, più recentemente, gli anticorpi antitransglutaminasi (anti-tTG) (1).
Se questa ricerca ha esito positivo, la probabilità di una diagnosi di celiachia è molto alta e si
procede ad eseguire la biopsia intestinale; se la ricerca sierologica è negativa, nella maggior
parte dei casi si rinuncia ad eseguire una biopsia intestinale. È dunque evidente che la prima
tappa, quella della determinazione degli anticorpi su siero, ha un ruolo fondamentale
indirizzando con il suo risultato il proseguimento dell'iter diagnostico.
Numerosi anni di esperienza e di ricerche, hanno chiarito che la positività o la negatività degli
anticorpi sierici ha, comunque, un valore diverso nel predire od escludere lo stato di malattia a
secondo di quali anticorpi vengono ricercati. Storicamente, gli AGA sono stati i primi anticorpi
sierici ad essere utilizzati, ma è oggi noto che i migliori risultati, in termini di predittività sono
offerti dagli EmA (1).
Tab. 1: Sensibilità e specificità dei pricipali
test sierologici utilizzati nella diagnosi di celiachia.
Dati riassuntivi della letteratura
*Per gli EmA vengono riportate sensibilità inferiori
in caso di lesione istologica intestinale lieve
Legenda: AGA = anticorpi anti-gliadina;
EmA = anticorpi anti-endomisio;
Anti-tTG = anticorpi anti-transglutaminasi
La tabella 1 riassume i dati presenti in letteratura
sulla sensibilità e la specificità dei diversi test
sierologici nella diagnosi di celiachia (2). Per meglio
chiarire il significato della tabella, è opportuno
precisare cosa si intende in medicina per sensibilità
o specificità di un test. La sensibilità di un test indica
la frequenza con cui quel dato esame di laboratorio
(o segno clinico) è presente nella malattia che stiamo
valutando; dunque, dire che un test ha una sensibilità
del 100% nel predire la celiachia significa dire che
esso è positivo in tutti i soggetti con celiachia;
mentre, una sensibilità del 50% equivale a dire che
quel test è positivo solo nella metà dei pazienti con celiachia.
La specificità del test indica, invece, la frequenza con cui l'esame risulta negativo in soggetti
che non hanno la malattia; in altre parole se valutiamo 100 soggetti che non hanno la celiachia
ed in tutti il test che noi adoperiamo risulta negativo, possiamo dire che quel test ha una
specificità del 100%, se il test risultasse negativo in 90 soggetti, diremmo che la specificità è del
90% e così via.
È evidente che un test ideale (in realtà pressoché inesistente in quasi tutte le patologie)
dovrebbe avere sia una sensibilità che una specificità del 100%, così da potere garantire che un
risultato positivo del test significhi con certezza presenza della malattia ed un risultato negativo,
con altrettanta certezza, assenza della malattia.
Come detto, però, questa è una condizione ideale che non si realizza quasi mai. Se torniamo alla
celiachia ed agli anticorpi sierici che vengono dosati per ricercarla (tabella 1), si può osservare
che i test che più si avvicinano alla condizione ideale sono il dosaggio degli EmA e degli
anticorpi anti-transglutaminasi; questi ultimi, tuttavia, costituiscono “l'ultima novità” nella
diagnostica della celiachia (3, 4), ed anche se sono ormai numerosi gli studi clinici che ne
abbiano evidenziato l'ottima affidabilità, si preferisce considerare ancora la determinazione
degli EmA come il test sierologico ottimale (“gold standard”).
Tuttavia, da qualche anno è stato evidenziato che almeno in una piccola parte di soggetti celiaci,
ed esattamente in coloro che non hanno un danno dei villi intestinali molto marcato (i casi con
atrofia parziale o con severa infiammazione della mucosa ma minimo danno dei villi), la ricerca
degli EmA nel siero può risultare negativa, e per questi particolari pazienti la sensibilità
diagnostica degli EmA scende notevolmente, fino al 25-40% (5).
È in questo piccolo sotto-gruppo di pazienti celiaci che può avere un ruolo la novità diagnostica
che è oggetto del nostro articolo: la ricerca degli EmA prodotti “in vitro” da un frammento della
biopsia intestinale. Ma vediamo, innanzi tutto, di riassumere la storia di questo altro tassello
della ricerca nel settore della celiachia.
Gli Ema su coltura
La storia della ricerca degli EmA nella coltura di frammenti bioptici di mucosa intestinale è
tutta italiana ed è, quindi, anche un piccolo motivo di orgoglio raccontarla.
Essa ha inizio nel 1996, quando ricercatori italiani della “Sapienza” di Roma e dell'Università
“Federico II” di Napoli dimostravano che una biopsia intestinale di pazienti con celiachia in
fase florida, posta in un mezzo di coltura adeguato per 48 ore, produceva anticorpi antiendomisio (6). Infatti, nei loro esperimenti la ricerca degli EmA nel mezzo di coltura risultava
positiva in 16 su 16 campioni testati.
Nello stesso prestigioso articolo apparso su “The Lancet” gli Autori evidenziavano che soggetti
celiaci a dieta priva di glutine e con mucosa intestinale normale, avevano una uguale risposta
della loro mucosa intestinale se al mezzo di coltura veniva aggiunta la gliadina. In altre parole,
in questo secondo esperimento si evidenziava che in 17/23 casi, da una mucosa di un celiaco in
remissione clinica (quindi senza alcuna alterazione istologica) era possibile ottenere la
produzione di EmA, aggiungendo della gliadina al mezzo di coltura, così da scatenare la
risposta immunitaria.
Questi risultati avevano importanti implicazioni nella comprensione della patogenesi della
celiachia (erano la prova che l'intestino era la sede di produzione di un auto-anticorpo gli EmA e che questo fenomeno avveniva precocissimamente al contatto con la gliadina, che fungeva da
antigene scatenante). Ma non minore era la possibilità di utilizzare questi dati nella pratica
clinica; si poteva sottoporre a biopsia intestinale qualsiasi paziente a dieta priva di glutine da
molti anni per una vecchia diagnosi di celiachia, e verificare se effettivamente fosse celiaco: se
la sua mucosa era in grado di produrre EmA nel corso della coltura “in vitro” con gliadina, si
poteva confermare la diagnosi, in caso contrario si doveva mettere in dubbio la consistenza
della precedente diagnosi di celiachia: nasceva così il concetto/possibilità di “challenge in
vitro”. Quest'opportunità non era certo da sottovalutare se consideriamo quanti casi di diagnosi
dubbie di celiachia giungono ai nostri ambulatori di gastroenterologia e con pazienti già a dieta
priva di glutine da molto tempo. Per questi casi l'approccio consolidato è sempre stato quello di
liberalizzare la dieta e di valutare la risposta clinica ed istologica alla riesposizione al glutine
(“challenge”). Il “challenge in vitro” consentirebbe dunque di non riesporre i pazienti al glutine
evitando le conseguenze sia fisiche che psicologiche che questa tappa diagnostica comporta.
Tuttavia, occorre dire che nonostante Antonio Picarelli e coll. abbiano confermato la bontà del
metodo della coltura della biopsia per il “challenge in vitro” in una successiva serie di pazienti
(7), altri Autori non sono riusciti a riprodurre i risultati inizialmente pubblicati dal gruppo
italiano (8,9). Una importante differenza era però evidente fra gli esperimenti di “challenge in
vitro” che risultavano positivi e quelli che risultavano negativi: la durata della coltura e, quindi,
del contatto della biopsia con la gliadina; nei casi in cui non si evidenziava la produzione di
EmA, il tempo della coltura non superava le 24 ore, negli altri casi in cui si osservava la
produzione di EmA in coltura, era di 48 o 72 ore. Nostre recenti ricerche hanno però mostrato
che non è solo il tempo di coltura che determina l'attendibilità del “challenge in vitro” ed hanno
anche rivelato un potenziale uso diagnostico della coltura della biopsia intestinale e della ricerca
degli EmA nel mezzo di coltura, anche in situazioni diverse dal “challenge in vitro” .
La nostra esperienza con l'Ema-Biopsy
All'inizio del corrente anno, abbiamo pubblicato la nostra esperienza sull'uso della coltura delle
biopsie intestinali in circa 200 pazienti, sia adulti che bambini, venuti alla nostra osservazione
per il sospetto di celiachia (10). In tutti i pazienti abbiamo eseguito sia i comuni test su siero
(AGA ed EmA), sia biopsie duodenali per il “classico” esame istologico e per la coltura con e
senza aggiunta di gliadina.
Come era prevedibile la valutazione degli anticorpi anti-endomisio su siero si è confermata
un'ottima metodica, avendo evidenziato nei nostri pazienti una specificità del 100% (nessun
falso positivo nei pazienti che non erano celiaci) ed una sensibilità del 88%. Questo dato di
sensibilità equivaleva alla corretta diagnosi di celiachia in 80 su 91 pazienti affetti da celiachia.
È stato molto interessante notare che la coltura del frammento bioptico intestinale con l'aggiunta
di gliadina, determinava la presenza di EmA nel mezzo di coltura in 87 su 91 casi, migliorando
dunque la possibilità diagnostica di celiachia e portando la sensibilità del test al 96%. La
principale obiezione è, tuttavia, che per raggiungere questo migliore risultato bisognasse fare
ricorso alla biopsia intestinale che è il mezzo diagnostico “ultimo” (posto alla fine dell'iter
diagnostico e solo per i casi con sierologia positiva) che “in ogni caso” chiarisce la presenza od
assenza di una condizione di celiachia.
Tuttavia, le cose non stanno esattamente così. Infatti, i pazienti che nel nostro studio risultavano
negativi per gli EmA sierici ma che erano identificati dalla produzione di EmA nel mezzo di
coltura della biopsia duodenale, erano tutti caratterizzati da un danno istologico intestinale
molto modesto. In questi pazienti, in pratica, la valutazione istologica dell'intestino non
mostrava un alterazione dell'altezza dei villi che erano, invece pressoché normalmente
rappresentati; le caratteristiche istologiche erano quelle di una iperplasia delle cripte e di un
notevole aumento delle cellule infiammatorie (linfociti, eosinofili, plasmacellule) nella mucosa
intestinale.
Questo aspetto è considerato uno degli stadi istologici precoci della celiachia, nel senso che
precede le classiche lesioni caratterizzate da appiattimento dei villi. Si tratta, tuttavia, di un
quadro istologico non univocamente interpretabile come condizione di celiachia: in assenza di
un risultato positivo degli anticorpi sierici (AGA, EmA ed anti-transglutaminasi) è molto
improbabile che il gastroenterologo (e prima di lui, l'anatomo-patologo) si orienti verso una
diagnosi di celiachia quando la biopsia intestinale non mostra alterazioni dei villi intestinali.
Ecco, dunque, che in questi particolari casi la presenza degli EmA nel terreno di coltura della
biopsia intestinale può confermare il sospetto del clinico che ha avanzato una possibile diagnosi
di celiachia, ma che non ritrova una sierologia positiva e non ha un chiaro esame istologico che
mostri un'atrofia della mucosa. Non si tratta, dunque di considerare l'EmA-biopsy (questo il
nome del kit commerciale che consente di eseguire l'esame presso qualsiasi centro ove sia
possibile praticare una biopsia intestinale ed un dosaggio degli EmA) come un esame che
migliora in genere la sensibilità degli EmA dosati nel siero, ma di considerare questo test come
un'arma in più da utilizzare nei casi a forte sospetto clinico ma sierologicamente negativi.
È ovviamente rilevante che tutti i pazienti da noi diagnosticati come celiaci mediante l'EmAbiopsy, fossero in qualche modo sintomatici e che dopo l'inizio della dieta priva di glutine i loro
disturbi si risolvessero.
Il secondo aspetto valutato dal nostro recente studio è stato l'attendibilità del “challenge in
vitro”. A questo scopo, abbiamo studiato 21 pazienti con celiachia a dieta da oltre un anno e con
quadro istologico al momento dello studio di normalità dei villi intestinali (10). La stimolazione
con gliadina, in vitro, per un tempo di 48 ore, di un frammento bioptico intestinale ha
determinato la produzione di EmA in 10 dei 21 pazienti. Dunque l'attendibilità del “challenge in
vitro” è risultata essere, nelle nostre mani, di circa il 50%.
È interessante notare che i casi che producevano EmA erano caratterizzati rispetto agli altri, da
una più breve durata della dieta priva di glutine (pazienti messi a dieta da meno tempo) e da una
maggiore presenza di cellule infiammatorie nella mucosa intestinale.
Da questi risultati si può concludere che il “challenge in vitro” mediante EmA-biopsy può
essere utile quando risulti positivo perché conferma una vecchia (e dubbia) diagnosi di
celiachia , senza dovere riesporre il paziente all'assunzione di glutine. Tuttavia, la sua negatività
non è assolutamente da interpretare come un'esclusione della diagnosi di celiachia, perché più
del 50% di soggetti celiaci a dieta priva di glutine non producono EmA nelle condizioni
sperimentali che sono state da noi adoperate. Un “challenge in vitro” negativo impone dunque
estrema prudenza, non consente di giungere a conclusioni certe e deve essere seguito da un
classico challenge “in vivo”.
In conclusione, la scoperta che la mucosa intestinale dei pazienti celiaci ha la capacità di
produrre EmA ha aperto la strada ad una migliore comprensione dei processi patogenetici della
celiachia e ci ha fornito un'ulteriore mezzo diagnostico per “esplorare l'iceberg” celiaco.
Ulteriori ricerche dovranno chiarire le reali dimensioni del gruppo di pazienti celiaci che
possono sfuggire all'attuale approccio diagnostico (ricerca di anticorpi nel siero + istologia
intestinale) e possono, invece, essere diagnosticati mediante l'evidenza della capacità che la loro
mucosa intestinale produca anticorpi specifici in vitro.
Bibliografia Essenziale
1. Fasano A., Catassi C.: Current approaches to diagnosis and treatment of celiac disease: an evolving spectrum.
Gastroenterology 2001; 120: 636-51.
2. Farrell R.J., Ciaran K.: Current concepts: celiac sprue. N. Engl. J. Med. 2002; 346: 180-8.
3 Dieterich W, Laag E, Schopper H, Volta U, Ferguson A, Gillet H et al.: Autoantibodies to tissue transglutaminase as
predictors of celiac disease. Gastroenterology 1998; 115: 1317-21.
4. Dieterich W, Ehnis T, Bauer M, Donner P, Volta U, Riecken EO, Schuppan D: Identification of tissue
transglutaminase as the autoantigen of celiac disease. Nature Med 1997; 3: 797-801.
5. Rostami K., Kerckhaert J., Tiemessen R., von Blomberg B.M., Meijer J.W.R., Mulder C.J.: Sensitivity of
antiendomysium and antigliadin antibodies in untreated celiac disease: disappointing in clinical practice. Am. J.
Gastroenterol 1999; 94: 888- 94.
6. Picarelli A., Maiuri L., Frate A., Greco M., Auricchio S., Londei M.: Production of antiendomysial antibodies after
in vitro gliadin challenge of small intestine biopsy samples from patients with coeliac disease. Lancet 1996; 348: 1065 7.
7. Picarelli A., Di Tola M., Sabbatella L., Anania M.C., Di Cello T., Greco R., Silano m., De Vincenzi M.: 31-43 amino
acid sequence of the -gliadin induces anti-endomysial antibody production during in vitro challenge. Scand. J.
Gastroenterol. 1999; 34: 1099-1102.
8. Vogelsang H., Schwarzenhofer M., Granditsch G., Oberhuber G.: In vitro production of endomysial antibodies in
cultured duodenal mucosa from patients with celiac disease. Am. J. Gastroenterol. 1999; 94: 1057-61.
9. Biagi F., Parnell D.J., Ellis H.J., Ciclitira P.J.: Endomysial antibody production is not related to histological
damage after in vitro gluten challenge. Eur. J. Gastroenterol. Hepatol. 2000; 12: 57-60.
10. Carroccio A., Iacono G., D'Amico D., Cavataio F., Teresi S., Caruso C., Di Prima L., Colombo A., D'arpa F.,
Florena A., Notarbartolo A., Montalto G.: Production of anti-endomysial antibodies in cultured duodenal mucosa:
usefulness in coeliac disease diagnosis. Scand. J. Gastroenterol. 2002; 37: 32-8.