PREMIO CESARE BONACINI
Anno Scolastico 2004-2005
Esperimenti quantitativi su lavoro, potenza,
trasferimenti di energia nelle macchine e in voi
studenti. Quanto si spende? Quanto si ottiene?
1° Premio
IPSIA ‘A.Lombardini’ e Liceo Scientifico "A. Moro"
Reggio Emilia
Motivazione:
Il tema è stato svolto su una cella a combustibile autocostruita, dispositivo il cui
funzionamento fisico-chimico è, dal punto di vista energetico, sufficientemente
semplice da poter essere proposto a studenti della scuola secondaria.
Particolarmente interessante la decisione di costituire un gruppo misto di
studenti appartenenti a scuole molto diverse, integrando con reciproco
vantaggio le competenze degli uni e degli altri. I fenomeni sono stati esplorati
sia dal punto di vista sperimentale, sia dal punto di vista della teoria che ne sta
alla base. I risultati sperimentali sono coerenti e bene interpretati nello spirito
del tema del concorso.
STUDENTI PARTECIPANTI
IPSIA ‘A.Lombardini’
Liceo Scientifico ‘A.Moro’
CAMPANI MANUELE
DE MICHELI FRANCESCO
FORTESE FRANCESCO
GREGORI FILIPPO
GAUNA JOSUE’ ZACARIAS
MONTAGNA ALESSANDRO
ISKHAKOV ARTUR
RUBIANI STEFANO
MARZIANO LUCIANO
Docenti:
Per l'IPSIA il Prof.Dario Menozzi
Per il Liceo Scientifico il Prof. Giulio Bassoli
1
RELAZIONE DOCENTI
La particolare esperienza che abbiamo scelto ci ha posto alcuni problemi nella
programmazione didattica; si sono dovuti affrontare argomenti poco trattati nei
corsi scolastici di fisica: termodinamica delle reazioni chimiche (entropia,
entalpia, energia libera e legge di Nernst), cenni di interfacciamento e di
programmazione in linguaggio Delphi.
Le difficoltà affrontate nella realizzazione dell’esperienza sono principalmente il
reperimento dei materiali, loro assemblaggio, preparazione e lavorazione nonché
la realizzazione delle esperienze per il conseguimento degli obiettivi preposti.
Alla programmazione sono state dedicate 20 ore così suddivise:
-- termodinamica ed elettrochimica
4 ore
-- convertitore e programmazione
4 ore
-- principi di funzionamento della cella a combustibile
4 ore
-- simulazione di misure sperimentali
2 ore
-- Misure ed elaborazioni al PC
3 ore
-- relazione finale
3 ore
La realizzazione pratica ha comportato la lavorazione di nuovi materiali (mai
utilizzati in precedenza nei nostri laboratori) con un conseguente adattamento
alle varie lavorazioni (grafite leggera, PEM, MEA, mylar, ecc..) e impegno
anche al di fuori dell’orario scolastico.
Nella fase preparatoria gli studenti hanno svolto ricerche personali sulle celle a
combustibile e sui fenomeni fisici e chimici connessi. I docenti hanno
successivamente verificato la preparazione raggiunta.
I docenti hanno svolto lezioni frontali, consigliato gli alunni nella costruzione,
nelle misure e nel reperimento dei materiali nonché all’uso del software
sviluppato.
Le maggiori difficoltà si sono dimostrate il reperimento dei materiali La scelta di
collaborare con studenti di istituti diversi ci ha messo nelle condizioni di esaltare
la complementarietà delle capacità di astrazione e delle capacità operativomanuali degli studenti con risultati estremamente positivi sia per la qualità
dell’elaborato finale sia per gli aspetti didattici legati all’apprendimento. Infatti
in tutte le fasi gli studenti hanno svolto un tutoraggio reciproco: Nelle fasi
pratiche hanno operato gli studenti del liceo con l'assistenza degli studenti di
IPSIA; la relazione è stata scritta dagli studenti di IPSIA con l'assistenza degli
studenti liceali.
2
INTRODUZIONE
Esperimenti quantitativi su lavoro, potenza, trasferimenti di energia nelle
macchine e in voi studenti. Quanto si spende? Quanto si ottiene?
L’energia è uno dei problemi più importanti del mondo odierno. In particolare le
fonti non rinnovabili (carbone, petrolio, gas) si stanno esaurendo e
l’inquinamento ambientale generato da queste forme di energie sta diventando
insopportabile. Il prezzo del petrolio sale vertiginosamente di giorno in giorno,
così come il costo dell’energia elettrica, e numerose città hanno adottato il
sistema delle targhe alterne per risolvere il problema dell’inquinamento
atmosferico generato dagli scarichi delle automobili. Ecco perché negli ultimi
anni abbiamo assistito ad un ricorso sempre maggiore alle energie “pulite” o
“alternative” (solare, eolica, idroelettrica, geotermica) che eliminano il problema
dell’inquinamento.
Considerando questo problema, che affligge tutto il mondo, abbiamo deciso di
rispondere all’argomento del concorso realizzando una cella all’idrogeno. Infatti
si tratta di un processo di produzione di energia altamente innovativo, che
probabilmente verrà installato nelle automobili del prossimo futuro anche perché
l’inquinamento generato nel corso della produzione è nullo in quanto l’unico
residuo del processo è il vapore acqueo. Crediamo che la scienza debba aiutare
l’uomo a risolvere i propri problemi, proponendo soluzioni alternative alle
difficoltà che la natura presenta. La natura e dunque la materia non si può né
creare né distruggere ma solo trasformare e la trasformazione del mondo che ci
circonda è alla base di tutta la fisica. La celebre equazione di Einstein,
conosciuta da tutti, rappresenta il culmine della trasformazione: la materia che
diventa energia, un’energia spaventosamente grande, che rivela in modo
inequivocabile la reale potenza della natura.
I trasferimenti di energia riguardano tutti gli aspetti della natura: quando
lavoriamo, il lavoro da noi speso (praticamente o intellettualmente) deriva dal
calore incamerato nell’alimentazione: l’energia si trasforma sempre.
In questo esperimento ci proponiamo di misurare il rendimento di una cella
all’idrogeno, basandoci sul principio di conservazione dell’energia. Proprio il
principio di conservazione è la base, il fondamento del nostro esperimento. La
progettazione e la realizzazione della cella è avvenuta attraverso la metodologia
del problem posing e del problem solving che ci ha posto nelle condizioni di
affrontare e risolvere anche aspetti al contorno quali la probabilità
termodinamica e l’energia libera. In questo modo siamo riusciti a completare il
nostro progetto, costruendo un piccolo “motore” del futuro e misurandone le
effettive capacità. Concludiamo questa brevissima introduzione augurandovi
buona lettura.
3
PARTE TEORICA
LA PILA: DALL’ENERGIA CHIMICA ALL’ENERGIA ELETTRICA
Per la realizzazione pratica del nostro esperimento è stato indispensabile
approfondire alcuni argomenti teorici che ci aiutassero a calcolare il rendimento
ideale della nostra cella all’idrogeno.
Innanzi tutto abbiamo individuato il fulcro dei nostri studi: la trasformazione di
energia chimica in energia elettrica.
Proprio questa trasformazione è alla base di ogni pila, uno strumento
indispensabile nella vita di tutti i giorni.
Nel corso della storia la prima pila elettrica fu realizzata da Alessandro Volta nel
1800. Questo primo rudimentale generatore di forza elettromotrice era formato
da coppie di dischi di rame e di zinco, intervallati con una pezzuola imbevuta di
una soluzione elettrolitica (cioè in cui il soluto si divide in ioni positivi e
negativi). Lo scienziato comasco osservò che tra un disco di rame e uno di zinco
si manifestava un passaggio di corrente elettrica. Questa osservazione lo
condusse a dedurre che fra i due dischetti (denominati elettrodi) si generasse una
differenza di potenziale, che rappresenta appunto la forza elettromotrice della
pila.
Una cella a combustibile contiene la cosiddetta "membrana scambiatrice di
protoni" (indicata di seguito con PEM: Proton Exchange Membrane). Poiché i
protoni dell’idrogeno che vengono a contatto con la PEM tendono a reagire con
l’ossigeno dell’aria che si trova dalla parte opposta (della PEM), sono indotti ad
attraversarla; gli elettroni dell’idrogeno non possono attraversare la PEM e si
accumulano su un elettrodo di grafite. Quando s'instaura un collegamento
elettrico esterno tra i due elettrodi della cella, i protoni H + attraversano la PEM
e gli elettroni passano nel circuito elettrico esterno e si portano sull’altro
elettrodo (permeato di ossigeno) completando la reazione:
Reazione all’anodo
Reazione al catodo
1
O2 ( gas ) + H 2 ( gas ) → H 2O(liquido) .
2
H 2 ( gas ) → 2 H + + 2e −
1
O2 ( gas ) + 2 H + + 2e − → H 2O(liquido)
2
L’energia chimica liberata in una reazione dipende dalla tendenza di un certo
evento a manifestarsi. Tradizionalmente questa tendenza viene misurata in
relazione alla variazione di entropia dell’intero universo (∆S ) . (L'entropia
(S ) è una grandezza fisica che indica il grado di disordine di un sistema). Tutti i
fenomeni naturali tendono ad avvenire aumentando il disordine complessivo
dell’universo.
Tuttavia, per ragioni di comodità, nel campo della chimica si utilizza una
grandezza diversa per definire la tendenza di una reazione chimica a
manifestarsi. Questa grandezza, elaborata da J.W. Gibbs (1839-1903), è
l’energia libera ( G = H − T ⋅ S ), che dipende solo dal sistema considerato e la cui
variazione (∆G ) è calcolata come differenza tra la variazione di entalpia (∆H ) ,
4
che può essere considerata uguale al calore di reazione misurato a pressione
costante, e il prodotto tra la variazione di entropia e la temperatura (sempre
durante il processo).
∆G = ∆H − T ⋅ ∆S
Una volta misurata la variazione dell’energia libera della cella, si può ricavare la
forza elettromotrice che viene a manifestarsi ai suoi morsetti (alla temperatura di
lavoro). Questa relazione è definita dalla legge di Nernst:
∆E = −
∆G
.
n⋅F
Questa formula definisce la forza elettromotrice della pila ∆E come il rapporto
tra la variazione dell’energia libera cambiata di segno e il prodotto tra il numero
di elettroni coinvolti nella reazione chimica in esame ( n ) e la costante di
Faraday ( F = 96487C ) che identifica la carica di una mole di elettroni.
Concludendo è utile sottolineare che l’energia chimica iniziale si trasforma in
parte in energia elettrica utile e in parte in calore nel dispositivo (dissipazione
della resistenza interna del generatore).
La costruzione della cella a combustibile
Per realizzare la nostra cella a combustibile abbiamo dapprima effettuato
svariate ricerche sulla rete; le informazioni ottenute unite a semplici espedienti
sperimentali ci hanno alla fine permesso di ottimizzare le varie fasi della
costruzione del nostro dispositivo.
Essendo il nostro primo tentativo di realizzare un simile dispositivo, ci siamo
orientati su di un modello semplice.
Partendo dal principio di funzionamento di una cella a combustibile abbiamo
costruito dapprima gli elettrodi in grafite (un’apposita grafite, una grafite
leggera costituita da materiale misto probabilmente a minime inclusioni d’aria
che appare come un insieme di scaglie di grafite compresse ). Su tale grafite
‘spugnosa’ abbiamo inciso le apposite scanalature per agevolare il passaggio
dell’aria (portatrice di ossigeno sul catodo) e del gas idrogeno (sull’anodo).
5
La fase successiva è consistita nella realizzazione dei morsetti (attacchi
elettrici);
in pratica una lastra di circuito stampato in vetronite (materiale epossidico usato
per realizzare i supporti dei circuiti elettronici) ricoperta da un lato, per
deposizione elettrochimica, di un sottilissimo strato di rame. Il lato rame viene
posto a contatto con il rispettivo elettrodo di grafite; l’altro lato della vetronite è
un ottimo isolante.
Un morsetto identico è posto sull’altro elettrodo.
Tra i due elettrodi in grafite si pone la MEA (membrane exchange assembly).
La MEA è costituita da una particolare membrana PEM a scambio protonico
(spessa 50 µm ) sulla quale con una elaborata lavorazione viene fissato un
materiale ( carta impregnata di polvere di grafite con minime tracce di platino
1
2
con funzioni di catalizzatore della reazione : O2 ( gas) + H 2 ( gas) → H 2O(l ) .
6
Tale materiale composito viene anche detto ‘backing layer’: esso viene fissato
da ambo i lati ed ha una duplice funzione:
! permettere il contatto elettrico con la grafite (con la quale è contatto);
! permettere al gas (idrogeno all’anodo e aria al catodo) di fluire alla PEM.
Gli elettrodi di grafite hanno una notevole rugosità superficiale; per mantenere
l’idrogeno a contatto con il backing layer (evitando che si disperda dalle fessure
dell'elettrodo) si pone una guarnizione (nel nostro caso in gomma di silicone di
0,5 mm di spessore) aderente all’anodo.
La realizzazione della MEA ha richiesto molta pazienza e grande impegno.
Per posizionare adeguatamente la MEA nel dispositivo la si mette in guida tra
due strati di materiale (nel nostro caso mylar), e il tutto viene assemblato e
fissato con 4 apposite viti.
Il gas idrogeno si può produrre in vari modi (ad esempio anche con un
voltametro di Hoffman) ma per eseguire l’esperienza noi ci siamo rivolti ad un
7
laboratorio fornito di gas idrogeno già pronto (e depurato da eventuali sostanze
dannose).
L’utilizzo di idrogeno puro (da laboratorio) è una scelta dettata dalla necessità di
evitare eventuali interferenze di sostanze estranee (che possono essere anche
dannose) come vapori di acido, vapore acqueo, ecc… Infatti alcune sostanze
possono potenzialmente ridurre l’efficacia della MEA (o pregiudicarne la
funzione).
Il montaggio è illustrato nello schema seguente.
Le misure eseguite con la nostra cella combustibile
Ci siamo proposti di determinare il rendimento di una cella a combustibile.
Questo richiede la conoscenza dell’energia prodotta dalle reazioni chimiche e
l’energia elettrica effettivamente disponibile (energia utile ).
I problemi affrontati sono stati di vario livello nelle varie fasi del nostro
processo costruttivo.
8
L’incognita maggiore riguardava l’effettivo funzionamento dell’apparato da noi
costruito (su tale funzionamento è basato tutto il nostro progetto).
Abbiamo superato svariate difficoltà (dal reperimento dei materiali alla
disponibilità di una sorgente di idrogeno, dalla valutazione dell’energia fruibile
alle inevitabili variazioni nel tempo dell’energia prodotta, ecc.)
La tensione in uscita dalla cella, essendo dipendente dal flusso di due gas
(idrogeno ed ossigeno contenuto nell’aria) avrebbe posto indubbi problemi di
misura.
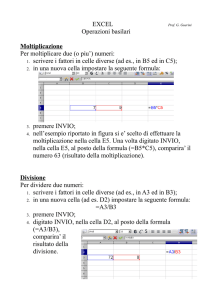
In previsione di questi problemi abbiamo messo a punto un sistema di
acquisizione dati attraverso il PC tramite un convertitore analogico digitale ad 8
bit (interamente progettato e costruito dagli studenti con la guida degli
insegnanti). La realizzazione del sistema ha richiesto molto tempo: la parte più
impegnativa ha riguardato lo sviluppo del software a basso livello per la
restituzione del valore analogico dai segnali digitali che giungevano dalla porta
seriale. Per evitare la programmazione di qualche microprocessore (troppo
specialistico per le nostre conoscenze) abbiamo usato un chip ad 8 pin (TLC549)
della Texas Instruments. La conversione avviene a soli 255 livelli: questo
comporta un certo errore ma è perfettamente accettabile ai nostri fini.
9
Lo sviluppo del software di acquisizione ed elaborazione diretta dei dati è stato
modificato via via dalle continue nuove esigenze sperimentali. La taratura dei
segnali acquisiti ha messo in evidenza un errore del 2,7% (
∆V
= 0,027 ; il 2,7% ).
V
L’interfaccia e il software da noi realizzati sono stati controllati con apposite
prove di collaudo. Alla fine il nostro sistema di acquisizione era in grado di
ricevere sotto forma di tabelle in formati testo o foglio elettronico i risultati
acquisiti nelle varie prove, di registrarli in un file, di mostrarli direttamente in
una tabella man mano che arrivavano; la tabella a sua volta poteva essere anche
modificata manualmente. Inoltre i dati venivano diagrammati sia durante la
misura che alla fine.
Durante le misure il software calcola la carica elettrica totale prodotta dal
generatore (da cui si risale al numero di reazioni avvenute) e l’energia sviluppata
sul carico in joule.
Il software può essere programmato fornendo in ingresso tre parametri: la durata
totale della prova (in secondi), l’intervallo di scansione tra due successive
misure (da millisecondi a vari minuti) e il valore della resistenza di carico: le
prove effettuate hanno avuto la durata di alcuni minuti.
Essendo la cella a combustibile un dispositivo a noi poco noto, non sapevamo il
livello dell’energia sviluppata (in particolare il calore prodotto); per questo ci
eravamo preparati a misurare attraverso un metodo di acquisizione dati anche il
calore eventualmente prodotto dalla nostra cella anche in una gamma di valori
molto ampia con un metodo basato su misure termiche nel tempo che avevamo
provato su resistenze di potenza riscaldate da corrente nota, riscontrando errori
massimi dell’1,2%. Tuttavia in realtà non abbiamo potuto applicare il nostro
metodo perché la temperatura della cella non raggiungeva valori sufficienti per
la sensibilità dei sensori.
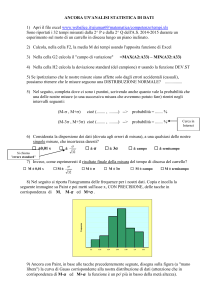
I RISULTATI OTTENUTI
Dopo svariati tentativi siamo riusciti ad ottenere valori di tensione significativi
dalla nostra cella.
10
Il grafico mostra variazioni accentuate nei valori della tensione di uscita
(eravamo in fase di prova). Successive esperienze hanno consentito risultati più
stabili.
Dai risultati si sono ottenute due grandezze (tramite elaborazione in tempo reale
via software):
! La carica totale prodotta in un certo intervallo di tempo dalla cella e quindi
l’energia chimica prodotta dalle reazioni tra idrogeno ed ossigeno
1
2
( H 2 ( g ) + O2 ( g ) → H 2O(liquido) )
La carica (nella prova a cui si riferisce il grafico) è risultata
Q = (103,0 ± 2,8)C
Tale risultato è stato ottenuto mediante integrazione numerica (direttamente
dal software)
Q=
t = max
∑
t =0
V
⋅ ∆t
R
in cui
Q
carica emessa dalla cella durante la prova (tra l’istante iniziale t = 0 e la
fine della scansione t = max )
V
tensione media nell’intervallo di tempo ∆t
t=0
inizio scansione
t = max fine scansione tempo (fine misura)
R
valore della resistenza di carico ( R = 0,989Ω )
Dalla carica si può facilmente calcolare il numero di moli di elettroni che si
producono (e, in seguito, l’energia sviluppata dalle reazioni chimiche):
N moli − elettronii =
103
= 1.07 ⋅ 10 − 3 moli ⇒ N moli − elettroni = (1,07 ± 0,03) ⋅ 10− 3 moli
96487
quindi il numero di moli d’acqua che si formano:
N moli − acqua =
N moli − elettroni
= 5.34 ⋅ 10 − 4 moli ⇒ N moli − H 2O = (5,34 ± 0,14) ⋅ 10 − 4 moli
2
Si conosce con precisione il valore della variazione di entalpia per ogni mole
1
2
della reazione ( O2 ( gas) + H 2 ( gas) → H 2O(liquido) ): ∆H = −285800 j .
Possiamo dunque determinare l’energia chimica prodotta.
E = 5.34 ⋅ 10 −4 ⋅ 285800 = 153 j
La propagazione degli errori porta al risultato completo:
E = (153 ± 4) j
! L’energia elettrica prodotta dalla cella sul carico (resistivo) noto ( R = 0,989Ω )
Nella stessa prova l’energia è stata calcolata per integrazione numerica:
E=
t = max
∑
t =0
V2
⋅ ∆t
R
in cui
E
V
energia elettrica prodotta
tensione media nell’intervallo di tempo ∆t
11
t=0
inizio scansione
t = max fine scansione tempo (fine misura)
R
valore della resistenza di carico ( R = 0,989Ω )
Notiamo che per la teoria della propagazione degli errori, l’errore su V 2 viene
raddoppiato rispetto a quello su V .
Il risultato del calcolo è risultato essere E = (43,1 ± 2,3) j
Il rendimento della nostra cella a combustibile, nella suddetta prova è stato:
η=
Energia ⋅ elettrica ⋅ prodotta ⋅ sul ⋅ carico 43
=
= (28,1 ± 2,3)
Energia ⋅ chimica ⋅ di ⋅ reazione
153
dove gli errori sono dovuti:
a) alla taratura dell’interfaccia (calcolata nel 3% ), questo valore tiene conto
tanto della taratura vera e propria che della non perfetta linearità di
conversione.
b) Alle fluttuazioni della tensione di uscita della cella (che inevitabilmente
hanno prodotto errori nell’integrazione numerica), valutabile mediamente
nello 0,5% dalle simulazioni di misura effettuate e dipendente anche
dall’intervallo tra le misure.
c) La resistenza di carico è stata misurata con grande precisione (tale da non far
risentire i suoi effetti nella propagazione degli errori sul risultato finale).
Le valutazioni sono state fatte con la cella in condizioni normali. Se aumentiamo
leggermente la ventilazione (forzando quella della convezione naturale) si
ottengono tensioni abbastanza stabili di uscita di circa
V = 0,81Volt
con un conseguente rendimento massimo del
η = (52,9 ± 4,3)%
IMPRESSIONI DEGLI STUDENTI
L’idea di costituire un gruppo di
studenti di due istituti (liceo
scientifico ‘A.Moro’ e I.P.S.I.A.
‘A.Lombardini’) coordinato da
un insegnante del liceo e da un
insegnante dell’IPSIA ci è
sembrato non solo stimolante
ma completamente nuovo per la
nostra esperienza scolastica.
Inoltre questa esperienza ci ha
posto nelle condizioni di
12
osservare e confrontare direttamente stili di apprendimento e modalità di
approccio ai problemi che pur nella diversità hanno stimolato un reciproco
arricchimento sia a livello di acquisizione delle conoscenze che a livello socioaffettivo.
Pur non avendo l’assoluta certezza di ottenere il risultato che ci aspettavamo,
abbiamo intrapreso questa attività con entusiasmo e dedizione. Successivamente
la realizzazione pratica della cella ci ha presentato numerosi ostacoli dovuti
principalmente alla difficoltà nel reperire i materiali, alla tecnica di lavorazione
della grafite e alla mancanza di esperienza. La collaborazione con altri ragazzi,
ed il reciproco “scambio” di
competenze, ci ha permesso di
superare questi problemi . Inoltre
abbiamo cercato di dividerci il
lavoro curando contemporaneamente la parte teorica e quella
pratica. Tutto ciò ha arricchito la
nostra conoscenza scientifica ma
non solo: abbiamo sperimentato
come bisogna lavorare in una
squadra, sforzandosi di sfruttare tutte le specifiche capacità dei componenti per
raggiungere il risultato.
Sul piano più strettamente scientifico abbiamo incontrato grandi difficoltà nel
reperire misure precise, specialmente per quanto riguarda la minima variazione
di temperatura cui la cella andava soggetta. Per ovviare a questo problema di
carattere pratico abbiamo deciso di
misurare solamente il rendimento
della cella senza orientarci al bilancio
energetico.
Abbiamo così capito le notevoli
difficoltà legate alla conduzione
pratica di qualsiasi esperimento, che
può essere condizionato in modo
decisivo da fattori considerati trascurabili. Nel nostro caso avevamo
ignorato il flusso di ossigeno, necessario alla reazione, pensando che le fessure
della grafite fossero sufficienti per consentire il passaggio dell’aria. Tuttavia la
pratica ha evidenziato un deficit di ossigeno all’interno della cella e per giungere
alle prestazioni ottimali della cella è risultato indispensabile ricorrere ad una
piccola ventola per forzare l’afflusso dell’aria.
Concludendo, nonostante le molteplici difficoltà, abbiamo ottenuto il risultato
auspicato all’inizio del nostro percorso e, cosa più importante, abbiamo formato
un gruppo capace di lavorare in sintonia.
13
Bibliografia:
! Chimica Generale George C. Pimentel e Richard D.Spratley
! Lezioni di Richard P. Feynman
Le ricerche sono state esclusivamente condotte sulla rete. E' stato particolarmente utile il sito http://hyperphysics.phy-astr.gsu.edu/hbase/hframe.html
14