Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
NOZIONI DI FISICA E
TERMODINAMICA
16/01/2011
1
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
INDICE
NOZIONI DI FORZA E PRESSIONE ____________________________________________ 3
NOZIONI GENERALI _____________________________________________________________ 3
Forza __________________________________________________________________________________ 3
Forza peso ______________________________________________________________________________ 3
Massa e peso specifico ____________________________________________________________________ 3
Pressione _______________________________________________________________________________ 3
PRESSIONE ESERCITATA DA UN CORPO SOLIDO __________________________________________ 4
PRESSIONE NEI LIQUIDI ________________________________________________________________ 4
PRESSIONE NEGLI AERIFORMI __________________________________________________________ 7
PRESSIONE ATMOSFERICA ______________________________________________________________ 8
PRESSIONE ATMOSFERICA O FISICA E ANCHE ATMOSFERA NORMALE ____________________ 10
ATMOSFERA METRICA ________________________________________________________________ 11
BAROMETRO _________________________________________________________________________ 12
MANOMETRI _________________________________________________________________________ 12
PRESSIONE EFFETTIVA E PRESSIONE ASSOLUTA ________________________________________ 12
INFLUENZA DELLE VARIAZIONI DI TEMPERATURA E DI PRESSIONE SU UN FLUIDO ________ 13
LEGGE DELLA PRESSIONE _____________________________________________________________ 14
RIEPILOGO ___________________________________________________________________________ 15
Tabella di conversione unità di pressione _____________________________________________________ 19
NOZIONI DI TERMOLOGIA __________________________________________________ 20
CALORE E TEMPERATURA ______________________________________________________ 20
LA TEMPERATURA ____________________________________________________________________ 21
UNITA' DI MISURA DELLA TEMPERATURA ______________________________________________ 22
SCALE TERMOMETRICHE ______________________________________________________________ 24
IL CALORE _____________________________________________________________________ 25
Definizione ____________________________________________________________________________
UNITA' DI MISURA DEL CALORE ________________________________________________________
CALORE SPECIFICO (solido o liquido) _____________________________________________________
CALORE SPECIFICO (di gas o vapore) _____________________________________________________
TABELLA: CALORE SPECIFICO DI ALCUNE SOSTANZE ____________________________________
25
25
26
28
29
STATI FISICI DELLA MATERIA __________________________________________________ 31
CAMBIAMENTO DI STATO FISICO _______________________________________________ 32
CAMBIAMENTI DI STATO _______________________________________________________ 34
FUSIONE _____________________________________________________________________________
EVAPORAZIONE ______________________________________________________________________
EBOLLIZIONE _________________________________________________________________________
CONDENSAZIONE _____________________________________________________________________
34
35
35
35
CALORE LATENTE DI FUSIONE __________________________________________________ 36
CALORE LATENTE DI VAPORIZZAZIONE ________________________________________ 37
Perche' e' importante il calore latente di vaporizzazione __________________________________________ 37
ENTALPIA ______________________________________________________________________ 39
PSICROMETRIA ____________________________________________________________ 41
Equazione dei gas perfetti __________________________________________________________ 41
VAPORE ACQUEO _____________________________________________________________________ 44
ARIA UMIDA ____________________________________________________________________ 48
CONDIZIONI DI SATURAZIONE _________________________________________________________ 48
CONDIZIONI DI NON SATURAZIONE ____________________________________________________ 51
16/01/2011
2
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
NOZIONI DI FORZA E PRESSIONE
NOZIONI GENERALI
Forza
E' la causa, qualunque essa sia, che puo' modificare lo stato di quiete o di moto di un corpo. Un
mattone si sposta se viene spinto; un carro si sposta se un trattore lo tira. La spinta o il tiro del
trattore, che sono le cause del movimento, rappresentano appunto delle forze.
Anche una grossa pietra, posta su un tavolo, esercita una forza sul tavolo stesso, infatti il tavolo
puo' deformarsi o rompersi.
Anche un sacco, per es. di 30 kg posto sulle spalle di un uomo trasmette una forza al corpo che
risente del peso del sacco stesso. Il sacco esercita sul corpo una forza di 30 chilogrammi di peso.
Nel Sistema Internazionale l'unita' di misura della forza e' quella forza che imprime alla massa
unitaria di un chilogrammo l'accelerazione unitaria di un metro al secondo per secondo (kg x
m/s2) newton (N).
Forza peso
La forza peso e' una delle piu' importanti forze di tipo meccanico. Essa e' caratterizzata dal fatto
che la Terra esercita su tutti i corpi un'azione di attrazione verso il centro.
La forza peso, chiamata comunemente peso, ha un'intensita' proporzionale alla massa del corpo,
la sua direzione coincide sempre con la verticale del luogo dove il corpo si trova, il verso e'
diretto sempre verso il centro della Terra, il suo punto di applicazione e' in quel particolare punto
del corpo chiamato baricentro, che verra' meglio definito nel seguito.
La forza-peso, oltre che in newton puo' essere misurata nell'unita' del sistema tecnico,
chilogrammopeso (kp), che esprime la forza con cui la massa di 1 kg viene attirata dalla Terra,
nel vuoto, al livello del mare ed alla latitudine di 45° (g = 9,80665 m/s22.
Massa e peso specifico
Si chiama massa specifica , in condizioni determinate di pressioni e di temperatura, la massa
dell'unita' di volume del gas considerato.
Si passa dal concetto di massa specifica a quello di peso specifico , essendo questo il peso
dell'unita' di volume del gas (tenendo presente che il valore del peso dipende dell'accelerazione
"g" impartita dal campo gravitazionale della Terra, accelerazione che, a livello del mare, e' di
9,81 m/sec2. E' in tal modo evidente il vantaggio di impiegare il valore della massa, che permane
invariabile, rispetto al valore del peso, che puo' variare da luogo a luogo.
Le unita' di misura sono nei due casi:
kg (m)/m3
kg (p)/m3
(chilogrammo massa per metro cubo);
(chilogrammo peso per metro cubo).
Pressione
Una forza F, ripartita con uniformità su una superficie di area S esercita su tale superficie la
pressione:
F
kg
P = -------- --------S
m2
16/01/2011
3
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
PRESSIONE ESERCITATA DA UN CORPO SOLIDO
Abbiamo gia' visto che cosa e' una forza e che essa si misura in chilogrammi, esattamente come
un peso, in quanto se noi tiriamo con una certa forza una molla e questa e' posta verticalmente,
noi possiamo sostituire alla nostra forza un peso corrispondente.
Abbiamo anche notato che di una forza noi abbiamo una chiara idea nelle due operazioni di tirare
e di spingere o premere.
Supponiamo ora che la forza che preme sia rappresentata dal peso di una persona , diciamo 75
chilogrammi, e che essa si eserciti su un terreno coperto di neve.
E' chiaro che se i 75 kg sono concentrati su una piccola superficie quale quella dei due piedi,
questi affonderanno nella neve, mentre se essi sono ripartiti su una superficie più grande quale
quella di due sci, questi lasceranno nella neve solo una leggera impronta.
La forza che agisce e' in tutti e due i casi uguale, pari cioè a 75 kg, ma diversa e' la superficie su
cui essa agisce: nel primo caso la superficie dei due piedi e' di circa 350 cm2, nel secondo caso la
superficie dei due sci e' di circa 3.500 cm2, ossia dieci volte maggiore.
Ora noi chiamiamo pressione il rapporto tra la forza e la superficie su cui la forza opera, ossia la
forza per unita' di superficie e la esprimiamo in chilogrammi per centimetro quadrato.
Tornando all'esempio di cui sopra, nel primo caso la pressione esercitata sul piano nevoso e' pari
a 75 diviso 350 ossia 0,2 chilogrammi per centimetro quadrato (200 grammi per centimetro
quadrato), nel secondo caso la pressione e' pari a 75 diviso 3.500 ossia 0,02 chilogrammi per
centimetro quadrato (20 grammi per centimetro quadrato).
PRESSIONE NEI LIQUIDI
Vediamo ora come si comporta la pressione quando invece di un corpo solido consideriamo un
liquido qualsiasi.
Tutti sappiamo che quando si pone un liquido in un recipiente, il liquido si pone orizzontalmente
e sappiamo pure che se si fa un foro nel recipiente, sotto il livello del liquido, il liquido stesso
esce con una certa spinta che e' tanto maggiore quanto più in basso viene praticato il foro rispetto
al livello del liquido.
Ora, si e' potuto provare sperimentalmente che, mentre un corpo solido esercita la sua pressione
solo dove si appoggia, e tale pressione corrisponde al suo peso diviso per l'area di appoggio, un
liquido esercita in ogni punto del recipiente in cui e' contenuto, una pressione che non dipende
affatto dalla quantita' del liquido, ma dal suo peso specifico e dall'altezza della colonna del
liquido sovrastante che e' poi la distanza, misurata verticalmente, tra il pelo libero del liquido ed
il punto considerato.
Prendiamo ad esempio due impianti di riscaldamento installati in due stabili di diversa
grandezza, in cui i vasi di espansione si trovino entrambi nel sottotetto all'altezza di 30 metri dal
suolo e supponiamo che gli impianti siano pieni sino ai vasi.
16/01/2011
4
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
Se noi misuriamo la pressione, poniamo a livello del suolo, noi troveremo che la pressione e'
identica nei due impianti, anche se, per esempio, il primo ha un vaso della capacita' di 1000 litri,
e l'altro ha un vaso della capacita' di 100 litri.
Tale pressione sara' uguale, come abbiamo detto, a quella prodotta da una colonna d'acqua alta
30 metri.
Se ci riferiamo ad un centimetro quadrato, una colonna alta 30 metri ed avente un'area di base di
un centimetro quadrato contiene 3000 centimetri cubi e pesa quindi 3000 grammi, cosicche'
potremo dire che la pressione e' di 3000 grammi per centimetro quadrato, ossia 3 kg/cm2.
Se invece di acqua che ha il peso specifico, come abbiamo gia' visto, di circa 1 kg per decimetro
cubo, misurassimo la pressione prodotta, poniamo, da gasolio che ha un peso specifico pari a
0,840 kg per dm2, la stessa colonna di 10 metri darebbe luogo ad una pressione di 0,840 kg per
cm2, anziche' di 1 kg per cm2.
Se viceversa si trattasse di mercurio il cui peso specifico e' pari a circa 13,6 kg per dm2, la
pressione di una colonna di 10 metri sarebbe pari a circa 13,6 kg per cm2.
TABELLA XII
Unita' usate correntemente per la misura della pressione (Sistema Tecnico)
chilogrammi per centimetro quadrato
atmosfera fisica (detta anche atmosfera normale)
metri di colonna d'acqua
millimetri di colonna di mercurio
atmosfera metrica
kg/cm2
atm
(m di c. d'a.)
(mm di Hg)
1 kg/cm2 = 10
m di c.d'a.
1 atmosfera fisica = 1,033 kg/cm2 = 10,33 m di c. d'a. = 760 mm di Hg
Per quanto riguarda il nostro lavoro occorre che ci ricordiamo:
a)
che in uno stabile molto alto la pressione esercitata dall'acqua all'altezza della caldaia
puo' essere notevolmente grande e deformare o sfiancare o addirittura sfasciare la
caldaia stessa se questa non e' abbastanza robusta;
b)
che la pressione parte da zero al livello del vaso di espansione e diventa sempre
maggiore
man mano aumenta l'altezza della colonna d'acqua sovrastante.
Ecco perche' talvolta i corpi scaldanti in lamiera, dei piani piu' bassi, vengono deformati (si
gonfiano per effetto della pressione elevata), mentre quelli dei piani alti non presentano alcuna
deformazione.
16/01/2011
5
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
Abbiamo visto quale è la pressione in un recipiente contenente un liquido ed in particolare essa e'
in ogni punto pari all'altezza di colonna d'acqua, ossia alla distanza tra il livello del liquido ed il
livello del punto considerato.
Vediamo ora che cosa accade se sulla superficie libera del liquido viene esercitata una pressione
ultriore, ad esempio mediante il pistone di cui la figura 8, pistone la cui faccia a contatto con il
liquido ha una superficie di 100 centimetri quadrati e viene premuto con una forza di 100
chilogrammi.
Si ha in tal caso ovviamente una pressione del pistone sul liquido pari a 100 kg per 100 cm2
ossia 1 kg per centimetro quadrato. Ebbene se noi misurassimo la pressione in qualunque punto
del recipiente, noi troveremmo che essa e' in tutti i punti pari a 1 kg/cm2. Nei punti piu' bassi la
pressione e' un po' piu' grande in quanto alla pressione esercitata dal pistone si aggiunge quella
che corrisponde alla colonna di acqua.
Se ad esempio il punto piu' basso B si trova a 1 metro di profondita' rispetto al livello A della
faccia premente del pistone, la pressione in A e' di 2 kg per cm2, in B di 2 kg per cm2 piu' 0,1 kg
per cm2.
In definitiva entro i liquidi di una pressione esercitata in un punto qualsiasi si ritrova identica in
tutti gli altri punti del recipiente posti allo stesso livello.
16/01/2011
6
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
PRESSIONE NEGLI AERIFORMI
Vediamo ora che cosa accade se invece di liquidi si tratta di gas.
In primo luogo i gas occupano tutto il recipiente in cui vengono introdotti purche' naturalmente
esso venga vuotato dell'aria che prima conteneva.
In secondo luogo anche i gas pesano, ma il loro peso e' trascurabile almeno per quanto concerne
le applicazioni tecniche che ci riguardano.
In terzo luogo i gas sono comprimibili ed elastici, mentre i liquidi, e l'acqua in particolare, si
possono considerare praticamente incomprimibili.
Riducendo il volume del recipiente in cui il gas e' contenuto, il gas si comprime ossia esercita
una pressione sulle pareti e si puo' dimostrare che la pressione e' in relazione al volume, ossia,
come si dice, e' inversamente proporzionale al volume.
Se il volume diventa meta', la pressione diventa doppia, se il volume diventa un terzo, la
pressione diventa tripla, ecc.
Come accade nei liquidi, anche nei gas la pressione e' uguale in tutti i punti del recipiente e
poiche' il peso del gas e' trascurabile, non e' piu' il caso di cercare una differenza di pressione tra
il punto alto ed il punto basso del recipiente.
16/01/2011
7
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
PRESSIONE ATMOSFERICA
Parlando di pressioni applicate sulla superficie di un liquido, dobbiamo ora osservare che sopra
tale superficie grava un'altra colonna e questa volta si tratta di una colonna d'aria, dell'aria cioe'
che ci circonda ed alla quale si deve parimenti una pressione: quella che si chiama pressione
atmosferica.
Noi non ci accorgiamo della pressione esercitata dall'aria, cioe' della pressione atmosferica,
perche', come nel caso dei liquidi, essa e' uguale per tutti i punti posti alla stessa altezza e la
pressione che grava, ad esempio, sulla faccia di un foglio di carta e' esattamente controbilanciata
da quella che grava sull'altra faccia.
Se pero' facciamo il vuoto in un tubo che pesca in un pozzo (e cio' e' possibile mediante pompe
speciali), entro il tubo la pressione atmosferica non grava piu', mentre essa agisce sulla superficie
dell'acqua del pozzo e conseguentemente l'acqua viene spinta entro il tubo e sale ad un'altezza la
cui misura dipende dalla pressione atmosferica della localita' ove si trova il pozzo in questione.
In concreto in tutte le localita' poste al livello del mare o quasi, l'acqua sale poco piu' di 10 metri
e poiche' il metro di colonna d'acqua e' pari a 0,1 kg/cm2, la pressione atmosferica e' di poco
superiore a 1 chilogrammo per centimetro quadrato.
Quando noi impieghiamo le comuni pompe per estrarre l'acqua da un pozzo, non si riesce a fare
il vuoto totale ed intervengono pure altri fenomeni per cui nella migliore delle ipotesi l'altezza a
cui si puo' aspirare acqua dal pozzo, alla temperatura media di circa 20°C, non supera i 6 metri.
TABELLA XIII
Altezza massima di aspirazione delle pompe alle varie temperature dell'acqua
Temperatura dell'acqua in
°C
0
10
20
30
40
50
60
70
80
90
100
Altezza di aspirazione in
metri
6,5
6,3
6
5,4
4,5
3,2
1,5
-
Battente necessario in metri
1,8
3
4
Se poi l'acqua e' calda l'altezza e' ancora minore e se la temperatura dell'acqua supera i 70°C,
occorre addirittura che la pompa lavori, come si suol dire "sotto battente", ossia che ci sia una
certa colonna di acqua che spinga sulla bocca di aspirazione.
Abbiamo detto che la pressione atmosferica e' di poco superiore a 1 kg per cm2 senza precisare il
valore in quanto la pressione atmosferica non ha un valore costante nel tempo ed in ogni luogo.
16/01/2011
8
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
Essa dipende in primo luogo dall'altezza a cui ci troviamo: infatti poiche' la pressione
atmosferica e' data dall'altezza della colonna d'aria che ci sovrasta, tale colonna e' ovviamente
tanto meno alta quanto piu' noi ci alziamo.
A 3000 metri di altezza la pressione atmosferica scende gia' a valori dell'ordine di 0,7 kg/cm2 e
tutti sappiamo che quanto piu' ci si innalza tanto piu' l'aria risulta rarefatta.
TABELLA XIV
Pressione atmosferica a varie quote
Altitudine sul livello del mare in metri
0
1000
2000
3000
4000
5000
6000
7000
8000
9000
10000
Pressione atmosferica in kg/cm2
1,033
0,917
0,810
0,715
0,626
0,551
0,482
0,421
0,336
0,326
0,294
In secondo luogo la pressione atmosferica dipende anche dalla latitudine; ossia dalla distanza dal
polo e cio' perche' come abbiamo visto, la forza di gravita' non e' costante su tutta la terra, anche
se le variazioni sono di piccola entita'.
In terzo luogo la pressione atmosferica varia per effetto dei fenomeni atmosferici: la temperatura,
l'umidita' relativa, il movimento dell'aria danno luogo ad oscillazioni dell'ordine di qualche
decina di grammi per cm2, oscillazioni che si misurano con il barometro.
16/01/2011
9
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
PRESSIONE ATMOSFERICA O FISICA E ANCHE ATMOSFERA NORMALE
Come abbiamo visto prima della pressione atmosferica e' la pressione esercitata dal peso della
colonna d'aria sovrastante i corpi immersi nell'atmosfera. Essa varia da luogo a luogo, ed inoltre,
nello stesso luogo, puo' subire variazioni in dipendenza delle condizioni atmosferiche. A Milano,
che si trova all'altezza di metri 122 sul livello del mare, la pressione corrispondente e' pari a
1,018 kg/cm2 ed i valori oscillano secondo le condizioni atmosferiche da una media minima di
0,993 ad una media massima di 1,034 kg/cm2.
Dall'esperienza di Torricelli, si ha che la pressione atmosferica fisica o barometrica, detta anche
atmosferica normale (ma e' una pressione convenzionale data da questa esperienza), equilibra
una colonna di mercurio alta 76 cm. Essendo il peso specifico del mercurio di 13,596 g/cm3, il
peso della colonna di mercurio sara' uguale a :
76 x 13,596 = 1033 g/cm2 = 1,033 kg/cm2
Nelle stessi condizioni barometriche, essa corrisponde ad una colonna d'acqua alta di 10,33
metri, ossia a:
1033 x 1 = 1033 g/cm2 = 1,033 kg/cm2
La pressione di un gas contenuto in un recipiente rigido puo' essere inferiore o superiore alla
pressione atmosferica.
Le pressioni misurate al di sopra della pressione atmosferica si dicono pressioni effettive.
Le pressioni misurate dallo zero, si dicono pressioni assolute. Pressione assoluta = pressione
effettiva + pressione atmosferica.
16/01/2011
10
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
ATMOSFERA METRICA
E' la pressione esercitata, alla base, da una colonna d'acqua alta 10 m (cioe', 10.000 mm), pari a:
1 kg/cmq = 1 atmosfera metrica
Essa corrisponde pertanto a una colonna di mercurio alta:
10.000
------------------- = 735,5 mm Hg
13,596
Come si vede, l'atmosfera metrica e' minore di quella fisica di 0,033 kg/cmq.
In generale, ci si riferisce sempre all'atmosfera metrica.
Le piccole pressioni si misurano in mm di colonna d'acqua o di mercurio.
Per esprimere o trasformare la pressione nelle varie unita' di misura, cioe' mm di colonna d'acqua
(mm H2O); mm di colonna di mercurio (mm Hg); atmosfera metrica (atm); occorre applicare le
seguenti formule:
(N = numero delle unita' da trasformare)
mm H2O in pressione atmosfera metrica
mm Hg in pressione atmosfera metrica
I)
N
N (mm H2O) - - > ------------------ =
10.000
II)
N x 13,596
N (mm Hg) - -> ---------------------- =
10.000
16/01/2011
.......................... atmosfera metrica
........................ atmosfera metrica
11
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
BAROMETRO
Abbiamo visto nelle pagine precedenti che la pressione atmosferica e' data anche dal peso di una
colonna di mercurio alta 76 cm. Pero' tutto questo risulta esatto solo se compiamo l'esperimento
al livello del mare.
Invece, se noi ripetiamo l'esperimento in montagna, vedremo che la colonna di mercurio, anziche'
di 76 cm, sara' per esempio di 70 cm. Piu' in alto noi ripetiamo l'esperimento, piu' bassa sara'
l'altezza della colonna di mercurio.
Cio' significa che la pressione atmosferica varia col variare dell'altitudine e quindi della densita'
dell'aria: densita' che e' minore in montagna (infatti noi diciamo che l'aria e' piu' fine, piu'
leggera).
Il tubo di mercurio cosi' descritto, graduato in centimetri o in millimetri, formerebbe il
barometro: uno strumento che segna la pressione atmosferica.
MANOMETRI
Abbiamo detto che le pressioni superiori a quelle atmosferiche si misurano con il barometro, uno
strumento che prende come base di misura la pressione atmosferica, detta anche "atmosfera".
Ad esempio, se in un serbatoio c'e' un fluido alla pressione di 3 volte di quella atmosferica
(pressione, cioe' capace di sollevare una colonna d'acqua a mt 3 x 10,33 = 30,99) diremo che la
pressione del fluido e' di 3,09 atmosfere.
L'atmosfera e' quindi lo sforzo che esercita sui corpi la pressione atmosferica, ed e' uguale a kg
1,033 per cmq.
Per semplificare i conteggi pratici, l'atmosfera si considera uguale non a kg 1,033 ma a 1 kg per
cmq.
La pressione di un liquido, di un gas, di un vapore si misura con i manometri. Essi sono graduati
in kg/cmq.
PRESSIONE EFFETTIVA E PRESSIONE ASSOLUTA
La pressione indicata da un manometro viene chiamata pressione effettiva o pressione
manometrica.
Ora, dato che il manometro segna lo zero in corrispondenza alla pressione atmosferica, e'
evidente che se si misura la pressione di un gas o di un vapore contenuti in un recipiente, la
pressione di tale gas o di tale vapore sara' quella indicata dal manometro piu' la pressione
atmosferica.
Tale pressione si chiama assoluta ed essa e' maggiore di quella effettiva esattamente della
pressione atmosferica.
In altre parole, se il manometro applicato ad una caldaia a vapore indica una pressione effettiva di
2 kg/cm2 la pressione assoluta sara' pari a 2 + 1,033 = circa 3 kg/cm2.
16/01/2011
12
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
INFLUENZA DELLE VARIAZIONI DI TEMPERATURA E DI PRESSIONE SU UN
FLUIDO
Tutti i fluidi sono soggetti, contemporaneamente, all'effetto delle variazioni della temperatura e
della pressione.
Per meglio illustrare questo concetto, riferiamoci ad uno dei fluidi piu' comuni: l'acqua.
L'acqua e' un liquido quando, sottoposta alla pressione atmosferica esistente al livello del mare
(1,03 Kg/cm2 di pressione assoluta), si trova ad una qualsiasi temperatura compresa tra 0 e
100°C.
Se raffreddiamo l'acqua, abbassandone la temperatura sotto i 0°C, essa gela, passando dallo stato
liquido a quello solido. Se al contrario la riscaldiamo oltre i 100°C, l'acqua bolle, passando dallo
stato liquido a quello gassoso.
Se la pressione atmosferica diminuisce il punto d'ebollizione si abbassa, mentre se la pressione
aumenta anche il punto d'ebollizione .
Per esempio. l'acqua sottoposta ad una pressione atmosferica di 0,64 kg/cm2 (pressione assoluta),
bolle a 73,5°C; mentre alla pressione di 1,70 kg/cm2 (assoluti) il punto d'ebollizione e' a
115,2°C.
16/01/2011
13
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
LEGGE DELLA PRESSIONE
Un solido non e' comprimibile
Un liquido e' poco comprimibile.
Es.bar 3000 per un
Vh - Vh' =
V = 1/10e
V
Un gas e' molto comprimibile.
Es. 1,12 bar per fare variare il volume
V = 1/10e ; Vh - Vh' = V
16/01/2011
14
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
RIEPILOGO
1)
Che cos'e' una pressione?
E' l'effetto che produce una forza su una certa superficie.
2)
Un corpo pesante come esercita la sua pressione su una superficie?
La esercita perche' essendo pesante preme sulla superficie e l'effetto e' tanto
maggiore quanto piu' a parita' di peso l'area su dui esso agisce e' ristretta.
3)
Perche' un chiodo si riesce a piantare meglio di un cilindretto senza punta?
Perche' a parita' di forza, che in questo caso e' rappresentata dal martello, la forza stessa
si concentra in una zona di area ristretta e quindi la pressione in quel punto e'
piu' forte.
4)
Che cosa succede nel caso di un liquido contenuto in un recipiente?
Che la pressione dipende unicamente dall'altezza della colonna del liquido e dal suo
peso specifico.
5)
Cosa significa "dipende solo dall'altezza della colonna del liquido"?
Significa che la pressione in un punto dipende solo dalla distanza misurata
verticalmente tra il livello del liquido ed il punto considerato: che si tratta quindi di
un lago o di una vaschetta d'acqua a pari dislivello corrisponde la stessa pressione.
6)
Supponiamo di avere un tubo verticale che contenga acqua dalla quota zero alla quota
5 metri ed uno inclinato che contenga parimenti acqua dalla quota zero alla
quota 5 metri.
Quale e' la pressione alla base dei due tubi, ossia alla quota zero?
E' di 5 metri di colonna d'acqua in tutti e due i casi.
7)
Che cosa significa che la pressione dipende dal peso specifico?
Significa che una colonna di mercurio il cui peso specifico e' di 13,596 kg per
decimetro cubico esercita una pressione 13,596 volte superiore di quella esercitata da
una colonna d'acqua della stessa altezza, ma il cui peso specifico e' 1 kg per
decimetro cubico.
8)
Cosa accade se si esercita una pressione sulla superficie di un liquido, ad esempio
mediante un pistone?
Che la pressione si esercita identicamente in tutti i punti del liquido.
16/01/2011
15
Per. Ind. Marco Masi
9)
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
Se in un recipiente entro cui si esercita una pressione ad esempio di 5 kg/cmq, noi
misuriamo la pressione in un punto qualunque troviamo la pressione di 5 kg/cmq?
Si, noi troviamo tale pressione in qualsiasi punto, tuttavia nei punti del recipiente che
sono sotto il livello del punto piu' alto, a tale pressione si aggiunge anche quella dovuta
all'altezza della colonna d'acqua sovrastante.
10)
Cosa accade per i gas?
I gas riempiono totalmente il recipiente in cui vengono immessi e la pressione a cui
essi sono assoggettati e' uguale in qualsiasi punto.
11)
Abbiamo visto che in ogni punto del recipiente contenente un liquido sotto pressione,
alla pressione cui il il liquido e' assoggettato si aggiunge la pressione dovuta alla
colonna di liquido sovrastante. Tale fatto accade anche nei gas?
Si, ma non se ne tiene conto perche' il peso dei gas e' trascurabile.
12)
Che differenza c'e' tra un liquido ed un gas?
Che il liquido non e' comprimibile, mentre il gas e' comprimibile.
13)
C'e' un rapporto tra la pressione di un gas ed il volume in cui esso e' contenuto?
Si, c'e' un rapporto stretto, detto di proporzionalita', ossia dimezzando il volume
occupato da un gas, la sua pressione raddoppia.
14)
Abbiamo visto che un gas pesa, ma non si tiene conto della colonna di gas dato che il
peso e' trascurabile. Quand'e' che il fenomeno non e' piu' trascurabile?
Nel caso dell'aria atmosferica in quanto la colonna d'aria che ci sovrasta e' tanto alta
che esercita una pressione notevolmente alta, ossia la pressione atmosferica.
15)
Perche' in un tubo verticale chiuso ad un'estremita' e posto con l'altra estremita' in
una vaschetta d'acqua, l'acqua si alza allorche' si fa il vuoto nel tubo?
Perche' nel tubo in cui si e' fatto il vuoto non c'e' piu' la pressione atmosferica,
mentre
la pressione esiste sullo specchio liquido e quindi l'acqua si alza nel tubo spinta
da
tale
pressione.
16)
A quale altezza giunge l'acqua?
L'acqua giunge a circa metri 10,33 ossia sino a dove viene spinta dalla pressione
atmosferica.
16/01/2011
16
Per. Ind. Marco Masi
17)
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
E se in luogo di acqua usassimo mercurio?
Dato che il peso specifico del mercurio e' 13,596 volte quello dell'acqua esso
verrebbe spinto dalla pressione atmosferica ad un'altezza 13,596 volte inferiore, ossia
circa 76 centimetri.
18)
Quale valore ha dunque la pressione atmosferica?
Circa 1 chilogrammo e 33 grammi per centimetro quadrato, dato che 10 metri di
colonna di acqua corrispondono a 1 chilogrammo per cmq.
19)
Perche' si dice circa 1 kg e 33 g?
Perche' tale pressione detta "atmosferica" si misura solo al livello del mare, a 45° di
latitudine, con aria secca e 0°C di temperatura.
20)
La pressione atmosferica varia?
Si, la pressione atmosferica varia secondo l'altezza sul livello del mare, secondo la
latitudine, secondo l'umidita' e la temperatura dell'aria.
21)
Se facendo il vuoto l'acqua sale a metri 10,33 possiamo con una pompa aspirare l'acqua
da tale profondita'?
No, perche' il valore di metri 10,33 corrisponde ad acqua a 40°C ed al vuoto
perfetto. Con l'acqua di pozzo a circa 20°C e con le pompe di tipo corrente non si
superano 6,5 metri.
22)
Cosa accade se l'acqua e' calda?
Se l'acqua e' calda si verificano dei fenomeni particolari, per cui gia' a 70°C l'acqua
non si puo' piu' aspirare ed a temperature superiori occorre farla addirittura pervenire
alle pompe con una certa pressione.
23)
Come si misurano le pressioni nei liquidi e negli aeriformi?
Col manometro.
24)
Cosa sono i barometri?
Sono manometri usati per misurare le variazioni della pressione atmosferica.
16/01/2011
17
Per. Ind. Marco Masi
25)
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
Cosa si intende per pressione effettiva e per pressione assoluta?
La pressione effettiva e' quella che si legge sul manometro che reca lo zero in
corrispondenza alla pressione atmosferica. La pressione assoluta e' quella effettiva
piu' la pressione atmosferica.
26)
Perche' normalmente non ci accorgiamo della pressione atmosferica?
Perche' essa opera in tutti i punti e, per esempio, e' vero che sulla faccia di un foglio
opera una pressione di 1,033 kg/cmq, ma e' anche vero che una identica pressione opera
sull'altra faccia del foglio.
16/01/2011
18
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
Tabella di conversione unità di pressione
GRANDEZZA
Pressione
GRANDEZZA
ESPRESSA IN:
Pascal
Bar
Chilogrammo forza per
cmq kgf/cmq
Atmosfera normale atm
mm d'acqua a 4°C
mm mercurio a 0°C
16/01/2011
PER LA TRASFORMAZIONE:
Bar (bar)
Millibar (mbar)
Atmosfera normale atm
Chilogrammo forza per cmq
Millimetro d'acqua a 4°C mmH2O
Millimetro di mercurio a 0°C mm Hg
Millibar mbar
Atmosfera normale atm (fisica)
Chilogrammo forza per cmq kgf/cmq
Millimetro d'acqua a 4°C mmH2O
Millimetro di mercurio a 0°C mm Hg
Pascal Pa
Sistema di unita' anglosassone Psi
Newton centimetro quadrato N/cmq
Pascal Pa
Bar bar
Millibar mbar
Atmosfera normale atm
Millimetro d'acqua a 4°C mm H2O
Millimetro di mercurio a 0°C mm Hg
Pascal Pa
Bar bar
Millibar mbar
Chilogrammo forza per cmq kgf/cmq
Millimetro d'acqua a 4°C mm H2O
Millimetro di mercurio a 0°C mm Hg
Pascal Pa
Millibar mbar
Bar bar
Atmosfera normale atm
Chilogrammo forza per cmq kgf/cmq
KPa
Pascal Pa
Millibar mbar
Bar bar
Atmosfera normale atm
mm di acqua a 4°C
Kg f per cmq
MOLTIPLI_
CARE PER:
10-5
10-2
9,87 10-6
1,02 10-5
0,102
0,75 10-2
103
0,987
1,02
1,02 104
7,5 102
105
14,50
10
9,81 104
0,981
9,81 102
0,968
104
7,35 102
1,013 105
1,013
1,013 103
1,033
1,033 104
760
9,81
9,81 10-2
9,81 10-5
9,68 10-5
10-4
9,81 10-3
133,3
1,33
1,33 10-3
1,32 10-3
13,6
1,36 10-3
19
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
NOZIONI DI TERMOLOGIA
CALORE E TEMPERATURA
Tutti i corpi sono costituiti da atomi i quali a loro volta costituiscono le molecole. Le molecole
non mantengono una posizione fissa ma continuamente vibrano, emettendo una particolare forma
di energia, chiamata "energia termica". Fornendo calore ad un corpo ne aumenteremo la propria
energia.
La temperatura non misura la quantita' di energia (calore) posseduta da un corpo, bensi' il livello
termico di questo.
Occorre distinguere perfettamente la differenza che passa tra calore e temperatura. Proviamo, per
rendere piu' chiara la questione, di fare un esempio. Immaginiamo che A e B siano due recipienti
contenenti acqua.
Nel recipiente A c'e' pero' una quantita' di acqua 5 volte superiore che in B.
Riscaldiamonmediante una fiamma che bruci sotto il recipiente A per 5 minuti, indi immergiamo
una mano nel fluido. Sentiremo che l'acqua si e' riscaldata.
Ora ripetiamo l'operazione con il recipiente B. Se immergeremo una mano nell'acqua, potremo
notare come questa sia molto piu' calda della precedente, nonostante che ai due recipienti sia
stata fornita la stessa quantita' di energia termica. L'effetto prodotto quindi, e' diverso. Noi
chiameremo questo effetto "temperatura".
Possiamo dire che il calore rappresenta la quantita' di energia posseduta da un corpo, mentre la
temperatura indica il livello al quale questa energia e' contenuta nel corpo.
L'energia termica contenuta in un serbatoio di 1000 lt. di acqua a 25°C e' molto maggiore di
quella contenuta in una pentola di 10 lt. alla temperatura di 90°C.
16/01/2011
20
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
LA TEMPERATURA
La temperatura puo' essere definita come il livello o l'intensita' di calore di un corpo. La
temperatura da sola non puo' dare la quantita' di calore contenuta nei corpi: la temperatura
costituisce solo un'indicazione del livello o della intensita' del calore.
La temperatura nel SI viene misurata in Kelvin (K).
Nel Sistema Tecnico essa si misura in gradi centigradi (°C).
Per convenzione viene dato il valore di 0°C alla temperatura del ghiaccio d'acqua fondente, e di
100°C alla temperatura di ebollizione dell'acqua al livello del mare.
La temperatura termodinamica (assoluta) viene misurata in kelvin (K).
Gli intervalli di temperatura possono essere misurati indifferentemente in kelvin o in gradi
Celsius e mantengono lo stesso valore in entrambe le scale.
Tra la temperatura misurata in gradi Celsius e quella in kelvin esiste la relazione che segue:
t = Tk - To
dove:
t
=
temperatura in gradi centigradi;
Tk
=
temperatura termodinamica in kelvin;
To
=
273,15 K (per definizione).
16/01/2011
21
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
UNITA' DI MISURA DELLA TEMPERATURA
Queste due temperature fisse sono:
a)
la temperatura dell'acqua distillata in fase di solidificazione (detta: ghiaccio fondente)
valutata alla pressione atmosferica media, che viene assunta come limite inferiore;
b)
la temperatura dell'acqua distillata in fase di ebollizione alla pressione atmosferica,
che viene assunta come limite superiore.
Alle temperature suddette, si assegnano valori convenzionali, ed il relativo intervallo viene
suddiviso in tratti uguali, la cui ampiezza varia a seconda della scala proposta:
-
La scala Celsius (fig. 164 a) assegnata ai due punti fissi le temperature convenzionali
rispettivamente di 0° e 100°; ne consegue che l'intervallo e' suddiviso in 100 parti uguali
e per tal motivo, si definisce comunemente "scala centigrada".
Indicheremo la temperatura centigrada con "t" ed il relativo valore numerico con °C.
-
La scala Fahrenheit (fig. 164 b), impiegata comunemente nei paesi di lingua
anglosassone, assegna ai due punti fissi rispettivamente i valori di 32° e 212°,
dividendone l'intervallo in 180 parti uguali.
Fra le due scale termometriche suddette, esiste la proporzione:
°C : 100 = (°F - 32) : 180
e da questa si puo' ricavare:
°C = 5/9 (°F - 32)
relazione con la quale si ottiene il valore della temperatura centigrada corrispondente ad un
valore dato in gradi Fahrenheit.
16/01/2011
22
Per. Ind. Marco Masi
-
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
La scala Reamur (fig. 164 c) infine, assegna ai due punti fissi i valori di 0° ed 80°,
ma il suo uso e' inconsueto.
Nei calcoli di termodinamica, si impiega comunemente un'altra scala termometrica che
costituisce una conseguenza di quella centigrada: e' noto dalla fisica che se si potesse asportare
ad un corpo tutto il calore che possiede, esso raggiungerebbe una temperatura teorica di - 273°C.
Tale limite viene definito "zero assoluto"; e' possibile quindi impostare una nuova scala
termometrica (detta "scala assoluta" o "scala Kelvin") assegnando il valore nullo allo zero
assoluto (-273°C) e mantenendo la suddivisione centesimale (fig. 164 d).
Indicheremo la temperatura assoluta con "T" ed il valore numerico di essa con °K; fra
temperatura assoluta e temperatura centigrada esiste ovviamente la relazione:
T = t + 273
16/01/2011
23
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
SCALE TERMOMETRICHE
Confronto tra scale termometriche relative ed assolute:
A - Temperatura d'ebollizione dell'acqua e pressione nominale.
B - Temperatura di fusione del ghiaccio.
C - Zero assoluto.
16/01/2011
24
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
IL CALORE
Definizione
Tutti i corpi sono costituiti da molecole, soggette a dei moti continui tra loro. Il calore non e'
altro che questo moto. Fornendo calore ad un corpo se ne aumenta l'agitazione molecolare.
Sottraendo invece calore l'agitazione molecolare viene ad essere rallentata, fino ad arrestarsi del
tutto alla temperatura dello zero assoluto (- 273°C). In questa condizione tutto il calore risulta
estratto dal corpo.
Il calore tende naturalmente a fluire da dove e' presente a un livello maggiore, verso dove e'
presente a un livello minore. Questa e' una condizione molto importante poiche' determina cio'
che noi chiamiamo "freddo". Infatti in natura non si puo' parlare di freddo ma solo di calore, che
puo' trovarsi a livelli diversi. E' la sottrazione di calore che determina quell'effetto da noi
chiamato freddo.
Possiamo ora anticipare una considerazione: tutte le macchime cosiddette frigorifere
non"producono freddo" bensi' sottraggono calore ai corpi o ai fluidi che devono trattare.
UNITA' DI MISURA DEL CALORE
L'unita' di misura della quantita' di calore nel SI e' il joule (J).
L'unita' di misura della potenza e del flusso di calore e' il watt (W).
1 W = 1 joule/secondo
Un suo multiplo e' il kilowatt (kW) = 1000 W
Nel sistema Tecnico l'unita' di misura della quantita' di calore e' la caloria (Cal) a cui corrisponde
la caloria /ora (Cal/h) come unita' di misura della potenza e del flusso di calore.
Un multiplo della caloria e' la kCal (= 1000 calorie).
1 kCal = 4,186 x 103 J
1 J = 0,24 Caloria
1 J = 0,239 x 10-3 kCal
L'unita' di misura del calore e' la "kilocaloria" (o Grande Caloria), definita come la
quantita' di calore che si deve somministrare ad un kilogrammo di acqua distillata per
elevare la sua temperatura da 14,5°C a 15,5°C.
16/01/2011
25
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
Indicheremo questa unita' di misura con il simbolo kCal (oppure Cal); essa non deve essere
confusa con la piccola caloria (o grammo-caloria) il cui impiego e' diffuso nelle esperienze di
laboratorio.
Nei paesi di lingua anglosassone viene invece definita l'unita' di misura del calore come la
180a parte della quantita' di calore che si deve somministrare ad una libbra di acqua
distillata per portarla dalla temperatura del ghiaccio fondente a quella di ebollizione, alla
pressione atmosferica.
Tale unita' di misura viene indicata con la sigla B.T.U. (British Termal Unit) e corrisponde
mediamente a 0,252 kCal.
CALORE SPECIFICO (solido o liquido)
Si riscontra facilmente che non tutti i corpi si riscaldano in egual misura quando venga loro
somministata - nelle identiche condizioni - una stessa quantita' di calore "Q".
Si dice in questi casi che i corpi hanno diversa "capacita' termica", caratteristica che varia a
seconda della natura del corpo e del peso "P" di esso.
A parita' di peso, la capacita' termica dipende esclusivamente dalla natura del corpo; la grandezza
che ne condiziona l'assorbimento del calore ad esso somministrato viene denominata "calore
specifico".
Si definisce quindi il calore specifico (C) di un corpo (solido o liquido) come la quantita' di
calore che occorre somministrare all'unita' di peso di esso, per elevarne la temperatura di
1°C.
Esso si misura in kCal/kg°C, come si puo' facilmente dedurre dalla definizione stessa; inoltre,
confrontando quest'ultima con quella dell'unita' di misura del calore, si rileva che,per l'acqua,
esse coincidono; il calore specifico dell'acqua distillata vale quindi 1 kCal/kg°C. La definizione
sopracitata non e' pero' rigorosa; il calore specifico di una sostanza, non ha infatti un valore
costante, ma cresce lentamente all'aumentare della temperatura, con legge pressoche'
lineare.
Nei calcoli occorrera' quindi valutare un "calore specifico medio" (Cm) nell'intervallo di
temperatura che si considera; detto "P" il peso del corpo, se vogliamo aumentare la sua
temperatura dal valore "t1" al valore "t2" (1) dovremo somministrare una quantita' di calore:
Q = P Cm (t1 - t2)
e quindi il calore specifico medio nell'intervallo di temperatura considerato, vale:
Q
Cm = -----------------P (t2 - t1)
__________________________________
(1)
Ci siamo riferiti in questo caso, alle temperature centigrade anziche' a quelle assolute; cio' e' ammissibile in quanto,
trattandosi di una differenza, il risultato numerico non subisce variazioni. E' da evitare comunque tale sostituzione quando si
tratti di rapporti o di prodotti fra temperature
16/01/2011
26
Per. Ind. Marco Masi
16/01/2011
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
27
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
CALORE SPECIFICO (di gas o vapore)
Nel caso di gas o di vapori (che indicheremo con il termine comune di aeriformi) occorre definire
due diversi calori specifici, a seconda che la somministrazione di calore venga effettuata
mantenendo costante la pressione cui il gas e' sottoposto, oppure mantenendo costante il suo
volume.
Si definisce pertanto "calore specifico a pressione costante" (Cp) la quantita' di
calore che si deve somministrare all'unita' di peso di un gas, per elevare la sua temperatura
di 1°C, mantenendo costante la pressione.
Del tutto analoga e' la definizione del "calore specifico a volume costante" (Cv).
Per un determinato gas, i valori numerici dei due calori specifici suddetti, differiscono fra loro, e
piu' precisamente, e' sempre:
Cp > Cv
E' possibile rendersi conto di tale diseguaglianza, valutando il diverso comportamento del gas nei
due casi: se esso viene riscaldato, mantenendo costante la pressione, il suo volume tende ad
aumentare (come vedremo meglio piu' innanzi) compiendo un certo lavoro contro le forze
esterne; ne consegue che per ottenere l'aumento di temperatura desiderato, occorrera'
somministrare una quantita' di calore maggiore di quella necessaria se il riscaldamento avvenisse
(a parita' di altre condizioni) a volume costante.
Si usa talvolta esprimere il calore specifico di un aeriforme in kCal/m3°C; questa unita' di misura
puo' dar luogo a notevoli errori, ove non si tenga presente che si tratta di fluidi comprimibili e
quindi il loro volume e' condizionato sia dalla pressione che dalla temperatura.
Volendo quindi riferire il calore specifico ai volumi, anziche' ai pesi, si stabilisce di considerare
il volume dell'aeriforme alla pressione di 760 mm di Hg ed alla temperatura di 0°C; tale volume
viene definito "normale".
L'unita' di misura del calore specifico e' quindi kCal/Nm3°C (kilocalorie per normalmetrocubo e
per grado cent.).
Concludiamo il presente paragrafo, riportando nella tabella n.9 i valori (in kCal/kg°C e in kj/kg
K) dei calori specifici di alcune sostanze liquide e solide.
16/01/2011
28
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
TABELLA: CALORE SPECIFICO DI ALCUNE SOSTANZE
SOSTANZA
SISTEMA NORME S.I.
SISTEMA TECNICO
Calore specifico
calore specifico kCal/(kg °C)
kJ/(kg x K)
Gas
acetilene
1,58
alcool etilico
1,52
alcool metilico
1,35
ammoniaca
2,20
aria secca:
0,52
0,24
- a pressione costante
1,006
- a volume costante
0,716
0,17
anidride carbonica
0,84
0,2
azoto
1,04
0,248
benzene
1,30
butano
1,58
esano
1,88
etilene
1,47
fluoro
0,81
idrogeno
14,20
metano
2,18
ossigeno
0,913
propano
1,57
vapore d'acqua
2,050
0,193
0,218
0,49
Liquidi
acetone
acqua
2,15 (276-296 K)
4,18 (293 K)
alcool etilico
2,84 (273-371 K)
alcool metilico
2,51 (288-293 K)
ammoniaca
4,60 (273 K)
benzene
1,72 (293 K)
1
brine di cloruro di sodio
- 20% ponderale
3,11 (293 K)
- 10% ponderale
3,62 (293 K)
esano
2,25 (293 K)
kerosene
2,00 (293 K)
idrogeno
2,00 (293 K)
petrolio
3,00
Solidi
acciaio
0,50
alluminio (lega 1100)
0,896
argento
0,235
bronzo
0,435
carbone di legna
0,84
carbone minerale
1,00
carta
1,30
cellulosa
1,30
coke
1,5
ferro
0,50
0,112
ghiaccio d'acqua
- 0°C
2,040
0,448
- -20°C
1,95
0,466
gomma
2,00
lana di vetro
0,657
legno: essenze dure
1,9 - 2,7
marmo
0,88
neve: fresca
0,10
0,0239
0,50
0,119
a 0°C
nichel
0,44
ottone
0,40
paraffina
2,90
pietra
0,80
piombo
0,129
rame elettrolitico
0,39
sabbia
0,80
silice
1,32
stagno
0,233
vetro-pyrex
0,84
16/01/2011
29
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
NOTE
I calori specifici dei gas sono riferiti alla pressione di 101 kPa, e temperatura di 273,15 K; o a quella di saturazione se piu' elevata.
Per i liquidi, i calori specificisono riferiti alle temperature assolute a fianco indicate
16/01/2011
30
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
STATI FISICI DELLA MATERIA
Premettiamo la fondamentale distinzione fra sostanze e corpi:
CORPI sono gli oggetti con le loro proprieta' contingenti, vale a dire dimensioni, forma, peso,
ecc.
SOSTANZA e la materia che costituisce i corpi, indipendentemente dalle suddette proprieta'.
La materia e' sempre costituita da un insieme di piccolissime particelle - gli atomi - che, a loro
volta, sono formati da corpuscoli ancora piu' ridotti, in genere caricati elettricamente.
Elemento base per individuare una sostanza e' pero' la MOLECOLA che puo' essere formata da
uno o piu' atomi, uguali tra loro o no, e che ci appare come un sistema equilibrato di particelle.
Un aggregato costituito da molecole tutte uguali, forma una sostanza chimicamente definita. Tra
le molecole che costituiscono una sostanza agiscono forze di attrazione chiamate genericamente
forze di coesione.
La materia presenta tre strati di aggregazione:
solido
liquido
aeriforme
Sono solide le sostanze in cui le forze di coesione hanno notevole intensita', tale da determinare
la costanza di volume e di forma (salvo l'intervento di azioni meccaniche esterne);
sono liquide le sostanze, in cui le forze di coesione sono di gran lunga minori delle precedenti,
che assumono la forma del recipiente in cui sono introdotte, pur avendo volume proprio.
Sono aeriformi le sostanze che, a causa delle ridottissime forze di coesione che legano le loro
molecole, non possiedono volume ne' forma propria.
Quanto sopra deve essere considerato nelle normali condizioni ambientali di temperatura e di
pressione.
Accentueremo la nostra attenzione sulle sostanze aeriformi tenendo presente che esse si
suddividono in:
-
gas
vapori.
Per chiarire la differenza tra gas e vapori occorre definire l'esistenza di una temperatura critica al
di sopra della quale nessun aeriforme puo' venire liquefatto, anche se sottoposto a pressioni
elevatissime. Si definiscono gas gli aeriformi che stanno a temperatura superiore della loro
temperatura critica, vapori quelli che ne stanno al di sotto.
Ogni temperatura critica e' caratteristica di ciascuna sostanza, nella seguente tabella sono
riportate a titolo di esempio varie temperature critiche:
16/01/2011
31
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
SOSTANZE
Etere etilico
Ammoniaca
Anidride carbonica
Metano
Propano
Ossido di carbonio
Aria (media)
Ossigeno
Azoto
Idrogeno
Acqua
Cloro
TEMPERATURE CRITICHE (°C)
193,0
132,4
31,1
-82,6
96,0
-140,2
-140,0
-118,8
-147,0
-240,0
374,0
144,0
Anche se nella pratica comune si fa confusione delle due definizioni, e' evidente che e' improprio
chiamare gas l'ammoniaca, il propano, il cloro e l'anidride carbonica nelle normali condizioni.
CAMBIAMENTO DI STATO FISICO
E' noto dalla fisica che quasi tutte le sostanze possono - in particolari condizioni di pressione e di
temperatura - subire dei cambiamenti di stato fisico, passare cioe' da solido a liquido (o
viceversa) oppure da liquido ad aeriforme (o viceversa).
Ci soffermeremo su quest'ultimo cambiamento di stato che interessa particolarmente la
termodinamica e le macchine termiche a vapore, ricordando tuttavia che molte delle conclusioni
cui perverremo sono valide anche per il passaggio da solido a liquido o viceversa.
Il cambiamento di stato fisico da liquido ad aeriforme puo' avvenire secondo due modalita'
diverse: per "evaporazione" o per "ebollizione" ( o vaporizzazione). Il fenomeno
dell'evaporazione e' una spontanea caratteristica di tutte o quasi le sostanze liquide; esso viene in
qualsiasi condizione di temperatura e pressione ma in modo lento e graduale,
interessando solo le particelle liquide che formano la superficie libera.
Alcuni liquidi evaporano molto facilmente, ed anche piuttosto rapidamente (liquidi facilmente
volatili) mentre per gli altri, il fenomeno e' talmente lento da non risultare apprezzabile.
Le cose cambiano notevolmente se il passaggio fra i due stati (liquido/aeriforme) viene
artificialmente affrettato mediante somministrazione di calore dall'esterno: il liquido inizialmente
aumenta la sua temperatura fino ad un valore - che per ogni singola sostanza dipende
esclusivamente dalla pressione che su di essa viene esercitata - oltre il quale il fenomeno inizia in
modo rapido e tumultuoso interessando tutta la massa.
Si nota che durante lo svolgimento del fenomeno (cioe' fino a quando tutto il liquido si e'
vaporizzato) la temperatura rimane costante, pur continuando a somministrare calore
dall'esterno.
Tale temperatura viene definita "temperatura di ebollizione" della sostanza in questione.
16/01/2011
32
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
Completata la trasformazione, tutto il liquido si e' trasformato in vapore la cui temperatura nell'istante finale - e' sempre eguale a quella di ebollizione.
Se continuiamo a somministrare calore, il vapore aumenta la sua temperatura allontanandosi cosi'
dalle condizioni che favoriscono il cambiamento di stato; questo esempio ci e' utile per
differenziare, come gia' detto precedentemente, gli aeriformi in due categorie:
-
"vapore" quando l'aeriforme si trova ad una temperatura prossima a quella di
ebollizione alla pressione cui e' sottoposto;
-
"gas" quando la temperatura dell'aeriforme e' sufficientemente lontana da quella di
ebollizione.
Questa distinzione era necessaria per la corretta applicazione delle leggi che illustreremo fra
poco; esse furono dedotte supponendo di riferirsi a dei "gas perfetti", non esistenti in natura, ma
si dimostrarono tuttavia sufficientemente attendibili anche se applicate ai gas reali sopradefiniti.
E' bene rilevare invece che si commetterebbe grave errore applicando tali leggi agli aeriformi
quando la loro temperatura e' uguale ( o molto prossima) al valore corrispondente all'ebollizione.
16/01/2011
33
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
CAMBIAMENTI DI STATO
1.
2.
Assorbimento di calore
Restituzione di calore
E' possibile cambiare lo stato di un corpo riscaldandolo o raffreddandolo.
Durante tutta la durata del cambiamento di stato, la temperatura del corpo resta fissa.
Sotto una stessa pressione, il cambiamento di stato si effettua sempre alla stessa temperatura.
FUSIONE
Passando dallo stato solido allo stato liquido, alla temperatura costante di 0°C, il ghiaccio
assorbe una quantita' d'energia uguale a 80 kCal/kg. Il calore assorbito dal ghiaccio per fondere e'
chiamato latente di fusione
16/01/2011
34
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
EVAPORAZIONE
E' la trasformazione lenta di un liquido in vapore che si verifica, a differenza dell'ebolizzione,
soltanto alla superficie, in un ambiente gassoso e a qualsiasi temperatura, fino a quando il vapore
raggiunge la sua pressione di saturazione.
Qualunque processo d'evaporazione avviene con assorbimento piu' o meno importante di calore
(seguendo il calore latente d'evaporazione del liquido considerato).
L'evaporazione si verifica non appena la pressione di vapore e' inferiore alla sua pressione di
saturazione. Più la differenza di pressione e' grande, più è veloce l'evaporazione nel raggiungere
l'ebollizione.
EBOLLIZIONE
E' la produzione di vapore nella massa di liquido. Ogni liquido puro entra in ebollizione alla
temperatura in cui la sua pressione di vapore e' uguale alla pressione del liquido. Dato che a una
determinata temperatura, puo' corrispondere un solo valore di pressione di vapore, l'ebollizione
del liquido (sotto una certa pressione) avverra' sempre alla stessa temperatura, che restera'
costante durante tutta la durata di tale ebollizione.
E' cosi' che l'acqua bolle a +100C alla pressione atmosferica, cioe' una pressione di 1,033
kg/cmq.
L'acqua bolle anche a una temperatura di +80°C se la pressione e' ridotta a 0,5 kg/cmq e a
+150°C se la pressione e' di 5,16 kg/cmq.
E' proprio su questo fenomeno di ebollizione (che puo' solo prodursi con l'assorbimento di
calore) che e' basata la tecnica attuale di refrigerazione. Ma, nel caso dell'acqua, bisogna
raggiungere 100°C per farla bollire; mentre la maggior parte dei fluidi frigorigeni hanno una
temperatura d'ebollizione (alla pressione atmosferica) nettamente al di sotto di 0C.
E' cosi' che l'R12 bolle a -29,8°C e l'R22 a -40,8°C.
CONDENSAZIONE
E' il fenomeno inverso all'evaporazione.
Se, diminuendo la pressione sulla superficie del liquido, si puo' provocare l'ebollizione,
all'inverso, aumentando questa pressione i vapori si liquideranno. Si puo' anche provocare la
condensazione raffreddando il vapore fino alla temperatura corrispondente alla pressione di
condensazione.
Per uno stesso liquido alla stessa pressione, la temperatura di condensazione e' la stessa che la
temperatura d'evaporazione.
16/01/2011
35
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
CALORE LATENTE DI FUSIONE
Il calore latente di fusione di una sostanza rappresenta il quantitativo di calore necessario per
provocare il passaggio dallo stato solido allo stato liquido, di 1 kg della sostanza medesima, a
temperatura costante.
Nel caso del ghiaccio d'acqua, ad esempio, il calore latente di fusione e' di 333,8 kJ/kg (80
kCal/kg). Durante la fusione si ritiene che la temperatura rimanga a 0°C e la pressione sia quella
atmosferica.
Per fare un esempio pratico, immaginiamo di avere 1 kg di ghiaccio di acqua alla temperatura di
-20°C e di cominciare a scaldarlo. La temperatura del ghiaccio aumentera' progressivamente e in
modo lineare fino a 0°C. A questo punto, per quanto calore verra' fornito, la temperatura non
aumentera' fin tanto che tutto il ghiaccio non si sara' sciolto in acqua. Tutto il calore fornito in
questa fase sara' servito a far sciogliere il ghiaccio, senza aumentarne la temperatura: avra'
costituito cioe' il calore latente di fusione.
Possiamo vedere rappresentato nella fig. 1 questo processo.
Dal punto A al punto B si ha un aumento lineare della temperatura del ghiaccio da -20°C a 0°C.
Invece, dal punto B al punto C non si ha aumento di temperatura; in questa fase avviene la
trasformaziopne del ghiaccio in acqua.
Possiamo facilmente calcolare il quantitativo di calore necessario per riscaldare 1 kg di ghiaccio
da -20°C a 0°C con la formula che segue:
Q = Cs x
Q
Cs
t
=
=
=
t, dove:
quantitativo di calore necessario;
calore specifico del ghiaccio (valore medio tra -20°C e 0°C);
differenziale di temperatura.
Q = (1,99 x 20) = 39,8 kJ/kg = (10 kCal/kg).
Questo valore corrisponde sulla fig. 1 al punto B.
Il punto C corrisponde alla sua somma con il calore latente di fusione del ghiaccio:
S.I.
kJ/kg (39,8 + 333,8) = 373,6 kJ/kg
S.T.
kCal/kg = (10 + 80) = 90 kCal/kg.
16/01/2011
36
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
CALORE LATENTE DI VAPORIZZAZIONE
Il calore latente di vaporizzazione di una sostanza rappresenta il quantitativo di calore necessario
per provocare il passaggio di 1 kg della sostanza medesima dallo stato liquido saturo allo stato di
vapore.
Nel S.I. il calore latente di vaporizzazione si misura in kJ/kg.
Nel S.T. si misura in kCal/kg.
Nel caso dell'acqua, esso vale 2257 kJ/kg (540 kCal/kg) (partendo dalla temperatura di
saturazione cioe' 100°C).
Una sostanza per passare dallo stato liquido allo stato di vapore deve potere assorbire del calore.
Ritorniamo al kg di ghiaccio, scioltosi in acqua, di cui al paragrafo precedente.
Se continuiamo a scaldare l'acqua essa aumenterà linearmente la propria temperatura da 0°C fino
a 100°C. Si veda ancora la fig. 1. Raggiunti i 100°C, l'acqua inizierà a bollire, ma per quanto la si
potrà ancora riscaldare essa non aumenterà la propria temperatura.
Il calore fornito andrà invece a provocare l'evaporazione dell'acqua, a temperatura costante e a
pressione atmosferica. Esso costituirà perciò il calore latente di vaporizzazione.
Nella fig. 1 nel tratto C-D avviene l'aumento di temperatura dell'acqua, da 0°C a 100°C
(temperatura d'ebollizione dell'acqua).
Nel tratto D-E, avviene invece il cambiamento di stato dell'acqua: da liquido a vapore.
Ogni ulteriore quantità di calore fornita al vapore ne provocherebbe un surriscaldamento, con
elevazione della temperatura, come indicato nel tratto E-F.
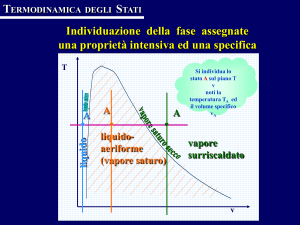
Vogliamo dare ora, rapidamente e con semplicità, alcune definizioni.
La temperatura d'ebollizione di un fluido viene anche detta temperatura di saturazione. Un fluido
si dice saturo quando, per una data pressione, si trova alla temperatura d'ebollizione.
Viene detto vapore saturo umido il vapore che si riscontra sopra il livello di un liquido, quando
questo si trova alla sua temperatura di ebollizione.
Invece si dice vapore saturo secco un vapore (non surriscaldato) non in presenza di liquido, come
lo si puo' avere, ad esempio, in un recipiente.
Perche' e' importante il calore latente di vaporizzazione
Immaginiamo di avere un fluido con una temperatura di ebollizione di 15°C.
Questo fluido, durante una normale giornata estiva (quando la temperatura sia maggiore di 15°C)
prendera' a bollire e a evaporare sottraendo calore dall'ambiente (quindi raffreddandolo) fino a
che non sara' evaporato del tutto.
In natura esistono numerosi composti che dispongono della proprieta' di avere temperature di
ebollizione, ridotta o molto ridotta.
Nelle macchine di refrigerazione, per effettuare la sottrazione di calore, viene sfruttata proprio
questa proprieta', tipica di alcuni composti, di avere temperature di ebollizione ridotte ed elevati
calori latenti di vaporizzazione in modo da asportare quantita' di calore quanto maggiori possibili
dall'ambiente o dal fluido da raffreddare.
16/01/2011
37
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
Attraverso questo diagramma temperatura-entalpia si possono capire i due fenomeni:
calore latente di fusione;
calore latente di vaporizzazione.
16/01/2011
38
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
ENTALPIA
L'entalpia puo' definirsi, in pratica, come la quantita' di calore posseduta da 1 kg di una sostanza
a una data temperatura.
Essa aumenta con l'aumentare della temperatura e diminuisce con il diminuire di quest'ultima.
Nel S.I. viene misurata in J/kg.
Nel S.T. viene invece misurata in kCal/kg.
L'entalpia del vapore d'acqua saturo e' data dalla somma di due grandezze. Vediamolo con
riferimento alla fig.1 . Nei tratti CD e DE si possono leggere i valori.
Se si riscalda ulteriormente il vapore d'acqua, oltre il punto di saturazione E, ne consegue un
aumento di temperatura, punto F.
Si fa l'ipotesi di avere elevato la temperatura di 20°C, passando da 100°C a 120°C. L'entalpia del
vapore surriscaldato (Es) sarà la somma dell'entalpia del vapore a 100°C piu' il quantitativo di
calore (N) fornito al vapore nella sua elevazione di temperatura, da 100°C a 120°C. Quest'ultimo
puo' facilmente calcolarsi, conoscendo il calore specifico del vapore d'acqua saturo a 100°C pari
a circa 1,227 kJ/kg (0,3 kCal/kg).
Si ottiene dunque:
S.I.
N = (1,227 x 20) = 24,54 kJ/kg
Es. (2670,4 + 24,54) = 2695 kJ/kg
S.T.
(0,3 x 20) = 6 kCal/kg
Es. (640 + 6) = 646 kCal/kg
16/01/2011
39
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
CONVERSIONI DELLE UNITA' DEL SISTEMA METRICO
GRANDEZZA
Forza
Lavoro o energia
GRANDEZZA ESPRESSA
PER LA TRASFORMAZIONE:
Newton N
chilogramma forza kgf
Joule (J)
chilogrammetro kgm
Watt ora
chilowatt ora kWh
Cavallo
Cv/h
Calore o energia
vapore
ora
Joule J
chilocaloria
Potenza
calorifica
o
potenza Watt W
Chilocalorie ora kCal/h
Chilogrammetro
secondo kgm/s
Cavallo vapore Cv
Frigorie fg
TON (British Unit)
BTU (British Unit)
16/01/2011
al
chilogramma forza kgf
Newton N
Chilogrammetro kg m
Watt ora Wh
Kilowatt ora kWh
Cavallo vapore ora Cv/h
Joule (J)
chilojoule kJ
Watt ora Wh
chilowatt ora kWh
Cavallo vapore ora Cv/h
chilowatt ora kWh
Cavallo vapore ora Cv/h
Chilogrammetro Kgm
Joule J
Joule J
Watt ora Wh
Chilogrammetro kgm
Cavallo vapore ora Cv/h
Joule J
Chilogrammetro kgm
Watt ora Wh
Chilowatt ora kWh
Calorie,piccola caloria cal
chilocalorie kCal (grandi calorie)
Termia th
Frigoria fg
Caloria cal
Joule J
Chilowatt ora kWh
Chilogrammetro kgm
Chilocaloria ora kCal/h
Frigorie fg
Chilocalorie al secondo kCal/s
Chilogrammetro al secondo kgm/s
Cavallo vapore Cv
Watt W
Chilowatt kW
Chilogrammetro al secondo kgm/s
Cavallo vapore Cv
Watt W
Chilowatt kW
Chilocalorie ora kCal/h
Cavallo vapore Cv
Watt
Chilowatt kW
Chilocalorie ora kCal/h
Chilogrammetro secondo kgm/s
Watt W
Chilowatt kW
Chilogrammetro secondo kgm/s
kCal o Frig
kCal o Frig
MOLTIPLICARE PER:
0,102
9,81
0,102
2,78 10-4
2,78 10-7
3,78 10-7
9,81
9,81 10-3
2,72 10-3
2,72 10-6
3,70 10-6
103
1,36 10-3
3,67 10-2
3,60 103
3,6 106
103
3,67 105
1,36
2,65 106
2,70 105
0,735 103
0,735
0,24
0,24 10-3
0,24 10-6
0,24 10-3
103
4,18 103
1,16 10-3
427
0,86
0,86
2,39 10-4
0,102
1,36 10-3
1,16
1,16 10-3
0,12
1,58 10-3
9,81
9,81 10-3
3,43
1,33 10-2
735,5
0,735
632,4
75
1,16
1,16 10-3
0,12
3000
0,252
40
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
PSICROMETRIA
Equazione dei gas perfetti
Ogni sostanza e' composta da molecole che si possono definire come la piu' piccola parte di una
sostanza che conservi le caratteristiche originali.
La molecola puo' essere a sua volta suddivisa in atomi, i quali non hanno tuttavia piu' le
caratteristiche della sostanza originale. Per esempio, una molecola di acqua ha ancora tutte le
caratteristiche dell'acqua: essa e' scomponibile in atomi di idrogeno e di ossigeno che tuttavia
presi separatamente non hanno piu' alcuna rassomiglianza con l'acqua.
Secondo una teoria generalmente accettata, tutte le molecole di una sostanza sono in continuo
movimento, movimento funzione crescente con la temperatura. Nei corpi solide le molecole sono
solo in continua vibrazione e non variano la loro posizione relativa, cosi' che presi si presentano
rigidi. Nei liquidi invece le molecole hanno una maggiore liberta', ma le forze di coesione sono
tali da impedire la loro separazione. Nelle sostanze aeriformi infine le molecole sono molto piu'
separate ed i loro movimenti tendono a diffondere indefinitivamente il gas fino a fargli occupare
il recipiente in cui si trova.
L'atmosfera in cui viviamo e' una miscela di diversi gas, la cui proporzione varia leggermente in
localita' diverse. I principali sono: ossigeno, azoto, argon e vapore acqueo, con tracce di anidride
carbonica, idrogeno, neon, ecc.
Nello studio delle proprieta' dell'aria atmosferica occorre distinguere l'aria perfettamente secca,
che segue con buona approssimazione le leggi fondamentali dei gas perfetti, dall'aria umida.
Quest'ultima infatti contiene del vapore acqueo che obbedisce alle leggi caratteristiche dei vapori.
Il comportamento dell'aria secca e' racchiuso nelle due leggi fondamentali dei gas perfetti la
legge di Boyle e la legge di Charles. La legge di Boyle dice che in un gas perfetto, a temperatura
costante, il volume e' inversamente proporzionale alla pressione. La legge di Charles dice che,
sempre in un gas perfetto, a pressione costante, il volume e' direttamente proporzionale alla
temperatura assoluta. Se combiniamo queste due leggi giungiamo alla legge fondamentale dei
gas perfetti:
PV= RT
PV = ART
per 1 kg di gas
per A kg di gas
in cui: P = pressione assoluta del gas in kg/m2
V = volume del gas in m3
A = peso del gas in kg
R = costante dei gas
T = temperatura assoluta (273+t)°C
16/01/2011
41
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
La costante dei gas R ha un legame interessante con il loro peso molecolare M: infatti e' costante
il prodotto R x M e precisamente e' uguale per tutti i gas a 848. Con questa relazione e' quindi
possibile calcolare molto semplicemente la costante R per ogni gas conoscendo il peso
molecolare.
Vediamo per esempio il caso dell'aria, che come sappiamo e' una miscela di diversi gas con la
seguente composizione volumetrica approssimata:
Costituente
Ossigeno (O2)
Azoto (N2)
Argon (A)
Parti in volume
0,210
0,781
0,009
______
1,000
Peso molecolare
Proporzione peso mol.
x 32
x 29
x 40
6,72
21,86
0,36
_______
28,94
Il peso molecolare apparente dell'aria e' quindi 28,94 e la costante R vale quindi 848/28,94 =
29,3.
A questo punto e' interessante mettere in rilievo il legame tra peso molecolare e volume
specifico. Il volume occupato da una kilomolecola, cioe' da un numero di kg di gas uguale al
numero che esprime il peso molecolare, e' costante per tutti i gas e vale 22,4 m3 in condizioni
"normali", cioe' a 760 mm di Hg e a 0°C. E' possibile quindi con questa relazione calcolare i
volumi specifici dei gas, noti i pesi molecolari, come si puo' vedere dagli esempi seguenti:
a)
il peso atomico dell'ossigeno e' 16, quindi il peso molecolare (O2) e' 2 x 16 = 32. Il
volume specifico dell'O2 a 760 mm Hg e a 0°C e' quindi 22,4/32 = 0,700 m3/kg.
b)
peso molecolare del CO2 = 12 + (2 x 16) = 44
Volume specifico 22,4/44 = 0,510 m3/kg.
c)
per l'aria si ha, in condizioni normali, 22,4/28,94 = 0,778 m3/kg.
Per ottenere il volume specifico a 20°C occorrera' moltiplicare tale valore per il
rapporto delle temperature assolute:
273 + 20
0,778 x ----------------- = 0,835 m3/kg
273
Le leggi dei gas perfetti sono per esempio applicate in casi simili:
a)
Sia data dell'aria a 20°C e a 760 mm Hg, quindi con volume specifico di 0,835
m3/kg.
2
A temperatura costante se ne aumenta la pressione di 0,35 kg/cm , quale sara' il nuovo volume
specifico? Applicando la legge di Boyle e ricordando che la
pressione
atmosferica
corrisponde a 1,033 kg/cm2, si ha:
16/01/2011
42
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
1,033
V = ----------------------- x 0,835 = 0,620 m3/kg
1,033 + 0,35
Se invece partendo dalle condizioni iniziali si raffredda a - 18°C a pressione costante
quale sara' il nuovov volume specifico? Applicando la legge di Charles si ha:
273 - 18
V = -------------------------- x 0,835 = 0,725 m3/kg.
273 + 20
b)
Un kg di aria a 760 mm Hg occupa un volume di 0,725 m3. Determinare la sua
temperatura applicando la legge dei gas perfetti:
PV = ART
PV
1,033 x 104 x 0,725
T = ------------- = ---------------------------------------- = 255° (assoluti)
AR
1 x 29,3
t = 255 - 273 = -18°C
c)
Dato 1 kg di aria a 20°C ed alla pressione relativa di 0,35 kg/cm2, determinare il suo
volume applicando la legge dei gas perfetti:
PV = ART
ART
1 x 29,3 x (273 + 20)
V = ----------------- = ----------------------------------- = 0,618 m3
P
(1,033 + 0,35) x 104
d)
Un pneumatico d'automobile contiene 0,25 kg di aria, la quale occupa un volume di
0,057 m3 ad una pressione relativa di 2,8 kg/cm2 ed ad una temperatura di 24°C. La
pressione barometrica e' al 1,01 kg/cm2. Applicando la legge di Charles, determinare
la pressione pneumatica quando la temperatura dell'aria salga a 54°C, immaginando
che il volume rimanga costante.
P1 T2
(2,8 + 1,01) (273 + 54)
P2 = -------------- = -------------------------------------- = 4,20 kg/cm2 assoluti
T1
273 + 24
16/01/2011
43
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
La pressione relativa risulta 4,20 - 1,01 = 3,19 kg/cm2 . Come verifica abbiamo:
ART
0,25 x 29,3 x 327
P = ---------------- = ------------------------------- = 4,20 kg/cm2 assoluti
V
0,057 x 104
Pressione relativa 4,20 - 1,01 = 3,19 kg/cm2.
Poiche' l'aria atmosferica e' una miscela di piu' gas e di vapore acqueo, la pressione atmosferica e'
la somma delle pressioni parziali esercitate da ciascun componente: questo e' il risultato della
legge di Dalton, la quale dice che due o piu' gas possono occupare contemporaneamente lo stesso
spazio, e che la pressione totale della miscela e' la somma delle pressioni parziali dei
componenti, cioe' delle pressioni che ciascun componente eserciterebbe se occupasse da solo
l'intero spazio. Questa legge e' particolarmente importante per lo studio delle miscele aria-vapore.
VAPORE ACQUEO
Esaminiamo ora alcune delle proprieta' fondamentali del vapore d'acqua che ci saranno utili piu'
avanti. Noi tutti sappiamo cosa succede quando si riscalda dell'acqua contenuta in un recipiente
aperto. Se partiamo da acqua a 0°C e forniamo del calore, vedremo la temperatura salire
progressivamente fino a 100°C. A questo punto (alla pressione atmosferica standard) l'acqua
inizia l'ebollizione: la sua temperatura rimane costante e, se forniamo il calore necessario,
vedremo dopo un certo tempo tutta l'acqua trasformarsi in vapore.
Dobbiamo tuttavia precisare che l'evaporazione dell'acqua si verifica, se pur in misura minore,
anche durante il periodo di riscaldamento e raggiunge il ritmo massimo quando la temperatura e'
massima. Comunque il fatto importante e' che per trasformare dell'acqua in vapore occorre una
ben determinata quantita' di calore e che questa quantita' e' legata alla temperatura ( o alla
pressione) dell'acqua.
Se vogliamo esaminare il fenomeno dal punto di vista molecolare, possiamo immaginare che la
vaporizzazione consiste nella liberazione delle ,olecole dalle forze di attrazione
molecolareproprie dello stato liquido. Se ora chiudiamo il recipiente, riempito parzialmente di
acqua, con un coperchio a tenuta, il vapore sviluppantesi rimarra' sopra la superficie del liquido,
e se l'acqua e' mantenuta ad una temperatura costante, per esempio 40°C, vi sara' un continuo
sviluppo di molecole allo stato di vapore nello spazio libero. Contemporaneamente tuttavia
alcune molecole di vapore colpiranno la superficie dell'acqua e ritorneranno allo stato liquido, il
fenomeno continuera' fino a che il numero di molecole di vapore che ritornano allo stato liquido
sara' esattamente uguale al numero di molecole che da liquide si trasformano in vapore.
In queste condizioni il vapore e' " in equilibrio con il liquido": esso si dice SATURO e la
pressione di equilibrio si dice PRESSIONE DI SATURAZIONE.
Il valore di questa pressione di saturazione e', per quanto abbiamo detto, legato alla temperatura,
essendo crescente in essa. Queste considerazioni si applicano non solo alle temperatura sopra
0°C, ma anche al ghiaccio.
16/01/2011
44
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
Se nel caso che abbiamo ora considerato il coperchio del recipiente viene tolto, il vapore non si
potra' accumulare sopra il liquido, esso non raggiungera' la saturazione e quindi non si potranno
raggiungere le condizioni di equilibrio. Il liquido allora si trasformera' interamente in vapore.
Il passaggio dallo stato liquido allo stato di vapore e' legato alla pressione esistente sulla
superficie del liquido.
Immaginiamo di aumentare improvvisamente la pressione sulla superficie di un liquido che e' in
ebollizione: si vedra' l'ebollizione cessare, e sara' necessario fornire altro calore (ad una
temperatura superiore ai 100°C) fino a raggiungere una nuova TEMPERATURA DI
SATURAZIONE corrispondente alla nuova pressione. Viceversa se diminuiamo bruscamente la
pressione sulla superficie di un liquido che e' al limite dell'ebollizione potremo vedere
l'ebollizione riprendere vigorosamente, appunto perche' avendo ridotto la pressione abbiamo
ridotto la temperatura di saturazione, cioe' la temperatura di ebollizione.
Se ora preleviamo del vapore che si produce in un recipiente chiuso in presenza del suo liquido
(cioe' VAPORE SATURO) e lo portiamo in un altro apparecchio in cui sia possibile fornirgli
altro calore, vedremo la sua temperatura salire oltre quella di saturazione, raggiungendo lo stato
di surriscaldamento. La differenza tra la nuova temperatura del vapore e quella di saturazione,
che corrisponde alla pressione alla quale si e' formato, e' detta GRADO DI
SURRISCALDAMENTO. Per limitati valori di surriscaldamento e per pressioni pari a quella
atmosferica, si puo' approssimativamente considerare il calore specifico del vapore pari a 0,45
Cal/kg°C.
Per rappresentare graficamente la produzione del vapore e' utile fare riferimento al diagramma
della temperatura - entropia. Sulle ordinate di questo diagramma sono riportate le temperature
assolute e sulle ascisse l'entropia. Per la nostra trattazione sara' sufficiente definire l'ENTROPIA
come rapporto tra le quantita' di calore fornito ad una sostanza e la temperatura assoluta la quale
il calore stesso viene fornito. Se moltiplichiamo quindi le variazioni di entropia per la
temperatura assoluta, il prodotto rappresenta Calorie ed il diagramma e' stato appunto tracciato in
modo che le aree possano reppresentare le quntita' di
calore nelle diverse trasformazioni. Ricordiamo qui che le proprieta' del vapore sono raggruppate
in forma tabellare in molti manuali tecnici.
16/01/2011
45
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
La linea A L rappresenta queela relativa allo stato liquido, la linea B C quella relativa al vapore
saturo. Se prolunghiamo le due linee fino alla loro intersezione, arriveremo al punto X detto
punto critico, oltre il quale non potremo piu' ricondurre il vapore allo stato liquido aumentandone
la pressione. Questo punto caratteristico corrisponde ad una temperatura a 375°C ed a una
pressione relativa di 224 kg/cm2.
Come esempio di applicazione del diagramma entropico consideriamo una caldaia che produce
vapore alla pressione relativa di 0,2 kg/cm2, a cui corrisponde una temperatura di saturazione di
104°C.
Se partiamo da acqua a 0°C (punto A), il liquido riscaldandosi percorrera' la linea A L , fino al
punto D che rappresenta appunto la temperatura di 104°C, corrispondente alla temperatura di
saturazione a 0,2 kg/cm2.
Fino a questo punto avremo fornito ad ogni kg di acqua una quantita' di calore equivalente
all'area compresa sotto la curva A D; questa quantita' di calore corrisponde al CALORE
SENSIBILE DEL LIQUIDO che nelle condizioni considerate corrisponde a 104 Cal/kg.
Al punto D abbiamo acqua che si trova nelle condizioni di trasformarsi in vapore se le forniamo
la necessaria quantita' di calore necessaria per la vaporizzazione. Il cambiamento di stato avviene
lungo la linea D E a temperatura costante. La trasformazione termina al punto E sulla linea di
vapore: qui 1 kg di acqua si sara' trasformato in 1 kg di vapore, e l'area sotto la linea D E
rappresentera' il CALORE LATENTE DI VAPORIZZAZIONE, cioe' il calore richiesto per
trasformare 1 kg di acqua a 104°C in 1 kg di vapore sempre a 104°C. Questo valore e' chiamato
"latente", cioe' non e' rilevabile da una lettura di temperatura, appunto perche' la sua
somministrazione non si traduce in un aumento di temperatura, ma in una trasformazione
meccanica liquido a vapore.
16/01/2011
46
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
Naturalmente se questo vapore viene fatto poi condensare, per esempio in un radiatore, esso
restituira' tutto il calore latente, che potra' per esempio servire a riscaldare l'ambiente in cui si
trova il radiatore.
Il calore latente del vapore che stiamo considerando, a 0,2 kg/cm2, e' di 536 Cal/kg, e quindi il
calore totale contenuto in 1 kg di vapore al punto E sar' 104 + 536 = 640 Cal/kg. Prolungando le
linee A L e B C del liquido e del vapore sono convergenti, e' evidente che il calore latente
diminuisce all'aumentare della temperatura o della pressione di saturazione. Si avra' anzi che al
punto critico X l'acqua si trasformera' istantaneamente in vapore senza la somministrazione di
calore di vaporizzazione. Come abbiamo visto, questa condizione corrisponde al vapore a 224
kg/cm2 relativi e a 375°C.
Se, raggiunto il punto E, continuiamo a fornire calore al vapore, esso riscaldandosi seguira'
la linea E F, che rappresenta la linea di surriscaldamento a pressione costante: la zona a destra
della linea B C e' la zona di surriscaldamento. Al punto F il calore di surriscaldamento fornito al
vapore e' rappresentato dall'area sotto la linea E F. Se per esempio il vapore e' surriscaldato fino a
120°C, il grado di surriscaldamento sara' di 120 - 104 = 16°C, ed il calore di surriscaldamento
sara' di circa 0,45 x 16 = 7,0 Cal/kg.
Al punto F il calore totale contenuto in 1 kg di vapore sara' quindi 104 + 536 + 7 = 647 Cal/kg.
Il vapore d'acqua che si trova sempre presente nell'aria atmosferica ha le stesse caratteristiche del
vapore che abbiamo sopra considerato, anche se esso si produce da acqua a temperatura inferiore
ai 100°C. Per esempio se riscladiamo dell'acqua a 20°C lungo la linea A G e poi l'evaporiamo
lungo la G K, noi avremo fornito del calore sensibile e del calore latente proprio come nel caso
del vapore a 0,2 kg/cm2. Cio' che a noi ora interessa e' questo: il punto K rappresenta le
condizioni del vapore in aria satura a 20°C. Ogni successiva somministrazione di calore
provochera' un surriscaldamento del vapore a pressione costante, per esempio sino al punto P.
Immaginiamo per un momento che il punto P corrisponda a 27 °C, che potrebbe essere la
temperatura del bulbo secco di una miscela aria-vapore acqueo (ARIA UMIDA). In questa
situazione il vapore acqueo risulterebbe surriscaldato di 7°C oltre il punto K, punto che
corrisponde alla temperatura di rugiada, cioe' alla temperatura alla quale occorrerebbe portare
l'aria per ottenerla satura di vapore acqueo senza variarne il contenuto d'umidita'.
Nella tecnica del condizionamento si ha a che fare con aria in cui il vapore acqueo e' contenuto
quasi sempre allo stato di surriscaldamento: ci troveremo quindi sempre sopra o a destra della
curva di saturazione B C, ed e' proprio in questa zona che e' stato tracciato il diagramma dell'aria
umida.
16/01/2011
47
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
ARIA UMIDA
Con questo termine si intende una miscela di aria e di vapore acqueo, com'e' praticamente l'aria
atmosferica in cui viviamo. Gia' sappiamo come in una miscela di aeriformi la pressione totale e'
la somma delle pressioni parziali dei singoli componenti, cioe' in altri termini:
Pt = Pa + Pv
la pressione atmosferica e' la somma della pressione parziale dell'aria secca (raggruppando in
questa tutti i gas che la compongono) e della pressione parziale del vapor d'acqua.
Come abbiamo visto sopra; il vapore acqueo puo' essere presente nella miscela in due condizioni:
in condizioni di saturazione quando l'aria e' satura, ed in condizioni di surriscaldamento quando
l'aria non e' satura.
Poiche' alle basse temperature il vapore acqueo si comporta approssimativamente come un gas
perfetto, potremo anche per esso scrivere la relazione Pv Vv = ARvTv in cui la costante Rv ha il
valore 848/18 = 47.
CONDIZIONI DI SATURAZIONE
I diagrammi dell'aria umida sono tutti riferiti al "kg di aria secca". La ragione di questo e' presto
spiegata: 1 kg di miscela aria-vapore puo' essere costituito da infinite combinazioni di pesi di aria
e di vapore acqueo, la cui somma equivale ad 1 kg di aria umida. Un digramma dell'aria umida
basato su 1 kg di miscela sarebbe quindi estremamente complicato, mentre riferendo tutte le
proprieta' al kg di aria secca e' sufficiente che nei casi pratici in cui puo' interessare riferire al
peso di aria umida sono il volume o il peso specifico.
Consideriamo ora 1 kg di aria secca a 20°C ed a 760 mm Hg. In queste condizioni sappiamo che
esso occupa 0,835 m3. Se ora saturiamo quest'aria con vapore d'acqua, la pressione totale
rimarra' 760 mm Hg, mentre la pressione parziale dell'aria sara' di 760 meno la pressione
esercitata dal vapore acqueo. Dalla tebella del vapore d'acqua ricaviamo che la pressione
corrispondente a 20°C e' pari a 17,5 mm Hg e che il volume specifico in tali condizioni e' di 59
m3/kg. La pressione parziale dell'aria e' quindi 760 - 17,5 = 742,5 mm Hg. Abbiamo gia'
calcolato che l'aria a 760 MM ha un volume specifico di 0,835 m3/kg, quindi a 742 mm il
volume specifico risulta:
760
-------------- x 0,835 = 0,855 m3/kg
742,5
che rappresenta quindi il volume occupato da 1 kg di aria secca piu' il vapore acqueo che lo
satura a 20°C.
16/01/2011
48
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
La quantità di vapore acqueo che satura 1 kg di aria secca alle condizioni che stiamo
considerando, e' pari a 14,5 grammi (vedi diagramma dell'aria umida). Poiche' abbiamo visto che
il volume specifico del vapore e' di 59 m3/kg, il volume occupato dal vapore che satura 1 kg di
aria secca sarà di:
59
---------- x 14,5 = 0,855
1000
Richiamiamo particolarmente l'attenzione sul fatto che il volume occupato dal vapore acqueo
presente in 1 kg di aria secca in condizioni di saturazione e' precisamente uguale al volume
occupato dal kg di aria secca alla sua pressione parziale nella miscela.
Poiche' abbiamo verificato che l'aria ed il vapore acqueo occupano lo stesso volume, potremo
usare questa proprietà per calcolare il contenuto di acqua nell'aria umida applicando le leggi dei
gas perfetti. Indicando con a e v rispettivamente aria e vapore, si ha:
Pa Pa = 29,3 Aa Ta
Pv Vv = 47 Av Tv
oppure, esprimendo la pressione in mm di Hg:
Pa Va = 2,15 Aa Ta
Pv Vv = 3,45 Av Tv
In una miscela aria-vapore possiamo, per quanto detto, scrivere:
Va = Vv
e quindi:
2,15 Aa Ta
---------------Pa
3,45 Av Tv
= -----------------------Pv
Se consideriamo 1 kg di aria e poniamo Ta = Tv
2,15 Pv
Av = ----------------------- kg di vapore /kg di aria secca
3,45 (760 - Pv)
Queta relazione puo' essere applicata per calcolare il peso di vapore contenuto nell'aria in
condizioni o no di saturazione.
16/01/2011
49
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
Per verificare la formula nel caso precedente abbiamo:
2,15 x 17,5
Av = ---------------------------- = 14,5 gr H2O/kg aria secca
3,45 (760 - 17,5)
che occupano un volume di 0,855 m3.
Il peso totale dell'aria umida e' quindi in questo esempio 1 + 0,0145 = 1,0145, ed il volume
occupato da 1 kg di aria umida (volume specifico) e' 0,855/1,0145 = 0,845 m3.
Per UMIDITA' ASSOLUTA si intende il peso in grammi di vapore acqueo contenuto in 1 kg di
aria secca. Il considerare l'umidita' riferita al kg di aria secca semplifica in effetti di molto i
calcoli, anche se introduce un errore che tuttavia per tutte le applicazioni pratiche puo' essere
tranquillamente trascurato.
Un termine molto importante per l'aria umida e' la temperatura di rugiada, definita come la
temperatura a cui occorre portare dell'aria, senza apporto o sottrazione di acqua, per ottenerla allo
stato di saturazione.
Se per esempio dell'aria e' satura a 20 °C, ogni reffreddamento al disotto di questa temperatura
provochera' la formazione di acqua.
Come risultato finale avremo dell'aria con un contenuto inferiore di vapore acqueo e con una
minore temperatura di rugiada.
Se invece quest'aria e' riscaldata oltre i 20°C in modo che le si possa aggiungere dell'acqua a
temperatura di rugiada salira'. Vogliamo sottolineare il fatto che la temperatura di rugiada e
l'aria e' in funzione del contenuto di acqua e se questo rimane costante , rimane pure costante la
temperatura di rugiada.
Calore totale di una miscela di aria e vapore acqueo si definisce la somma del calore dell'aria
secca (misurata sopra una determinata temperatura di riferimento) piu' il calore sensibile
dell'acqua da cui si e' formato il vapore, piu' il calore latente di vaporizzazione. Come
temperatura di riferimento si assume lo 0°C.
Nell'epressione calore totale abbiamo nominato il calore sensibile ed il calore latente, che ci
devono essere completamente familiari. Quando forniamo calore ad una sostanza ne aumentiamo
la temperatura ed il calore fornito viene chiamato calore sensibile poiche' deve essere "sentito" e
rilevato da un termometro. Del calore tuttavia puo' essere ceduto ad una sostanza senza che di
essa ne varii la temperatura: si ha in questo caso una trasformazione di stato, per esempio da
solido a liquido, o da liquido, o da liquido a vapore, ed il calore aggiunto e' chiamato calore
latente.
Per esempio quando del ghiaccio si fonde in acqua, il calore assorbito durante la trasformazione
(che alla pressione atmosferica avviene a 0°C) e' il "calore latente di fusione".
Quando dell'acqua si trasforma in vapore, il calore richiesto per la trasformazione e' il "calore
latente di vaporizzazione". Alla pressione atmosferica l'acqua si trasforma in vapore a 100°C e la
quantita' di calore richiesta per vaporizzare 1 kg di acqua e' pari a circa 540 Cal/kg. Abbiamo nel
16/01/2011
50
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
diagramma che il calore latente di vaporizzazione diminuisce con l'aumentare della pressione di
evaporazione, e si riduce a 0 a 375°C.
La definizione precedente conduce alla seguente equazione che da' il calore totale J di una
miscela satura aria-vapore:
J = 0,24 (T - O) + [ Av x 1 x (T - O)] + AvL in cui:
0,24 = calore specifico medio dell'aria secca (Cal/kg/°C)
T = temperatura dell'aria satura (°C)
Av = peso del vapore d'acqua contenuto nell'aria satura alla
temperatura T (kg)
L = calore latente di vaporizzazione alla temperatura T (Cal/kg)
Per esempio l'aria satura a 20°C ha un contenuto di calore:
J = 0,24 (20) + 0,0145 (20) + 0,0145 x 584 =
(cal. sensib) (cal. sensib.) (cal.latente)
= 4,8 + 0,3 + 8,5 = 13,6 Cal/kg di aria secca
CONDIZIONI DI NON SATURAZIONE
Fino a questo punto abbiamo sempre trattato miscele aria-vapore sature: tuttavia i casi piu'
frequenti che si incontrano riguardano aria non in stato di saturazione (cioe' con vapore in stato di
surriscaldamento). Abbiamo precedentemente definito umidita' assoluta il peso in grammi
dell'acqua contenuta in 1 kg di aria secca: definiamo ora come UMIDITA' RELATIVA il
rapporto percentuale tra il peso dell'acqua contenuta in 1 kg di aria in condizioni di non
saturazione ed il peso dell'acqua che puo' essere contenuto nello stesso kg di aria in condizioni di
saturazione alla stessa temperatura. Possiamo quindi affermare che l'umidita' relativa di aria
satura e' del 100%.
Sia data dell'aria a 26°C con umidita' relativa del 50%.
Se quest'aria fosse satura a 26°C conterebbe 21 gr. di vapore dell'acqua per kg di aria
secca.
Poiche' siamo al 50% di umidita', ogni kg di aria secca conterra' 21 x 0,5 = 10,5 gr
H2O. In queste condizioni la temperatura di rugiada e' di 15°C.
Ricordiamo ancora che la temperatura di rugiada rappresenta la minima temperatura alla quale
l'aria puo' essere raffreddata senza modificare il suo contenuto iniziale di vapor acqueo.
16/01/2011
51
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
Il calore totale di aria umida non satura deve comprendere, oltre i termini gia' visti, il calore di
surriscaldamento del vapore: e' importante sottolineare che il calore latente di vaporizzazione
deve essere valutato in corrispondenza alla temperatura di rugiada.
Vediamo per esempio il contenuto di calore nel kg di aria secca del caso precedente. Poiche' la
sua temperatura di rugiada e' di 15°C e il contenuto di acqua di 10,5 gr, si ha:
J = 0,24 x 26 + 0,0105 x 1 x 15 + 0,0105 x 587 + 0,45 x 0,0105 (26 - 15) = 12,6 Cal/kg
Il calore totale che abbiamo indicato con la lettera J e' spesso chiamato "Entalpia" e con tale
nome si puo' trovare su molti diagrammi e tabelle.
Una interessante proprieta' dell'aria umida che riguarda il suo calore totale e' messa in rilievo
dalla " temperatura del bulbo umido", che vorremmo illustrare con un esempio.
Immaginiamo di inviare dell'aria inizialmente a 26°C con il 50% di umidita' relativa, a contatto
con degli spruzzatori di acqua. Supponiamo inoltre che il condotto ove avviene il trattamento sia
perfettamente isolato termicamente dall'ambiente e che l'aria a contatto con l'acqua si saturi
completamente, cosa quest'ultima senz'altro possibile se la zona di trattamento e'
sufficientemente estesa.
L'aria giunge a saturazione evaporandosi in essa dell'acqua; ma il calore latente necessario per
evaporare quest'acqua non puo' essere fornito dall'esterno avendo presupposto il perfetto
isolamento termico.
L'unica sorgente di calore disponibile e' l'aria presente con il suo calore sensibile: quest'aria
quindi si raffreddera' saturandosi al 100% mantenendo costante il suo calore totale, cioe' dando
una parte del suo calore sensibile per evaporare una quantita' di acqua che richieda una quantita'
equivalente di calore latente. La temperatura che l'aria raggiungera' in questa trasformazione e'
detta temperatura di saturazione o del bulbo umido.
Esso si definisce come la temperatura che raggiunge l'aria saturandosi a J costante.
Nel nostro caso l'aria uscira' dal condotto contenente gli spruzzatori d'acqua satura ed alla
temperatura di 18,7°C. Poiche' siamo in condizioni di saturazione, questa temperatura
rappresentera' anche la temperatura del bulbo secco e la temperatura di rugiada dell'aria trattata.
Alle nuove condizioni vediamo che, mentre inizialmente l'aria conteneva 10,5 gr H2O/kg, ne
abbiamo 13,5, cioe' durante il passaggio attraverso i polverizzatori ogni kg di aria secca avra'
assorbito 13,5 - 10,5 = 3 grammi di acqua. Poiche' l'evaporazione avviene a 18,7°C e questa
temperatura il calore latente e' di 585 Cal/kg, la trasformazione dell'acqua in vapore chiedera':
0,003 x 585 = 1,75 Cal
Poiche' l'unica sorgente di calore per ottenere queste calorie e' il calore contenuto nell'aria stessa,
la temperatura del bulbo secco diminuira' fino a ottenere proprio le 1,75 Cal necessarie.
Vediamo se il bilancio e' soddisfatto. Il calore disponibile e' costituito dal calore sensibile
dall'aria secca e dal calore di surriscaldamento del vapore acqueo presente:
16/01/2011
52
Per. Ind. Marco Masi
CORSO CONDUTTORI IMPIANTI TERMICI
Nozioni di Fisica e Termodinamica
0,24 x (26 - 18,7) - 0,45 x 0,0105 x (26 - 18,5) = 1,75 Cal/kg aria secca.
Un'applicazione interessante della temperatura del bulbo umido e' per il calcolo della pressione
parziale del vapore d'acqua in aria non satura, nota la temperatura del bulbo secco, secondo
l'equazione di Carrier:
(Pa - Ps) (ts - tu)
Pv = Ps - -----------------------1540 - 1,3 x tu
Pv
Ps
Pa
ts
tu
in cui:
= pressione del vapore acqueo in condizioni di non saturazione
= pressione del vapore saturo alla temperatura del bulbo umido
= pressione atmosferica
= temperatura bulbo secco
= temperatura bulbo umido
Esempio: Determinare la pressione parziale del vapore contenuto in aria a 760
mm Hg avente una temperatura di 24°C al bulbo secco e di 17°C al bulbo umido.
La pressione del vapore saturo a 17°C e' di 14 mm Hg
Si ha quindi:
(760 - 14) (24 - 17)
P = 14 - ---------------------------------- = 10,5 mm Hg
1540 - 1,3 x 17
La temperatura del bulbo umido ha una grande importanza nei calcoli per il condizionamento
dell'aria: la sua misura puo' essere effettuata con un normale termometro il cui bulbo e' rivestito
da una garza che puo' essere facilmente imbevuta di acqua. Per effettuare la misura occorrera'
agitare l'aria intorno al bulbo, ad una velocita' non inferiore ai 2,5 m/sec per ridurre al minimo gli
errori di osservazione.
16/01/2011
53