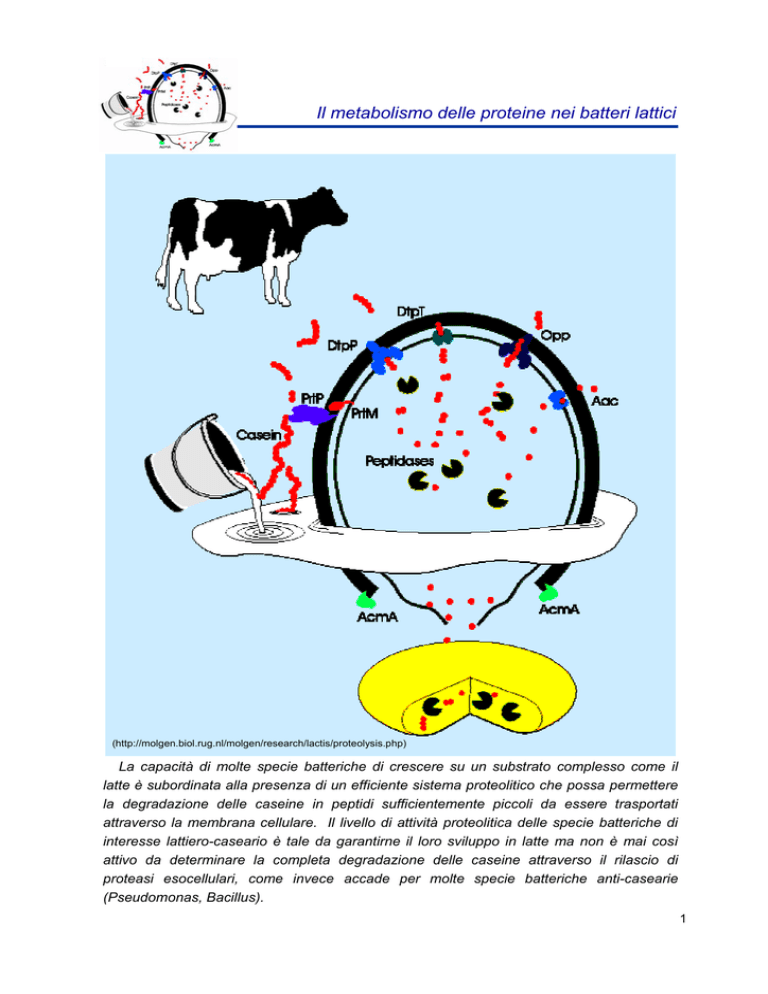
Il metabolismo delle proteine nei batteri lattici
(http://molgen.biol.rug.nl/molgen/research/lactis/proteolysis.php)
La capacità di molte specie batteriche di crescere su un substrato complesso come il
latte è subordinata alla presenza di un efficiente sistema proteolitico che possa permettere
la degradazione delle caseine in peptidi sufficientemente piccoli da essere trasportati
attraverso la membrana cellulare. Il livello di attività proteolitica delle specie batteriche di
interesse lattiero-caseario è tale da garantirne il loro sviluppo in latte ma non è mai così
attivo da determinare la completa degradazione delle caseine attraverso il rilascio di
proteasi esocellulari, come invece accade per molte specie batteriche anti-casearie
(Pseudomonas, Bacillus).
1
CEP
Il processo di proteolisi esercitato dai batteri lattici si può suddividere in diverse fasi
temporali. Nella prima fase, le proteinasi di parete (Cell Envelope Proteinase, CEP),
intervengono attaccando le caseine e generando piccoli peptidi o (nel caso di processi
caseari) idrolizzando i peptidi originati dall’azione delle chimosine del caglio. In una
seconda fase, i piccoli peptidi generati dall’azione delle CEP vengono trasportati
all’interno della cellula da opportune proteine di trasporto (Oligopeptide permease system,
Opp) dove potranno essere ulteriormente idrolizzati ad amminoacidi necessari per la
crescita cellulare. In questa terza fase interviene una categoria piuttosto complessa di
peptidasi costituita da endo-, ammino- e carbossi-peptidasi. Nella produzione di formaggi,
questa categoria di enzimi svolgerà una importante funzione anche dopo la morte della
cellula durante quella fase di processo denominata di “maturazione”.
Caratteristiche delle CEP
Le proteasi di parete caratterizzate a livello genetico e/o biochimico sono quelle di
Lactococcus lactis, Lactobacillus delbrueckii subsp. bulgaricus, Lactobacillus casei,
Lactobacillus helveticus e Streptococcus thermophilus.
PrtP (type I)
PrtP (type III)
Lactococcus lactis
PrtB
Lactobacillus delbrueckii subsp. bulgaricus
PrtP
Lactobacillus casei
PrtH
Lactobacillus helveticus
PrtS
Streptococcus thermophilus
Le CEP sopra elencate mostrano una diversa specificità di taglio nei confronti delle
caseine. Di seguito sono rappresentati diversi profili HPLC in fase inversa delle miscele di
peptidi ottenuti incubando tre diverse CEP di L. lactis con un idrolizzato chimosinico di
caseina (αs +β).
2
Specificità di taglio di alcune CEP nei confronti della frammento caseinico αs1 (1-23)
PrtH
PrtP (type III)
PrtP (type I)
1
5
8
9
10
13
14
16
17 18
20
21
22 23
R P K H P I K H Q G L P Q E V L N E N L L R F
PrtS
= Elevata frazione relativa di taglio
= Media frazione relativa di taglio
= Bassa frazione relativa di taglio
Organizzazione genica di prtS di Streptococcus thermophilus
SS
PP
PR
A
H
W
AN
4775 bp
1585 aa
La proteina codificata da prtS è costituita da 7 diversi domini funzionali. SS
rappresenta la sequenza segnale, PP il propeptide, PR il dominio catalitico, A il
dominio globulare, B il dominio stabilizzante, H il dominio ad elica, W il dominio di
parete e AN il dominio di ancoraggio alla parete caratterizzato dal motivo LPXTG.
Grazie a questo motivo, presente nelle CEP di altre specie e estremamente
conservato nelle proteine batteriche ancorate alla parete, la PrtS di S. thermophilus è
molto probabilmente legata in modo covalente al tetrapeptide di cross-bridge del
peptidoglicano. Questo legame, che dovrebbe essere catalizzato da una sortase,
avviene tra il residuo di treonina (T) delle CEP e il tetrapeptide del peptidoglicano.
3
Rappresentazione grafica della biosintesi delle CEP
N
N-
proteina matura
prtS
attiva
ancorata
alla parete
-C
membrana
parete
OUT
C
IN
C-
PrtM
C-
PrtM (lipoproteina
chaperone
responsabile del
processamento
delle Prt - presente in
Lb. casei e
Lc. lactis). Nessun
gene prtM-like in Lb.
helveticus e in S.
thermophilus.
Pre-prtS
-N
mRNA prtS
prtS
La caratterizzazione biochimica delle CEP dei batteri lattici ha evidenziato che questi
enzimi appartengono alla classe delle serin-proteasi attivate da ioni Ca2+ e generalmente
hanno degli optimun di attività a 30-37 °C a pH 7-7.5 anche se rimangono attive a
temperature più basse e a pH acidi (5-5.5).
4
La CEP matura di Lactococcus lactis (PrtP-III) è costituita da una estremità N-terminale
con caratteristiche analoghe alla classe enzimatica delle subtilisine e da una porzione Cterminale la cui funzione non è nota ma che nella regione distale ancora la proteina alla
parete cellulare. La rimozione di ioni Ca dalla forma nativa della proteina provoca una
forte diminuzione dell’attività specifica e una altrettanto marcata, ma reversibile, riduzione
della stabilità termica dell’enzima (nessuna attività a 25 °C, pH 6.5).
Exterkate and Alting. 1999. Appl. Environ. Microbiol., 65: 1390-1396
In questa rappresentazione grafica è riportata la regione della PrtP coinvolta nel legame
con il substrato e sono indicati i residui amminoacidici coinvolti nel legame con il Ca. I
residui catalitici sono indicati in grigio.
5
Le CEP di molti batteri lattici vengono rilasciate dalla parete attraverso una semplice
incubazione delle cellule in un tampone privo di ioni Ca2+ che induce il rilascio degli ioni
covalenti dai siti della struttura proteica suscettibili all’autoproteolisi. I siti di autoproteolisi
e di legame agli ioni Ca2+ sono localizzati nel dominio B presente in diverse CEP (PrtP)
ma non nella PrtS di S. thermophilus. Per questa ragione PrtS è difficilmente separabile
dalla parete batterica anche utilizzando detergenti molto energici. Per quanto riguarda le
CEP in cui il dominio B è presente, è stato recentemente osservato un cambio nella
specificità di taglio sulla b-caseina tra la PrtP(III) di Lactococcus lactis e la sua forma
rilasciata dalla cellula inseguito all’attività autoproteolitica.
PrtP
lavaggio delle cellule
in un tampone privo
di ioni Ca
Ca
Ca
Ca
Ca
Ca2+
AUTOPROTEOLISI
∆PrtP
Ca
Ca
Ca2+
liberazione
nel mezzo di PrtP
modificata e ancora
attiva
6
Crescita diauxica di Streptococcus thermophilus in latte
(Letort et al., 2002. Appl. Environ. Microbiol. 68: 3162-3165)
I ceppi di S. thermophilus che possiedono la CEP PrtS, mostrano in latte una chiara
crescita diauxica che scompare se il latte viene implementato di amminoacidi. Questo
fenomeno, che determina un rallentamento della crescita di S. thermophilus, è dovuto al
fatto che amminoacidi essenziali quali Glu e Met sono presenti in latte in concentrazioni
decisamente inferiori (Glu 45 mg/l, Met 1 mg/l) a quelle richieste da questa specie per
crescere correttamente (Glu 200 mg/l, Met 60 mg/l). Di conseguenza, S. thermophilus deve
trovare altre fonti amminoacidiche per poter raggiungere alte concentrazioni cellulari in latte.
7
espressione
di prtS
Per controllare i livelli di
espressione del gene
prtS, il promotore di
questo gene è stato fuso
con due geni lux
(luciferasi). I livelli di
fluorescenza emessa
erano così proporzionali
ai livelli di mRNA prtS
prodotti.
Si è potuto quindi
verificare come la
biosintesi della CEP
PrtS fosse stimolata al
termine della prima fase
esponenziale dalla
carenza di amminoacidi
liberi. L’azione di PrtS
sulle caseine generava
nuovi peptidi, che
idrolizzati da peptidasi
endocellulari, rifornivano
di amminoacidi
essenziali la cellule che
di conseguenza
riattivavano la fase
esponenziale di crescita.
8
La crescita diauxica di S. thermophilus si riflette in un rallentamento della velocità di
acidificazione in latte.
(Courtin et al., 2002. Microbiology, 148, 3413-3421.)
La crescita diauxica di S. thermophilus rimane evidente anche in co-colture si S.
thermophilus e L. delbrueckii subsp. bulgaricus, come ad esempio avviene nella preparazione
dello yogurt. In questa associazione batterica la crescita diauxica di S. thermophilus non
influenza la velocità di acidificazione del prodotto a condizione che sia presente PrtB di L.
delbrueckii subsp. bulgaricus. In questo caso specifico, per garantire il raggiungimento di un
adeguato pH finale (4.8-4.9) e di una buona biomassa (108-109 ufc/ml) risulta essere di
fondamentale importanza la presenza di PrtB di L. delbrueckii subsp. bulgaricus mentre è
ininfluente la presenza di PrtS.
9
Le peptidasi
(Christensen et al., 1999. Antonie van Leeuwenhoek, 76: 217-246)
La conversione dei peptidi a singoli amminoacidi e la loro successiva utilizzazione
rappresentano la parte centrale delle attività metaboliche dei procarioti. Sino ad oggi, sono
state caratterizzate (biochimica e genetica) circa 20 peptidasi di diverse specie batteri lattici. I
sistemi peptidasici caratterizzati in maggior dettaglio sono quelli delle specie Lactobacillus
helveticus e Lactococcus lactis. I batteri lattici associati all’ambiente lattiero-caseario sono
generalmente auxotrofi per un numero variabile da 6 a 14 amminoacidi. Di conseguenza, la
capacità di crescere in latte di molte specie di batteri lattici è subordinata all’efficienza del loro
sistema proteolitico. Le peptidasi rappresentano una classe di enzimi che comprende
cysteino-peptidasi, metallo-peptidasi e serin-peptidasi; si tratta di enzimi che hanno
strutture quaternarie da monomeriche a ottameriche.
Il sistema di classificazione più
utilizzato per questi enzimi è quello che si basa sulla specificità di taglio nei confronti di
substrati peptidici sintetici.
10
amminopeptidasi A
(PepA) Idrolisi dall’amminoacido N-terminale.
Glu, Asp. Lc. lactis, S. thermophilus.
Attive sugli aa
X-prolyl dipeptidyl amminopeptidasi
(PepX) liberano Xaa-Pro dipeptidi dall’Nterminale di peptidi. Lb. acidophilus, Lb.
delbrueckii, Lb. casei, Lb. helveticus, Lc. lactis,
S. thermophilus.
dipeptidasi (PepD)
Idrolisi di dipeptidi ad esclusione di Val-Xaa, Ile-Xaa. L.
helveticus.
dipeptidasi (PepV)
simile a PepD. Non idrolizza peptidi contenenti Gly all’Nterminale. Lb casei, Lb delbrueckii, Lb helveticus, Lb sake, Lb
sanfrancisciensis, Lc lactis.
prolina imminopeptidasi (PepI) Idrolizza peptidi contenenti Pro all’N-terminale. Lb
delbrueckii, Lb helveticus.
prolidase (PepQ)
Idrolizza dipeptidi Xaa-Pro e mostra attività anche nei confronti di
altri dipeptidi. Lb delbrueckii, Lb helveticus.
prolinase (PepR)
Idrolizza specificatamente dipeptidi Pro-Xaa. Lb helveticus, Lb
rhamnosus.
peptidasi (PepL)
Idrolizza dipeptidi e tripeptidi con Leu, Ala e Pro in posizine Nterminale. Lb delbrueckii.
peptidasi (PepP)
Idrolizza Xaa-Pro-Pro- (Yaa)n. Lc lactis.
tripeptidasi (PepT)
Idrolizza tripeptidi con un ampio range di amminoacidi. Lb
delbrueckii, Lb sake, Lc lactis, P pentosaceus.
endopeptidasi (pepE)
Lb delbrueckii, Lb helveicus.
PepG
simile a PepC, Lb delbrueckii, Lb helveicus.
endopeptidasi (PepO)
La sua attività aumenta per substrati del tipo YGGF(X)n con n da
1 a 13. Lc lactis, Lb helveticus, S thermophilus.
endopeptidasi (PepF)
Idrolizza oligopeptidi costituiti da 6 a 16 amminoacidi. Lc lactis.
11
Peptidi bioattivi del latte (Meisel and Bockelman, 1999.
Antonie van Leeuwenhoek, 76: 207-215)
Le proteine del latte contengono sequenze amminoacidiche di peptidi con caratteristiche
bioattive. La formazione di questi peptidi è però conseguente al verificarsi di una adeguata
azione proteolitica come quella che si può potenzialmente verificare in seguito ad un
intervento microbico.
= CEP
= OPP
= peptidasi
= caseine/peptidi
= peptide BIOATIVO
12
I peptidi bioattivi sono potenziali modulatori diretti o indiretti di processi metabolici dei
mammiferi e quindi dell’uomo (hormone-like activity).
OPPIOIDI
INIBITORI DELL’ACE
IMMUNOMODULANTI
ANTIMICROBICI
ANTICOAGULANTI
CARRIERS DI MINERALI
Anche se peptidi biologicamente attivi possono essere ottenuti da altre proteine animali e
vegetali le proteine del latte rappresentano la fonte maggiore di biopeptidi.
13
Si tratta di opioidi peptidici atipici che differiscono dagli oppioidi
endogeni (encefaline, endorfine e dynorfine) nella regione Nterminale.
Sono peptidi che hanno azione inibitoria nei confronti
dell’enzima ACE (angiotensin-I-converting enzyme).
ACE è un enzima multifunzionale che ha un ruolo
chiave nel regolare i livelli locali di diversi peptidi
bioattivi. Il ruolo fisiologico dell’ACE è quello di
rilasciare per azione proteolitica l’angiotensina II, uno
dei più potenti agenti vasocostrittore.
INIBITORI DELL’ACE
angiotensinogeno
angiotensina I
ACE
-
renina
angiotensina II
(ERVYIHPF)
(YLLF) β
(YGLF) α
(YQQPVLGPVR)
β
ACE-inhibinotory
(YPFPGPI) β
OPPIOIDI
14
Si tratta di peptidici derivati dalla degradazione della caseina
che hanno un’azione stimolante nei confronti dei macrofagi e
mostrano effetti protettivi nei confronti di infezioni batteriche
(Klebsiella
pneumonie.
Possono
avere
azione
immunostimolante anche gli innibitori dell’ACE e gli opioidi.
IMMUNOMODULANTI
CARRIERS DI MINERALI
ANTICOAGULANTI
Molti fosfopeptidi possono formare sali con differenti
minerali ma soprattutto con il calcio. Il 30 % del fosforo del
latte è legato a residui di Ser della caseina.
I peptidi che derivano dalla porzione C-terminale della kcaseina sono inibitori dell’aggregazione delle piastrine e del
legame tra piastrine e fibrinogeno. La sequenza di questi
peptidi è caratterizzata dalla presenza di alcuni residui
amminoacidici (Ile-108, Lys-112, Asp-115) analoga a quella
presente nella sequenza della catena γ del fibrinogeno. Si
pensa quindi che questi peptidi svolgano la loro azione
anticoagulante competendo con il fibrinogeno per il legame
alle piastrine.
ANTIMICROBICI
Si tratta di peptidi derivati dalla degradazione della
lattoferrina, una glicoproteina legante il ferro ad attività
antibatterica. Il frammento N-terminale di questa proteina,
originato dall’azione idrolitica della pepsina, è caratterizzato
dalla presenza di un ponte disolfuro intramolecolare e
mostra una forte attività antibatterica. La modalità di azione
battericida e la natura peptidica di queste molecole è molto
simile a quella delle più note batteriocine batteriche.
15