LICEO G. M. COLOMBINI
MATERIA: SCIENZE NATURALI
CLASSI: TERZE LICEO SCIENZE APPLICATE
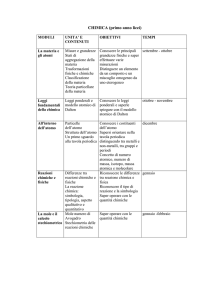
COMPETENZE
CONTENUTI
TIPOLOGIA DELLA PROVA
PER LA DETERMINAZIONE DEL
VOTO UNICO QUADRIMESTRALE
BIOLOGIA
– Illustrare e confrontare le
diverse
modalità
di
attraversamento
della
membrana plasmatica da parte
delle sostanze necessarie al
metabolismo cellulare
BIOLOGIA
1. Le trasformazioni energetiche
nelle cellule
– Le reazioni endoergoniche ed
esoergoniche che avvengono
nelle cellule
– La funzione degli enzimi
– Le modalità con cui la cellula
effettua il trasporto delle
sostanze in entrata e in uscita
– Descrivere il processo della
respirazione cellulare come
processo esoergonico
2. Respirazione cellulare
– La funzione della respirazione
cellulare
– Descrivere il processo di
fotosintesi clorofilliana come
processo endoergonico
3. Fotosintesi
– Il processo di fotosintesi
– Confrontare la struttura e la
funzione di DNA e RNA
– Descrivere i processi di
duplicazione, trascrizione e
sintesi proteica
– Identificare il ruolo delle
proteine nelle cellule e negli
organismi
– Descrivere i cromosomi e
indicarne il ruolo biologico
4. Le basi chimiche
dell'ereditarietà
– Il DNA e RNA: strutture e
funzioni
– Il processo di duplicazione del
DNA
– Il processo di trascrizione e le
funzioni dell’RNA
– Il codice genetico
– La sintesi proteica
– Utilizzare l’equazione di HardyWeinberg in semplici
applicazioni
– Confrontare i diversi tipi di
selezione
– Confrontare i meccanismi di
microevoluzione e
macroevoluzione
– Confrontare i diversi modelli
evolutivi
– Ricostruire le principali linee
evolutive del genere Homo
5. L'evoluzione
– La variabilità e sue dinamiche
– L’equilibrio di Hardy-Weinberg e
fattori che lo modificano
– La selezione naturale, tipi di
selezione
– L’adattamento
– Microevoluzione e
macroevoluzione, origine della
specie, modelli evolutivi
– L’evoluzione degli ominidi
Per la valutazione scritta verranno
svolte un minimo di due prove
per
quadrimestre
con
esercizi/problemi
applicativi,
relazioni di laboratorio, domande
aperte secondo le tipologie di
seconda e terza prova d’esame.
Per la valutazione orale sono
previste due verifiche di cui
almeno una in forma di colloquio,
eventualmente
affiancata
da
prove di tipo strutturato o semi
strutturato (es. test di ammissione
alle facoltà universitarie).
Il
punteggio
assegnato,
diversificato per tipo di esercizio,
terrà conto della diversità del
livello di richiesta.
Gli indicatori della valutazione
considereranno
l’acquisizione
delle conoscenze e le relative
capacità applicative.
Dal punto di vista quantitativo, a
ogni risposta verrà assegnato un
punteggio e la sufficienza verrà
attribuita al conseguimento del
55% del punteggio totale.
Per la valutazione sarà utilizzata
la scala da 1 a 10.
CHIMICA
CHIMICA
– Spiegare le proprietà delle tre
particelle che compongono
l’atomo
– Identificare gli elementi della
tavola periodica mediante il
numero atomico e stabilire la
massa atomica degli isotopi
componenti
1. Le particelle dell’atomo e i
modelli atomici
Le particelle subatomiche
(richiami)
L’identità chimica di un atomo
Il modello atomico di Bohr
Il modello quanto-meccanico
dell’atomo
– Descrivere la natura
ondulatoria e corpuscolare
della luce
– Rappresentare la
configurazione elettronica di un
elemento
2. La struttura dell’atomo
Le configurazioni elettroniche
– Spiegare la relazione fra
struttura elettronica e posizione
degli elementi sulla tavola
periodica
– Descrivere le principali
proprietà periodiche che
confermano la struttura a strati
dell’atomo
– Descrivere le principali
proprietà di metalli, semimetalli
e non metalli
– Descrivere le proprietà
osservabili dei materiali sulla
base della loro struttura
microscopica
– Comparare i diversi legami
chimici
– Stabilire la polarità dei legami
covalenti e delle molecole sulla
base delle differenze di
elettronegatività degli elementi
e della geometria delle
molecole
– Classificare i composti
secondo la natura ionica,
molecolare, binaria, ternaria
– Assegnare il numero di
ossidazione.
– Usare le regole della
nomenclatura IUPAC o
tradizionale per scrivere le
formule
– Conoscere le reazioni generali
di preparazione dei più
importanti composti inorganici
– Bilanciare una reazione
chimica
– Effettuare calcoli stechiometrici
– Leggere un’equazione chimica
bilanciata sia sotto l’aspetto
macroscopico che sotto
l’aspetto microscopico
3. Il sistema periodico
La scoperta della legge
periodica
Periodicità di alcune proprietà
chimiche e fisiche degli
elementi
Metalli, semimetalli, non metalli
4. I legami chimici
Origine e natura del legame
chimico
La regola dell’ottetto
La notazione di Lewis
Legame covalente
Legame ionico
Legame metallico
La teoria del legame di valenza
Interazioni tra molecole
5. Classificazione e nomenclatura
dei composti
Numero di ossidazione
Classificazione dei composti
inorganici
Nomenclatura tradizionale e
IUPAC
Reazioni di preparazione dei
principali composti inorganici
6. Le reazioni chimiche e la
stechiometria
Le reazioni e le equazioni
chimiche
Classificazione delle reazioni
chimiche
Calcoli stechiometrici con le
– Riconoscere il reagente in
eccesso e il reagente limitante,
rispetto alle quantità
stechiometriche
– Provare la solubilità di una
sostanza in acqua o in altri
solventi
– Preparare soluzioni di data
concentrazione (percentuale in
peso e in volume, ppm,
molarità, molalità)
– Spiegare la solubilità mediante
il modello cinetico-molecolare
della materia
SCIENZE DELLA TERRA
equazioni chimiche
7. Le proprietà delle soluzioni
Solubilità e temperatura
Concentrazioni di una soluzione
SCIENZE DELLA TERRA
– Distinguere le rocce
magmatiche, le sedimentarie e
le metamorfiche
– Distinguere una roccia
magmatica intrusiva da una
effusiva
– Classificare una roccia
sedimentaria clastica in base
alle dimensioni dei frammenti
che la costituiscono
– Risalire all’ambiente di
sedimentazione di una roccia
sedimentaria clastica
– Stabilire se una roccia
metamorfica è scistosa o meno
1. I materiali della Terra solida
– Le caratteristiche e le proprietà
dei minerali
– I principali gruppi di minerali
– I tre gruppi principali di rocce
– Il ciclo litogenetico
– Formazione delle rocce
magmatiche
– Formazione delle rocce
sedimentarie
– Formazione delle rocce
metamorfiche
– I principi della stratigrafia
– Distinguere un vulcano centrale
da uno lineare
– Riconoscere un vulcano a
scudo, un vulcano-strato, un
cono di scorie
– Leggere la carta che riporta la
distribuzione dei vulcani attivi
sulla superficie terrestre
2. I fenomeni vulcanici
– Che cosa sono i vulcani
– Quali sono i prodotti dell’attività
vulcanica
– Che forme hanno i vulcani
– I diversi tipi di eruzioni
vulcaniche
– La distribuzione dei vulcani sulla
superficie terrestre
– Interpretare la carta della
distribuzione dei terremoti
– Conoscere i comportamenti
adeguati in caso di terremoto
3. I fenomeni sismici
– Il meccanismo all’origine dei
terremoti
– I tipi di onde sismiche e il
sismografo
– Come vengono utilizzate le
onde sismiche nello studio
dell’interno della Terra
– La scala MCS
– La scala Richter
– La distribuzione degli ipocentri
dei terremoti sulla Terra
– La prevenzione antisimica