11. IL CALORE
11. IL CALORE
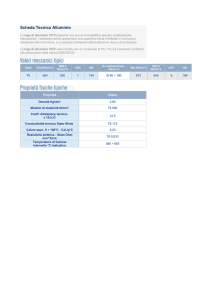
11.1 – La legge fondamentale della termologia
Il metodo più comune per aumentare la temperatura di un corpo è quello di scaldarlo
ponendolo a contatto con un corpo che abbia una temperatura maggiore. In queste
condizioni dal corpo a temperatura maggiore al corpo a temperatura minore si
trasferisce un qualcosa, che chiamiamo calore,.
Dopo un certo intervallo di tempo, i due corpi raggiungono la stessa temperatura
(temperatura di equilibrio) e si trovano in una situazione chiamata equilibrio termico.
Fra due corpi in equilibrio termico non c’è passaggio di calore.
Il calore non è altro che energia termica che si trasferisce da un corpo all’altro.
L’energia termica è una forma di energia che dipende dall’incessante movimento di
tutte le particelle che costituiscono il corpo (descrizione microscopica).
Nel Sistema Internazionale il calore si misura in Joule (J). Un’altra unità di misura del
calore è la caloria (cal). Vale la seguente uguaglianza: 1cal =4,18 J.
La relazione che lega il calore assorbito da (ceduto da) un corpo, all’aumento
(diminuzione) della sua temperatura, è espressa dalla legge fondamentale della
termologia:
Q = m ⋅ c ⋅ ∆T
dove Q è il calore (in J), m è la massa (in kg), ∆T è la variazione di temperatura (in
°C o in K, ed è la differenza tra la temperatura finale e la temperatura iniziale), c è il
calore specifico (in
J
).
kg ⋅ °C
Il calore specifico è la quantità di calore che un chilogrammo di materiale assorbe (o,
viceversa, cede) quando la sua temperatura aumenta (o, viceversa, diminuisce) di
1°C (o 1K).
Il calore specifico non dipende dal corpo ma dalla sostanza con cui il corpo è fatto (è
una grandezza intensive come l’intensità).
Il calore specifico dell’acqua, per esempio, è 4180
J
(che corrisponde a 1
kg ⋅ °C
cal
), ossia occorrono 4180 J per aumentare di 1°C la temperatura di 1 kg di acqua
g ⋅ °C
67
11. IL CALORE
(in modo equivalente, significa che serve 1 cal per aumentare di 1°C la temperatura
di 1 g di acqua).
Il calore è positivo se è assorbito dal corpo (produce un aumento di temperatura e
∆T>0), è negativo se è ceduto dal corpo (produce una diminuzione di temperatura e
∆T<0)
ESEMPIO
Una sbarra di ferro di massa 1,5 kg (calore specifico del ferro 450
J
) viene
kg ⋅ °C
riscaldata dalla temperatura di 17 °C fino alla temperatura di 50°C. Qual è la quantità
di calore trasferita?
DATI
m=1,5 kg
c= 450
J
kg ⋅ °C
Tiniziale= 17 °C
Tfinale= 50°C
Q=?
SOLUZIONE
Q = m ⋅ c ⋅ ∆T = m ⋅ c ⋅ (T finale − Tiniziale ) = 1,5 ⋅ 450 ⋅ (50 − 13) = 24975 J
Definiamo, infine, la grandezza fisica capacità termica di un corpo, uguale al prodotto
tra la massa (m) del corpo e il calore specifico della sostanza con cui il corpo è fatto
(c).
C = c⋅m
L’unità di misura della capacità termica è il
J
J
(o
).
K
°C
11.2 L’equilibrio termico
La legge fondamentale della termologia permette di ricavare la temperatura di
equilibro di due corpi messi a contatto.
68
11. IL CALORE
Consideriamo ora una sostanza fredda di massa m1, temperatura T1 e calore
specifico c1 e una sostanza calda di massa m2, temperatura T2 e calore specifico c2.
Messe a contatto, le due sostanze raggiungono la temperatura di equilibrio Te. La
temperatura di equilibrio è maggiore di T1 e minore di T2 (T1<Te>T2).
La sostanza calda cede calore e si raffredda:
Qceduto = m2 ⋅ c2 ⋅ (Te − T2 ) < 0
La sostanza fredda acquista calore e si riscalda:
Qacquistato = m1 ⋅ c1 ⋅ (Te − T1 ) > 0
La quantità di calore che la sostanza cede è interamente assorbita dalla sostanza
fredda, per cui:
m1 ⋅ c1 ⋅ (Te − T1 ) + m2 ⋅ c2 ⋅ (Te − T2 ) = 0
Qacquistato + Qceduto = 0
Questa è l’equazione dell’equilibrio termico. Essa permette di calcolare la
temperatura di equilibrio Te, note le altre quantità presenti:
Te =
(m1 ⋅ c1 ⋅ T1 + m2 ⋅ c2 ⋅ T2 )
m1 ⋅ c1 + m2 ⋅ c2
Se le sostanze sono identiche, c1 è uguale a c2 e l’equazione si semplifica:
Te =
(m1 ⋅ T1 + m 2 ⋅ T2 )
m11 + m 2
ESEMPIO
Mescolando 1 kg di acqua a 20°C con 3 kg di acqua a 60°C, si ottiene dell’acqua che
ha una temperatura di equilibrio di 50°C. Infatti:
Te =
(m1 ⋅ T1 + m 2 ⋅ T2 )
m11 + m 2
=
1 ⋅ 20 + 3 ⋅ 60
= 50°C
1+ 3
11.3 – Esercizi proposti
1) Un cubo di alluminio ha una massa di 1,2 kg. Sapendo che il calore specifico
dell’alluminio è 880
J
:
kg ⋅ K
•
determina la sua capacità termica;
•
quanta energia deve acquistare per aumentare la sua temperatura da
20°C a 120°C.
69
11. IL CALORE
2) Un cilindretto di ferro che peso 80 g (0,08 kg) deve essere riscaldato da 20°C
a 60°C fornendogli 25,6 J/s (ossia in ogni secondo si forniscono 25,6 J di
energia). Sapendo che il calore specifico del ferro è 480
J
, determina per
kg ⋅ K
quanto tempo deve essere riscaldato?
3) Due masse diverse a e b di una stessa sostanza vengono riscaldate ed il
grafico in figura rappresenta la temperatura T in centigradi, in funzione del
calore Q fornito.
Quale delle due masse è maggiore? Motiva la risposta.
120
100
T(°C)
80
corpo di massa a
60
corpo di massa b
40
20
0
0
1
2
3
4
5
Q(J)
4) Una sbarra di alluminio di 2 kg viene presa da un forno alla temperatura di 520
°C e messa in un recipiente che contiene 2 kg di acqua alla temperatura di
20°C.
•
Supponendo che non ci siano dispersioni, calcola la temperatura di
equilibrio.
•
Quanto calore ha perso l’alluminio caldo?
•
Quanto calore ha acquistato l’acqua fredda?
(calore specifico acqua=4180
J
J
; calore specifico alluminio=880
)
kg ⋅ K
kg ⋅ K
70
11. IL CALORE
Soluzioni:
1)
C = c ⋅ m = 880 ⋅1,2 = 1056
J
K
Q = m ⋅ c ⋅ ∆T = C ⋅ ∆T = 1056 ⋅ (120 − 20) = 1056 ⋅100 = 105600 J = 1,056 ⋅10 5 J
2)
Q = m ⋅ c ⋅ ∆T = 0,08 ⋅ 480 ⋅ (60 − 20 ) = 1536 J
triscaldamento =
Q
1536
=
= 60s = 1min
25,6 25,6
3) La massa b è maggiore della massa a. Infatti, a parità di calore somministrato, il corpo di
massa b aumenta meno la temperatura rispetto al corpo di massa a. Per esempio con 2J la
temperatura del corpo b sale di 10°C (da 20°C a 30°C), mentre la temperatura del corpo a
sale di 80°C (da 20°C a 100°C).
4)
Te =
(m1 ⋅ c1 ⋅ T1 + m2 ⋅ c2 ⋅ T2 ) = 2 ⋅ 880 ⋅ 520 + 2 ⋅ 4180 ⋅ 20 = 1082400 = 107°C
m1 ⋅ c1 + m2 ⋅ c2
2 ⋅ 880 + 2 ⋅ 4180
10120
Qceduto = m ⋅ c1 ⋅ ∆T1 = 2 ⋅ 880 ⋅ (107 − 520 ) = −7,27 ⋅ 105 J (segno meno, perché è ceduto)
Qassorbito = m2 ⋅ c2 ⋅ ∆T2 = 2 ⋅ 4180 ⋅ (107 − 20) = 7,27 ⋅ 105 J
N.B.: il calore ceduto è uguale a quello assorbito
71