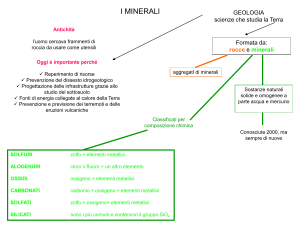
- Elementi nativi -
Tra gli elementi nativi ci sono alcuni elementi metallici e alcuni elementi non metallici.
Metallici: pochi elementi metallici si trovano in natura allo stato nativo e si tratta in genere di metalli “nobili”,
caratterizzati cioè da notevole inerzia chimica che ha impedito o comunque frenato la loro combinazione con
elementi non metallici (in particolare l’ ossigeno) e quindi la formazione di composti. Come conseguenza della
presenza del legame metallico le strutture sono compatte e manifestano proprietà fisiche caratteristiche
(lucentezza, malleabilità, conducibilità termica ed elettrica).
Oro (Au): colore giallo brillante, più chiaro se contiene argento e con il quale ha spiccato isomorfismo per la quasi
identità di raggio ionico, più scuro e rossiccio se contiene rame. La sua lucentezza è costante per assenza di fenomeni
di alterazione superficiale.
Esistono due tipi principali di giacimenti: quelli primari e quelli secondari.
I giacimenti primari hanno origine da magmi acidi (si trova l’ oro in vene idrotermali).
I giacimenti secondari sono costituiti da depositi alluvionali coerenti o incoerenti. Nei primi troviamo “Au” nei
conglomerati quarziferi (Sud Africa). Nei secondi nelle sabbie sciolte contenenti “pagliuzze” e “pepite”.
Argento (Ag): di colore splendente ma spesso annerito da un velo superficiale di solfuro di Ag (argentite).
A differenza dell’ oro, l’ argento nativo è poco importante perché molto raro, maggiormente si rinviene e si estrae
dal solfuro di argento Ag2S (argentite).
Rame (Cu): lo si rinviene raramente in cristalli e più comunemente lo si trova in masse compatte.
Il colore caratteristico del minerale è il “rosso-arancio”, spesso alterato in superficie (verde rame). Il rame che
troviamo in commercio si estrae o dai solfuri come calcopirite (Cu,Fe)S2 o dalla cuprite (Cu2O).
Non metallici:
Zolfo (S): Nel minerale sono presenti unità molecolari costituite da anelli di otto atomi di zolfo fra loro legati da
legami covalenti; fra gli anelli i legami sono più deboli con tipiche forze di Van der Waals. Il colore del minerale è
giallo “vivo”, ha basso punto di fusione (120°C circa) ed ha cattiva conducibilità termica ed elettrica.
I giacimenti possono essere vulcanici (solfatare) e sedimentari (solfare). Nei giacimenti sedimentari lo zolfo è sempre
associato a rocce di tipo evaporitico contenenti gesso, anidrite e talvolta salgemma: tipica la formazione gessososolfifera. I metodi estrattivi sfruttano il basso punto di fusione dello zolfo: trivella a circolazione d’ acqua calda
surriscaldata (120°C). In Italia esistono i giacimenti siciliani ora inattivi.
Diamante e grafite (C): sono due fasi polimorfe della stessa sostanza. La prima ha una struttura tetraedrica e la
seconda planare. Per le caratteristiche dei due minerali rivedersi gli appunti delle spiegazioni in classe.
Giacimenti diamantiferi di Kimberly (sud dell’Africa): sono cavità imbutiformi che contengono rocce basiche (le
kimberliti); i diamanti sono segregati da questa roccia per effetto di altissime pressioni che si generano all’ interno
degli “imbuti” in seguito a fenomeni eruttivi esplosivi.
Il diamante è utilizzato come gemma per le sue proprietà di trasparenza, durezza, alto indice di rifrazione, fenomeno
di dispersione-scomposizione della luce bianca aumentato dal taglio a brillante. Un carato per il diamante è pari a
0,200 g.