_________________________________________________________
RICERCA DI PIOMBO IN PREPARAZIONI DA FORNO E VALUTAZIONE
DELL’IMPATTO SULLA SALUTE UMANA DOVUTE AL CONSUMO DI PANE
BIANCO INDUSTRIALE PRECONFEZIONATO
N. Invernale G. Mancino
Scopo
Valutare il contenuto in diverse preparazioni di “pane bianco”di un metallo pesante, il Piombo, in
relazione agli effetti che possono manifestarsi sulla salute dei consumatori, mediante Potenziometria di
Strippaggio Anodico.
Introduzione
rendere le sue proprietà di cottura più
prevedibili.
Esso viene usato soprattutto per fare tramezzini
e toast.
Il pane bianco
Il pane bianco è fatto con farina di frumento da
cui sono stati rimossi la crusca e il germe. Ciò dà
alla farina un più lungo periodo di
conservazione, dal momento che la crusca
contiene olio, consentendo ai prodotti che si
realizzano con essa, una resistenza più lunga ai
tempi di transito e stoccaggio. Inoltre la farina
usata per il pane bianco è spesso sbiancata con
bromato di potassio o con diossido di cloro per
rimuovere anche ogni minimo alone giallo e
Varietà
Pane bianco
Pane bianco
tostato
Pane di segale
Pane in
cassetta
Pane integrale
Pane per
hamburger
Energia
(kcal)
261
Informazioni nutrizionali
Come si evince da Tabella 1 (1), il pane bianco è
una fonte energetica che sostituisce in tutto il
pane tradizionale per cui il suo consumo è
diffuso e l’eventuale presenza di contaminanti
tossici o pericolosi per la salute assume una
certa rilevanza.
Acqua (g)
Proteine (g)
Lipidi (g)
Glucidi (g)
Fibra (g)
34.9
8,5
1,6
51,5
3,5
262
37,5
6,8
4,4
46
5,3
230
40,5
6,2
1
45,8
6,5
272
34,9
7,9
3,8
49,9
3,6
259
36,1
10,9
3
44
6
271
36,2
7,5
4,7
47,5
4,1
Tabella 1: Valori nutrizionali in diverse preparazioni di pane
I metalli pesanti
Si definiscono metalli pesanti gli elementi con
peso atomico maggiore di 20 e densità cinque
volte superiore a quella dell’acqua (1,000 kg/m³
); inoltre presentano un carattere cationico con
diversi stati di ossidazione ed elevata attitudine
a formare complessi metallorganici.
Essi tendono ad accumularsi nel suolo e quindi
nella catena alimentare, e possono avere effetti
nocivi sugli esseri viventi anche a concentrazioni
non elevate.
I metalli pesanti sono presenti nell'aria,
nell'acqua, nel suolo e di conseguenza anche
negli alimenti. Tuttavia le attività umane hanno
portato ad una progressiva dispersione
nell'ambiente dei metalli stessi. L'uomo ha
cominciato ad estrarre e a lavorare i metalli
dall’antichità, ma con l'avvento dell'era
industriale l'industria mineraria e metallurgica si
svilupparono in maniera esponenziale fino agli
anni ‘80.
Le attività estrattive, metallurgiche e di
lavorazione dei metalli hanno determinato una
loro dispersione nell'ambiente di vita e
costituiscono un fattore di rischio anche per la
popolazione generale, oltre che per i lavoratori
esposti.
Piombo
Il piombo è l’elemento chimico con numero
atomico 82, ed il suo simbolo è Pb; in natura si
trova principalmente sottoforma di Galena
(PbS), un solfuro.
Esso fu uno dei primi metalli che vennero
scoperti in antichità; venne spesso usato dai
romani durante la costruzione di acquedotti.
Inoltre, venne associato dagli alchimisti al
pianeta Saturno, da dove deriva il nome
“Saturnismo”,
termine
che
indica
le
intossicazioni croniche da piombo.
Tossicità
Il piombo figura al 2° posto nella lista delle
sostanze pericolose indicate dall' ATSDR
(Agency for Toxic Substances and Disease
Registry) nel 1999. La nocività di questo metallo
è nota da molto tempo, specie nelle sue
manifestazioni acute (colica saturnina). Tuttavia
recentemente, come è accaduto per numerosi
altri agenti inquinanti, la dose considerata
critica è stata notevolmente abbassata. Fino a
circa trent'anni fa, l'avvelenamento cronico da
piombo era definito dalla presenza di una dose
superiore a 80µg/dl nel sangue, mentre
attualmente viene considerata 'alta' una dose di
Pb di 30 µg/dl e potenzialmente nocive, specie
nello sviluppo, quantità uguali o superiori a
10µg/dl (0.1ppm).
Assorbito
essenzialmente
attraverso
la
respirazione e la nutrizione, il piombo non viene
metabolizzato, ma per larga parte escreto,
mentre il resto (circa 20%) si distribuisce nei
tessuti e in particolare:
nel
sangue,
ove
circola
quasi
esclusivamente negli eritrociti
nei tessuti minerali (ossa e denti), ove si
accumula
nei tessuti molli (reni, midollo osseo, fegato
e cervello)
La presenza di Pb nel sangue, all'interno dei
globuli rossi e in massima parte legato
all'emoglobina, provoca anemia, che deve però
considerarsi non un sintomo, ma una
manifestazione tardiva dell'avvelenamento da
Pb. Attraverso il sangue, il Pb si distribuisce in
tutti gli altri tessuti. Per la sua capacità di
'imitare' il calcio, e quindi soprattutto in caso di
insufficiente assunzione di calcio, il piombo si
accumula nelle ossa e vi costituisce una
componente stabile. Tale componente può
essere mobilizzata, e quindi rientrare in circolo
nel sangue, in particolari stati fisiologici di stress
(gravidanza, allattamento, malattie), ma anche
come conseguenza di un accresciuto apporto di
calcio nella dieta. Questo accumulo stabile di Pb
nelle ossa rende molto lenta la guarigione dalla
piombemìa, anche dopo un completo
allontanamento dall'agente tossico. Il piombo è
in grado di danneggiare praticamente tutti i
tessuti, in particolare i reni e il sistema
immunitario. La manifestazione più subdola e
pericolosa dell'avvelenamento da piombo è
quella a carico del sistema nervoso. Negli adulti
il danno da piombo si manifesta soprattutto con
neuropatia periferica, che si ritiene dovuta a un
processo di demielinizzazione delle fibre
nervose. L'esposizione intensa ad elevate dosi di
piombo (da 100 a 200µg/dl) provoca
encefalopatia, i cui sintomi sono: vertigini,
insonnia, cefalea, irritabilità e successivamente
crisi convulsive e coma. La neuropatia da
piombo colpisce soprattutto nello sviluppo, con
turbe comportamentali e danni cognitivi. Studi
epidemiologici hanno mostrato una forte
correlazione fra il livello di piombo nel sangue e
nelle ossa e scarse prestazioni in prove
attitudinali (test QI o psicometrici); una simile
3
correlazione è stata accertata anche in studi
comportamentali su animali esposti al piombo
subito dopo la nascita. Il processo di
apprendimento
avviene
attraverso
la
formazione e il rimodellamento delle sinapsi e
l'effetto tossico del piombo su questo processo
suggerisce che questo metallo danneggi
specificamente la funzione sinaptica. La
particolare vulnerabilità dei bambini è
accresciuta dal fatto che essi sono
particolarmente esposti all'assunzione di
piombo, per esempio se nutriti con latte
artificiale preparato con acqua ricca di piombo,
ovvero per ingestione di frammenti di vernice al
piombo.
L'avvelenamento da piombo viene curato con
farmaci che esercitano un'azione 'chelante' sul
metallo, ovvero molecole in grado di legare il
piombo formando un complesso stabile che
viene escreto. I farmaci più utilizzati per questa
terapia sono il calcio-EDTA (calcio disodico
edetato), il diemercaprolo (DMSA o BAL) e la
penicillammina, un derivato della penicillina che
però non ha azione antibatterica, ma solo
chelante. (2)
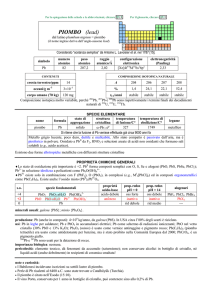
Valori limite negli alimenti
Il valore di riferimento viene desunto dalla
Tabella 2 ed è pari a 0,050 ppm. (3) (4)
Tabella 2: estratto della tabella della Gazzetta Ufficiale dell'Unione Europea
Potenziometria di Strippaggio Anodico
La potenziometria di ridissoluzione fu introdotta
nel 1976 da Jagner e Graneli, che la applicarono
alla determinazione di ioni metallici che
formano un’amalgama con il mercurio (o leghe
con l’oro).
Si lavora con un sistema potenziostatico a tre
elettrodi, opportunamente modificato da un
voltmetro a elevata impedenza per la misura
del potenziale dell’elettrodo di lavoro. La
preconcentrazione,
che
consiste
nella
elettrodeposizione catodica degli ioni metallici
da depositare, a una durata variabile secondo le
esigenze analitiche (in genere circa due min.),
viene condotta su l’elettrodo di carbonio
vetroso ricoperto da un sottile film di mercurio
o d’oro, a cui viene applicato un potenziale
sufficientemente negativo. La soluzione in
analisi deve contenere un opportuno agente
ossidante, come l’ossigeno disciolto nel
campione oppure ioni Hg2+ o anche, talvolta,
4
ioni Cr2O7 2- o MnO4-. Le reazioni che si
verificano possono essere così schematizzate:
Riduzione dello ione metallico e formazione di
una amalgama
Mn+ + ne-
M(Hg)
Riduzione degli ioni Hg2+ o di altri ossidanti
presenti. I metalli si depositano con diverse
velocità, secondo la loro natura e
concentrazione. Se vengono mantenute
costanti le condizioni idrodinamiche (velocità di
agitazione della soluzione), la riproducibilità è
assicurata. Dopo la preconcentrazione si
interrompe l’applicazione del potenziale e si
apre il circuito; entrambi gli elettrodi (quello di
lavoro
e
di
riferimento)
vengono
immediatamente collegati ad un voltmetro per
la misura del potenziale. A partire da questo
momento si registra la variazione nel tempo del
potenziale del microelettrodo, che in questa
fase funge da elettrodo indicatore, perché non
è più polarizzato. Tale variazione è dovuta alla
riossidazione dei metalli amalgamati, che
ritornano in soluzione come cationi.
L’ossidazione
può
avvenire
a
spese
dell’ossigeno normalmente disciolto, che si
riduce ad H2O o H2O2, oppure di Hg2+ o degli
altri ossidanti appositamente introdotti in
soluzione prima dell’analisi. L’ossidazione dei
diversi metalli avviene secondo i rispettivi
potenziali redox, a partire dal più riducente, e la
velocità del fenomeno è regolata dalla velocità
con cui l’agente ossidante raggiunge il
microelettrodo. Lavorando in condizioni tali da
mantenere costante questa velocità, il tempo
necessario per la completa ridissoluzione di un
metallo è direttamente proporzionale alla
quantità
depositata
e
dunque
alla
concentrazione
del
campione.
(5)
Figura 1: Tipico tracciato di una determinazione in PSA
Questo tracciato pone sull’asse delle x Δt/ΔE e
sull’asse delle y il potenziale in Volt. La
concentrazione dei metalli è correlabile con
l’altezza della relativa onda. La linea rossa
rappresenta la concentrazione dell’analita nel
campione tal quale, mentre quella blu indica la
concentrazione in seguito all’aggiunta della
soluzione standard a titolo noto.
Procedura sperimentale
Pretrattamento del campione
Si omogeneizza il campione (circa 30 grammi)
che si vuole analizzare tramite mulino a lame, in
modo pulsato per prevenire surriscaldamento. Il
campione così ottenuto viene conservato in
contenitore a tenuta ed in ambiente anidro sino
ad una settimana.
Incenerimento a secco
Si pesano circa esattamente 5,0 g di campione
precedentemente omogeneizzato in una
capsula di porcellana, e si carbonizzano su
piastra riscaldante in maniera lenta e graduale
al fine di evitare perdite di materiale. Il residuo
carbonioso viene trasferito in muffola ed
incenerito alla temperatura di 520°C fino a
quando le ceneri non risultano bianche o
leggermente grigiastre. Dopo tale trattamento
si aggiunge 1 ml di HNO3 al 65% e si riscalda
fino a completa dissoluzione. La soluzione viene
trasferita quantitativamente in un matraccio
tarato da 50 ml ei portata a volume con H2O
distillata. (6)
Ricerca del Pb presente nel campione
mediante l’uso della PSA
Lo strumento utilizzato è ION3 (Steroglass) con
software Neotes. Per effettuare la
determinazione potenziometrica di stripping si
usano i seguenti parametri strumentali:
Volume campione 10 mL
Volume di diluizione 11 mL
Volume di Standard 0,1 mL
Concentrazione di standard 5 ppm
Fattore di diluizione 10
Intervallo di integrazione -495 -295 mV
Intervallo di potenziale da -700 mV a -5
mV
Potenziale di condizionamento 50 mV
per 5 secondi
Potenziale di accumulo – 900 mV per
180 secondi
Tempo di ridissoluzione 10 secondi
Potenziale finale di acquisizione 0 mV
Periodo di campionamento 300 micro
secondi
Velocità di agitazione impostata a 2
Plating
Si introducono nella cella 20 ml di soluzione di
platinatura con la composizione mercurio
standard a 1000 ppm in HCl 1M e si esegue la
procedura di platinatura per 4 minuti a velocità
di agitazione 2.
Esecuzione dell’analisi
Si introducono 10 ml di HCl 2M, 10 ml di
soluzione da analizzare ottenuta dopo
l’incenerimento a secco e 1 ml di soluzione di
platinatura formata da Hg2+ a 1000 ppm come
ossidante. Si effettua l’aggiunta di standard
dopo tre replicazioni.
Raccolta dati
Lo strumento fornisce i dati già elaborato
secondo il metodo delle aggiunte e permette la
reintegrazione nel caso occorra spostare il
limite di integrazione a causa della normale
usura dell’elettrodo ad argento/cloruro di
argento. Vengono di seguito riportate le curve
analitiche e le rette di regressione. Si
raccolgono i risultati analitici in Tabella 3
Pane bianco Conad
Pane bianco Coop
Pane bianco Barilla
Conc. Pb nella matrice
1306,6 ppb
1881,13 ppb
1412,61 ppb
Rapporto fra contenuto e
valore limite
26.1
37.6
28.3
Tabella 3: riassunto dei risultati analitici
Risultati e discussione
Si osserva immediatamente che tutti i valori
ottenuti sono ampiamente superiori al limite di
riferimento di 50 ppb. Il 100% dei campioni
analizzati risulta fuori limite e questo fa
supporre che, essendo le materie prime comuni
per tutte le aziende principali di trasformazione
nel territorio italiano, questi valori siano
riscontrabili anche in prodotti di aziende
diverse. Le materie prime sono sicuramente fra
i maggiori responsabili dell’alto contenuto di
piombo e diventa importante per una scelta
consapevole da parte del consumatore
conoscere la provenienza di queste. La
tracciabilità e una etichetta chiara ed esaustiva
sono però, ad oggi, una chimera e quasi mai è
possibile conoscere i requisiti e le
caratteristiche delle materie prime utilizzate. Il
concetto di tracciabilità, così come delineato dal
regolamento CE 178 /2002 è utilizzato solo
nell’ambito della sicurezza alimentare e non nel
processo di etichettatura. In altre parole, le
aziende devono esibire la tracciabilità alle
autorità competenti che ne facciano richiesta,
ma non devono indicare la provenienza
sull’etichetta. A tutt’oggi non esiste un
regolamento di tutela del consumatore per
questo aspetto. L’elevato contenuto di piombo
nei cereali è sicuramente proveniente dai suoli
su cui sono coltivati e quindi i risultati ottenuti
sono un campanello di allarme più globale di
inquinamento ambientale diffuso anche
probabilmente alle acque di irrigazione
superficiali e di falda.
provoca in realtà un forte aumento dei costi
sociali derivanti da problemi di salute connessi
al consumo di prodotti come quelli da noi
analizzati. A nostro avviso i governi dovrebbero
aumentare gli sforzi per arrivare a dei protocolli
di intesa a livello globale che tengano conto
delle esigenze aziendali e di quelle di salute
pubblica. Organismi come l’EFSA nati proprio
per sovrintendere la sicurezza alimentare
sembrano a volte più preoccupati di non crear
danno alle economie mondiali che alla reale
salute dei cittadini.
Bibliografia
1. United States Department of Agriculture.
National Nutrient Database for Standard
Reference Release 28. [Online]
https://ndb.nal.usda.gov/ndb/foods/show/561
4?fgcd=Baked+Products&man=&lfacet=&count
=&max=35&sort=&qlookup=&offset=35&forma
t=Full&new=&measureby=.
2. CNR. [Online]
http://www.phyles.ge.cnr.it/htmlita/tossicitade
lpiombo.html.
3. Gazzetta ufficiale dell’Unione europea.
REGOLAMENTO (CE) N. 1881/2006 DELLA
COMMISSIONE.
4. Gazzetta ufficiale dell'Unione europea.
REGOLAMENTO (UE) 2015/1005 DELLA
COMMISSIONE del 25 giugno 2015 che modifica
il regolamento (CE) n. 1881/2006 per quanto
concerne i tenori massimi di piombo in taluni
prodotti alimentari.
Conclusioni
5. D., Jagner. The analyst. 1982. p. 593 - 599.
Vol. 107.
Le aziende produttrici acquistano materie prime
senza preoccuparsi del livello dì inquinamento
nel paese di coltivazione per scelta economica,
ma questa stessa scelta improntata al risparmio
6. Istituto Superiore di Sanità. Metodi di analisi
utilizzati per il controllo chimico degli alimenti.
1996.