Large Animals Review, Anno 9, n. 4, Agosto 2003
45
EMBRYO TRANSFER NEGLI OVINI E NEI CAPRINI
II - Tecniche di trapianto degli embrioni e fattori
che influenzano il successo dell’Embryo Transfer*
GIOVANNI MARTEMUCCI, ANGELA GABRIELLA D’ALESSANDRO
Dipartimento di Progettazione e Gestione dei Sistemi Agro-Zootecnici e Forestali
Università degli Studi - Bari
Vengono descritte le principali metodiche di trapianto degli embrioni e i fattori di maggiore influenza sulla sopravvivenza
embrionale e sul successo della biotecnologia di embryo transfer negli ovini e nei caprini. La metodica laparoscopica di trapianto degli embrioni risulta più rapida e meno traumatica rispetto a quella chirurgica. La tecnica semi-laparoscopica fornisce
risultati soddisfacenti. La qualità degli embrioni prodotti in vitro è inferiore a quella della produzione in vivo. La metodica di
crioconservazione degli embrioni per vitrificazione fornisce buoni risultati. Per il transfer merita particolare attenzione lo stadio di sviluppo degli embrioni, il grado di sincronizzazione tra embrione e stato fisiologico della ricevente, il numero e sito di
transfer degli embrioni.
Summary
The article describes the main techniques for embryo transfer and the factors affecting embryo survival and successful of
the whole biotechnology of embryo transfer in sheep and goats. Transfer by laparoscopic method is more rapid and less traumatic compared to the surgical procedure. Semi-laparoscopic technique provides satisfactory results. In vitro-produced embryos emphasize a lower quality than those in vivo derived. Regarding embryo cryopreservation, the vitrification system is an
effective method providing good results. Stage of embryo development, synchrony between age of embryos and physiological state of recipient, number of embryos transferred and site of transfer affect survival of embryos.
INTRODUZIONE
La tecnica di trasferimento embrionale, mentre nei bovini
trova già un consistente interesse, negli ovini e nei caprini è
limitata dal rapporto costo/benefici e dalle procedure di
raccolta e di trapianto per via chirurgica degli embrioni66.
Con lo sviluppo dell’allevamento intensivo, si assiste ad una
maggiore predisposizione dell’allevatore ad accettare l’impiego di tecnologie innovative e l’applicazione delle biotecnologie riproduttive nell’allevamento. Peraltro, l’intensificarsi degli scambi internazionali del germoplasma animale e
la problematica legata alla conservazione delle razze in via
di estinzione determinano una modificazione del concetto
classico di “costi/benefici” e accrescono l’interesse verso
l’embryo transfer anche nei piccoli ruminanti.
Il primo intervento di embryo transfer nella pecora e nella
capra risale al 1934 ad opera di Warwick et al.155. Nel 1955
* Lavoro svolto nell’ambito del P.F. R.A.I.Z. Pubblicazione N. RZ 296.
Hunter et al.58 effettuarono il trapianto di 19 embrioni in 18
pecore, con un tasso di sopravvivenza embrionale del 42%
(8 agnelli nati). La procedura adottata da questi Autori costituisce ancora oggi la base per il trapianto chirurgico degli
embrioni negli ovini e nei caprini. La metodologia di trasferimento degli embrioni costituisce una fase importante dell’embryo transfer, a cui è legato il successo e le potenzialità
di sviluppo della biotecnologia. I risultati conseguiti variano
con le diverse procedure adottate (Tabb. 1 e 2).
METODOLOGIE DI TRASFERIMENTO EMBRIONALE
Trasferimento chirurgico
L’animale, privato degli alimenti solidi e liquidi 24-36
ore prima dell’intervento, viene preparato come per l’intervento di raccolta degli embrioni e posto in decubito
dorsale sul tavolo operatorio con inclinazione antero-posteriore di 30-45°79.
ALTRE SPECIE
Riassunto
46
Embryo Transfer negli ovini e nei caprini - II
Tabella 1
Sintesi di risultati di trasferimento degli embrioni negli ovini in rapporto alla tecnica di trapianto e alle caratteristiche dell’embrione
Trapianto
Fertilità(3)
Embrione
Sopravvivenza
Embrionale(4)
Autori
Tecnica
Sito
Età(1)
Tipo(2)
N/ricevente
N
%
N
%
Laparoscopia
utero
6-7 d
Fresco
/
/
88
/
72
Naitana e Cappai, 1988
Laparotomia
utero
-
Fresco
/
22/25
88
/
/
Vallet et al., 1991
Laparoscopia
utero
-
Fresco
/
37/46
80
/
/
”
Laparoscopia
utero
6d
Fresco
1
12/33
36,4
12/33
/
Caira et al., 1992
Laparotomia
utero
6d
Fresco
1
18/37
48,6
18/37
48,6
”
Laparotomia
utero
3-6 d
Fresco
1
126/276
45,6
/
/
Cseh e Seregi, 1993
Laparotomia
utero
3-6 d
Fresco
2
32/58
55,2
/
/
”
Transcervicale
utero
7d
Fresco
2-3
1/15
6,6
/
/
Buckrell et al., 1993
Laparoscopia
utero
7d
Fresco
2-3
14/14
100
/
/
”
Laparoscopia
utero
5,5-6,5 d
Fresco
1-2
/
/
/
71
McMillan e Hall, 1994
Laparotomia
utero
/
Fresco
1-2
/
/
17/24
70,8
Ledda et al., 1995
Semilaparoscopia
utero
5d
Fresco
2
/
/
1/4
25
Flores-Foxworth et al., 1995
Semilaparoscopia
utero
5d
IVP - fresco
1-3
/
/
3/13
23
”
Semilaparoscopia
utero
B
IVC - fresco
2
/
/
28/70
40
O’Brien et al., 1997
Laparotomia
utero
6d
Fresco
2
20/32
62,5
28/64
43,7
Martemucci et al., 1988 b
Laparotomia
utero
7-8 d
IVP - fresco
2
8/17
47,0
14/34
41,2
Ptak et al., 1999 b
Laparotomia
utero
7-8 d
IVP - congelato
2
7/21
30,0
10/42
23,8
”
Laparotomia
utero
7d
Fresco
1-3
18/25
72
29/48
60
Baril et al., 2001
Laparotomia
utero
7d
Congelato
2
27/36
75
25/50
50
”
Laparotomia
utero
7d
Fresco
2
8/11
72,7
14/22
63,6
D’Alessandro e
Martemucci, 2003
Laparotomia
utero
7d
Congelato
”
11/15
73,3
17/30
56,7
”
(1)
(2)
(3)
(4)
M= morula; B= blastocisti
IVP= embrioni prodotti in vitro; IVC= embrioni coltivati in vitro
Fertilità= femmine partorite/trapiantate
Sopravvivenza embrionale= nati/embrioni trasferiti
Nei piccoli ruminanti, la procedura chirurgica tradizionale di trasferimento embrionale viene eseguita con esteriorizzazione del tratto riproduttivo dopo laparotomia medio-ventrale4,24,33,43,62,65,68,81,138,159. Dopo anestesia generale,
viene praticata una incisione di 7-8 cm sulla linea alba, a
partire da 2-3 cm dalla linea di attacco della ghiandola
mammaria. Vengono esteriorizzati i corni uterini e osservata la presenza di corpi lutei sulle ovaie.
Per il trapianto, gli embrioni vengono aspirati in 30-50 µl
di medium PBS in un capillare di vetro o in un catetere tomcat collegato ad una siringa di 1 ml. Dopo la puntura con
ago a punta conica, a livello del terzo superiore, del corno
ipsilaterale dell’ovaia dove è presente il corpo luteo, il capillare viene introdotto per 2-3 cm nel lume uterino, in prossimità della giunzione utero-tubarica, e gli embrioni vengono
espulsi lentamente in direzione del corpo dell’utero.
Dopo il transfer, si somministra antibiotico nella cavità
addominale, quindi si procede alla suturazione del peritoneo, del sottocute e della cute.
Trasferimento laparoscopico
La procedura di trasferimento degli embrioni per via
endoscopica è stata sviluppata, sia negli ovini che nei caprini, con diverse varianti24,50,51,69,99,105,149,150,159.
Per il transfer laparoscopico può essere effettuata solo
la sedazione dell’animale associata ad anestesia locale, o
soltanto l’anestesia locale.
Secondo McMillan e Hall93 la ricevente viene sedata,
con 0,2 ml di xilazina cloridrata 2%, e posta in decubito
dorsale su un tavolo operatorio inclinato a circa 45°; una
Large Animals Review, Anno 9, n. 4, Agosto 2003
47
Tabella 2
Sintesi di risultati di trasferimento degli embrioni nei caprini in rapporto alla tecnica di trapianto e alle caratteristiche dell’embrione
Fertilità(3)
Embrione
Sopravvivenza
Embrionale(4)
Autori
Tecnica
Sito
Età(1)
Tipo(2)
N/ricevente
N
%
N
%
Laparotomia
utero
5-7 d
Refrigerato
1-2
6/11
54,5
6/17
35,2
Bilton e Moor, 1976
Laparotomia
utero
5-7 d
Congelato
1
3/6
50
3/6
50
”
Laparotomia
utero
6-7 d
Congelato
2-3
37/14
21
7/53
13
Jaques et al.,1989
Laparotomia
utero
6-7 d
Fresco
”
33/52
62
56/134
41,7
”
Laparotomia
utero
6-7 d
Fresco
1-3
/
/
/
56
Deguet et al., 1989
Laparotomia
utero
/
/
/
24/34
70,5
39/70
55,7
Vallet et al., 1991
Laparoscopia
utero
/
/
2
28/37
75,6
28/77
62,3
”
Laparotomia
utero
M
IVP - fresco
3
–
50
2/6
33,3
Kenskintepe et al., 1996
Laparoscopia
ovidutto
/
Fresco
4-5
6/23
26
9/108
8,3
Kuhholzer et al., 1998
Laparotomia
utero
7-8 d
Congelato
2
/
61,8
/
47,3
Baril et al., 2000
(1) M= morula; B= blastocisti
(2) IVP= embrioni prodotti in vitro; IVC= embrioni coltivati in vitro
(3) Fertilità= femmine partorite/trapiantate
(4) Sopravvivenza embrionale= nati/embrioni trasferiti
infiltrazione locale con lignocaina cloridrata (2%) viene
praticata nei punti di incisione della parete addominale,
anteriormente alla ghiandola mammaria.
O’Brien et al.107, per la ricevente riportano l’anestesia locale effettuata con 5 ml di lignocaina.
Baril et al.10, invece, riportano l’anestesia generale dell’animale per il transfer endoscopico degli embrioni.
Ai fini del trapianto10, gli embrioni vengono aspirati in
30-50 µl di medium in un capillare di vetro (70 mm x 1
mm di diametro), collegato ad una siringa di 1 ml mediante un tubo di raccordo di 20 cm. Per assicurare la necessaria rigidità per poter operare, il capillare ed il tubo sono
inseriti in una cannula metallica. Per l’intervento di trapianto, vengono praticati tre punti di incisione sulla parete
addominale. Uno serve per il passaggio della cannula dell’endoscopio e per l’immissione dell’aria nella cavità addominale (pneumoperitoneo), al fine di agevolare la visualizzazione e la manipolazione degli organi riproduttivi. Attraverso la seconda incisione, opposta alla prima, a pochi
centimetri dalla linea alba, viene introdotta una pinza
atraumatica, per la manipolazione del tratto riproduttivo.
Tramite la pinza viene mantenuto il corno uterino ipsilaterale all’ovaia con corpo luteo. Una terza incisione sulla linea alba, a 15 cm dalla linea di attacco della mammella, infine, viene effettuata per il passaggio della cannula con il
capillare contenente l’embrione. Il transfer viene eseguito
inserendo il capillare nel lume uterino, in prossimità della
giunzione utero-tubarica, punta con ago di Mintz (30 cm x
1,5 mm di diametro) previamente inserito nella cavità ad-
dominale attraverso la linea alba. Gli embrioni vengono
espulsi lentamente in direzione del corpo dell’utero. Il trasferimento embrionale viene effettuato in circa 5 minuti.
McMillan e Hall93 utilizzano per il transfer endoscopico
due punti di incisione, a circa 5-7 cm anteriormente alla
ghiandola mammaria. Una incisione viene praticata sulla
linea alba, per il passaggio di una pinza atraumatica di Allis modificata; l’altra, a 5-7 cm sulla destra della linea alba,
per il passaggio dell’endoscopio. La pinza di Allis viene
utilizzata per manipolare il tratto riproduttivo, ovvero,
dapprima per la rilevazione dei corpi lutei e, successivamente, per la esteriorizzazione dell’apice del corno uterino
(2-3 cm), attraverso una incisione praticata sulla linea alba.
Gli embrioni vengono aspirati in un aspic per inseminazione in utero (Cassou, IMV, L’Aigle, Francia), modificato,
collegato a una siringa da 1 ml. Attraverso l’ago dell’aspic,
gli embrioni vengono immessi lentamente nel lume uterino
in direzione del corpo dell’utero. Nel 5-10% degli animali
trapiantati sono state riscontrate complicazioni nel transfer, con compromissioni nella sopravvivenza embrionale.
Negli animali privi di complicazioni durante il transfer è
stato ottenuto un elevato tasso di gravidanza (>80%) e di
sopravvivenza embrionale (>70%).
Per l’impianto degli embrioni Caira et al.24 utilizzano
due punti di incisione, previa infiltrazione con lidocaina
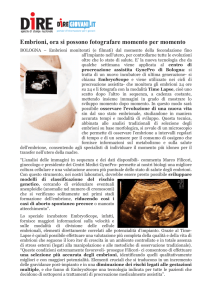
cloridrato (2%), in posizione simmetrica, a 3-4 cm dalla linea mediana della parete addominale, a circa 10 cm dall’attacco della mammella (Fig. 1). Attraverso una incisione
passa la cannula dell’endoscopio e l’aria per ottenere il
ALTRE SPECIE
Trapianto
48
Embryo Transfer negli ovini e nei caprini - II
A
B
C
D
FIGURA 1 - Trapianto di embrioni mediante laparoscopia nella pecora (da Caira et al. 1992).
Il laparoscopio viene prima utilizzato per la osservazione del tratto riproduttivo (A) e la pinza da presa a valve smusse serve per prendere il corno uterino (B).
La pistolet, attraverso il laparoscopio, entra in cavità (C) e con la punta penetra nel lume uterino ove viene deposto l’embrione (D).
L = Laparoscopio; P = Pinza da presa a valve smusse; T = Pistolet.
pneumoperitoneo. L’ottica laparoscopica operativa, con
diametro di 10 mm (SL 10,8939.315 Wolf), è percorsa da
un canale cilindrico di 5 mm per il passaggio di una pistolet (mod. Cassou, IMV, L’Aigle, Francia), modificata per il
trapianto degli embrioni (45 cm di lunghezza, 4 mm di
diametro, puntale terminale di 3 cm ad ago smusso). Nella
guida interna viene inserita la paillette contenente l’embrione. Attraverso la seconda incisione viene introdotta la
cannula (6 mm) per il passaggio della pinza da presa a valve smusse (mod. 8383.03 Wolf) con la quale viene bloccato il corno uterino ipsilaterale all’ovaio con il corpo luteo.
La pistolet, con la paillette contenente l’embrione, viene
introdotta nella guida della cannula dell’ottica, e la parte
terminale dell’ago, con leggera pressione, penetra nel lume
ove viene deposto l’embrione.
La procedura laparoscopica di impianto degli embrioni rispetto a quella chirurgica è meno traumatica, meno
costosa e più rapida (circa 5 minuti10; da 15 a 20 soggetti/
ora93).
Il tasso di concepimento o di fertilità risulta similare
con il trasferimento laparoscopico e chirurgico degli embrioni (Tab. 3).
Trasferimento trans-cervicale
Il trasferimento degli embrioni per via trans-cervicale è
stato poco studiato nei piccoli ruminanti.
In generale la ricevente viene preparata come descritto
per la raccolta trans-cervicale degli embrioni.
Large Animals Review, Anno 9, n. 4, Agosto 2003
Specie
Trasferimento embrioni
Chirurgico
Endoscopico
Autori
Caprini1
70,5
(34)
75,6
(37)
Vallet et al. (1989)
Ovini2
69,0
(26)
74
(27)
Brebion et al. (1989)
1
: % di femmine partorite.
: % di femmine gravide.
( ): Numero delle riceventi.
2
Per il transfer, dopo aver posizionato l’ingresso della
cervice nella parte anteriore della vagina con una pinza
atraumatica, il catetere contenente gli embrioni viene inserito attraverso l’ostio della cervice e il passaggio nel canale cervicale viene guidato per via trans-rettale. Il passaggio del catetere attraverso la cervice è difficoltoso, soprattutto nella pecora, per le caratteristiche anatomiche
del tratto riproduttivo116. Gli embrioni vengono depositati nel corpo o alla base del corno uterino, in maniera non
precisa, e senza possibilità di controllare la presenza del
corpo luteo e di individuare il corno ipsilaterale all’ovaia
con il corpo luteo.
Nella capra, Flores–Foxworth et al.50 non hanno riscontrato differenze nel tasso di gravidanza di riceventi con impianto di embrioni per via laparoscopica o trans-cervicale
(35,7 vs 38,9%).
Nella pecora, Buckrell et al.23 hanno eseguito il trapianto trans-cervicale degli embrioni con la tecnica adottata
per la inseminazione artificiale (Guelph System for Transcervical AI), ottenendo risultati non soddisfacenti (6,6%)
rispetto alla tecnica laparoscopica (100%).
In generale, il tasso di sopravvivenza embrionale successivo a trapianto per via cervicale è insoddisfacente.
FATTORI CHE INFLUENZANO LA SOPRAVVIVENZA
DEGLI EMBRIONI TRAPIANTATI E IL SUCCESSO
DELL’EMBRYO TRANSFER
Molti sono i fattori che possono ostacolare la riuscita
del trasferimento embrionale: le caratteristiche della donatrice, della ricevente, dell’embrione, o fattori esterni.
Per quanto attiene ai fattori esterni è consigliabile evitare ogni possibile causa di stress durante le tre-quattro
settimane precedenti e successive all’embryo transfer,
quali: cambio di alimentazione, vaccinazioni, trasporti,
riorganizzazione della gerarchia tra gli animali nell’ambito dei gruppi. Gli ovini, e i caprini in particolare, sono
sensibili al gruppo, alla gerarchia e alle variazioni ambientali62,138,150.
MANAGEMENT E SUPEROVULAZIONE
DELLA DONATRICE
Management della donatrice
Fermo restanti le elevate caratteristiche genetiche richieste ai fini della produzione in vivo degli embrioni nell’ambito del MOET (Multiple Ovulation and Embryo
Transfer), risultano importanti anche lo stato fisiologico e
lo stato sanitario della donatrice.
È consigliabile custodire gli animali in idonee condizioni igieniche ed effettuare i trattamenti di profilassi sanitaria. È opportuno separare le pecore dalle capre almeno
due mesi prima dell’inizio degli interventi di iperstimolazione ovarica, poiché la mescolanza in gruppo delle due
specie causa stress91.
Per le donatrici si richiede una età non avanzata, una
carriera riproduttiva normale, uno stato sanitario ottimale,
sia clinico che ginecologico, tre mesi prima dei trattamenti
di superovulazione.
I trattamenti di iperstimolazione ovarica per la produzione di embrioni devono essere effettuati ad una distanza
minima di cinque mesi dopo il parto.
La presenza della lattazione e/o un elevato livello di produzione di latte riducono la risposta superovulatoria26,80.
Trasferimento semi-laparoscopico
È una procedura che associa la endoscopia ad un piccolo intervento chirurgico. La ricevente è posizionata sul tavolo operatorio, come descritto per il trasferimento laparoscopico.
L’animale non è sottoposto ad anestesia generale; viene
sedato con acepromazina (0,3 mg/kg), a cui si associa l’anestesia locale (xilocaina) nei due punti di incisione sulla
parete addominale, a circa 10 cm anteriormente all’attacco
della ghiandola mammaria10. Attraverso una incisione si
introduce in cavità l’ottica laparoscopica, dall’altra, di circa 1 cm, una pinza atraumatica con cui viene esteriorizzato
l’apice del corno uterino ipsilaterale all’ovaia con corpo luteo. Con un ago si pratica un piccolo foro sul corno uterino, in prossimità della giunzione utero-tubarica, e un piccolo catetere viene usato per il trasferimento degli embrioni nel lume uterino.
I risultati conseguiti nella pecora con questa procedura
sono incoraggianti (70-80% di gravidanza7).
Superovulazione, produzione in vivo
e qualità degli embrioni
I risultati relativi alla produzione in vivo degli embrioni
negli ovini e nei caprini, conseguenti ai trattamenti farmacologici di superovulazione sono stati pubblicati da vari
Autori5,10,29,36,78 e indicano una elevata variabilità di risposta alla iperstimolazione ormonale, sia nel tasso di ovulazione che nella produzione di embrioni. A ciò contribuiscono vari fattori, di natura genetica, stagionale, ambientale, nutrizionale, individuale, legati anche alle caratteristiche dei preparati ormonali e alla loro modalità di somministrazione, al tipo di inseminazione.
Negli ovini, la produzione media di embrioni trasferiti o
crioconservati, per donatrice, varia da 2,9-4,564,86,122,137 a
10,429, con un tasso di recupero di embrioni vitali pari al
33-50% delle ovulazioni. Nei caprini, Chemineau et al.27
indicano un range di 12-16 ovulazioni medie, con una va-
ALTRE SPECIE
Tabella 3
Tasso di gravidanza o di fertilità successiva al trasferimento
di embrioni per via chirurgica o endoscopica
49
50
Embryo Transfer negli ovini e nei caprini - II
riabilità individuale da 0 a 40 ovulazioni. In media si possono ottenere 7 embrioni utilizzabili per capra19,27.
La variabilità nella risposta superovulatoria e nella produzione di embrioni costituisce una forte limitazione nei
programmi di embryo transfer nei piccoli ruminanti.
Rapporto FSH/LH e modalità di somministrazione
delle gonadotropine
In generale, la superovulazione è indotta alla fine di un
trattamento progestativo di sincronizzazione degli estri,
mediante iniezione di preparati gonadotropici per una durata uguale a quella della crescita follicolare terminale (3
giorni). Attualmente, per ottenere alti tassi di ovulazione
viene maggiormente accettato l’impiego di estratti pituitari
di FSH rispetto alla gonadotropina sierica di cavalla gravida (PMSG).
I preparati di FSH di origine porcina (pFSH) o ovina
(oFSH) sono estratti ipofisari più o meno purificati, con
attività FSH ed LH variabile in rapporto al lotto commerciale. Considerando la breve emivita del preparato
FSH (2 ore2; 5 ore per il pFSH44), si utilizza un regime di
6-8 iniezioni, ogni 12 ore, a partire da 2-3 giorni prima
della fine del trattamento progestativo, con una dose totale variabile tra 16 e 20 Unità Armour. Nella pecora, un
preparato ipofisario a basso contenuto di LH non favorisce la superovulazione e la produzione di embrioni37,39.
Nella capra, risultano adeguati estratti ipofisari con apporto di LH pari al 40%106 e anche al 100% del preparato gonadotropico83.
All’inizio del trattamento di iperstimolazione ovarica
l’attività FSH del preparato gonadotropico deve prevalere
su quella dell’LH. La possibilità di utilizzo delle frazioni
purificate di FSH e di LH, nel protocollo di superovulazione, può consentire di mimare gli eventi fisiologici delle
variazioni endogene delle gonadotropine, comprese tra la
regressione luteale e l’ovulazione. L’impiego di un rapporto FSH/LH decrescente durante il trattamento superovulatorio, con valori pari a 0,3-0,4 nelle due ultime somministrazioni, migliora la risposta ovarica e la produzione
degli embrioni negli ovini30,39. Nei caprini, la variazione
del rapporto FSH/LH durante il trattamento di superovulazione ha fornito risultati discordanti, positivi in alcune ricerche11, mentre in altre non ha migliorato la produzione di embrioni19,38.
Particolare importanza ai fini della risposta superovulatoria assume la dinamica follicolare individuale al momento del trattamento. Nella pecora, la presenza di un
follicolo dominante influenza negativamente la risposta
superovulatoria120 così come rilevato nella bovina67. Risulta difficile realizzare un trattamento in assenza del follicolo dominante, poiché ciò impone il costante monitoraggio
ecografico dei follicoli nella donatrice. Il controllo delle
ondate follicolari può essere superato mediante un trattamento antigonadotropico con agonisti/antagonisti del
Gn-RH, che ha fornito risultati incoraggianti nella pecora
e nella capra29,85. L’impiego di Gn-RH antagonista seguito
dalla somministrazione di LH sembra poter allungare la
fase follicolare e consentire un maggiore reclutamento e
maturazione di follicoli nonché una maggiore sincronia
tra l’ovulazione e la inseminazione artificiale nella dona-
trice12,46. Nella pecora Lacaune il trattamento con Gn-RH
antagonista consente una produzione superiore a 10 embrioni trasferibili e 7 nati per donatrice29, ma la variabilità
individuale del tasso di ovulazione rimane ancora molto
elevata31.
Il trattamento ripetuto di iperstimolazione ovarica con
gonadotropine eterologhe può indurre la formazione di
anticorpi nella donatrice. Nella capra, l’induzione ripetuta
della superovulazione con pFSH causa la formazione di
anticorpi anti- pFSH115 che limita la risposta superovulatoria. Questo ostacolo può essere superato efficacemente
utilizzando l’FSH ovino (oFSH) o l’FSH caprino
(cFSH)14, anche se il preparato caprino di FSH non è
commercializzato. Recenti studi hanno dimostrato una
maggiore componente genetica nella immuno-risposta alle
gonadotropine esogene118 suggerendo una strategia di selezione nell’utilizzo delle donatrici nei programmi MOET.
Alcuni studi condotti negli ovini indicano che il trattamento di superovulazione può essere semplificato con una
sola iniezione, veicolando il pFSH in PVP (polivinilpirrolidone)40,42. Un’altra strategia è rappresentata dall’impiego,
in una singola somministrazione, di pFSH associato a dosi
moderate di PMSG (400-800 UI)40,121. Nella capra, questo
trattamento condiziona negativamente la risposta ovulatoria e la qualità degli embrioni38.
Inseminazione della donatrice e produzione
di embrioni
La fertilizzazione della donatrice varia in rapporto al
metodo di inseminazione e al grado di sincronizzazione
delle ovulazioni. Con la monta libera si utilizza un maschio
per 3-4 femmine. Con la monta controllata la donatrice riceve almeno 2 salti, a distanza di 12 ore, preferibilmente a
partire dalla 12a ora dopo la comparsa dell’estro. Con la
monta naturale si può ottenere l’80% di fertilizzazione,
ma la fertilità può essere limitata dalla stagione di inattività
o ipoattività riproduttiva.
Con la inseminazione artificiale, la deposizione del seme a livello cervicale, anche con 2-3 inseminazioni per
femmina, determina un basso tasso di fertilizzazione, soprattutto nelle donatrici con elevato tasso di ovulazioni
(>10-12)10, dovuto alla riduzione del trasporto dei nemaspermi attraverso la cervice48. La inseminazione intrauterina per via laparoscopica (48 ore dopo la rimozione del
progestageno) consente di ottenere alti livelli di fertilità e
di ridurre la dose di seme utilizzata (80-100 x 10 6
Spz/femmina) rispetto alla inseminazione cervicale10. Nelle capre, il tasso di fertilizzazione è inferiore a quello riscontrato nelle pecore, soprattutto con elevati tassi di
ovulazione (>1531). Anche in pecore Lacaune con tassi di
ovulazione maggiori di 30 è stato rilevato un calo della
fertilizzazione e della produzione di embrioni
trasferibili31. Con il seme congelato, il tasso di fertilizzazione, anche con la inseminazione intrauterina, è inferiore
rispetto all’impiego del seme fresco, sia nella pecora che
nella capra10,31, soprattutto quando non viene rispettato il
momento ottimale di inseminazione in rapporto all’ovulazione49. Nella capra, è stato rilevato che il momento ottimale di inseminazione è 20-24 ore dopo la comparsa dell’estro148 mentre nella pecora sarebbe 6 ore prima dell’ini-
Large Animals Review, Anno 9, n. 4, Agosto 2003
La razza
Sono state riscontrate differenze nella risposta superovulatoria tra le razze, sia negli ovini6,8,82,144 che nei caprini11,84.
Sussistono razze in cui la raccolta di embrioni può essere effettuata con successo in qualsiasi periodo dell’anno9,28,
mentre in altre i migliori risultati si ottengono durante la
stagione di riproduzione11,53,123,124,133,145.
L’alimentazione
I rapporti tra lo stato nutrizionale dell’animale e la risposta superovulatoria alla iperstimolazione ormonale non
sono ben definiti18,117. La restrizione alimentare può alterare l’accrescimento follicolare nelle pecore superovulate158 e
ridurre il tasso di fertilizzazione degli ovociti75. Gli effetti
della nutrizione, comunque, sembrano esercitarsi ancor
prima della fertilizzazione e dell’ovulazione, cioè durante
l’aquisizione delle competenze dell’ovocita18,90.
Una razione insufficiente può determinare una luteolisi
prematura dei corpi lutei nel 50% delle donatrici superovulate61, che si traduce in una drastica riduzione del tasso
ematico di progesterone20 e della produzione di embrioni.
Altri studi indicano altresì che alti livelli alimentari nelle
pecore donatrici possono determinare una minore produzione di embrioni75, influenzare negativamente lo sviluppo
degli embrioni e la loro sopravvivenza dopo il transfer89,90,
forse a causa di un più rapido metabolismo e clearance del
progesterone.
Tasso di ovulazione e qualità degli embrioni
La qualità degli embrioni rappresenta il fattore più importante per la loro sopravvivenza dopo il trasferimento
nella ricevente.
Nei caprini, è stata rilevata una relazione positiva tra il
tasso di ovulazione della donatrice, la produzione di embrioni e il numero dei nati successivi al trapianto (Tab. 4).
Nella pecora, invece, con l’aumento del tasso di ovulazione è stata osservata una drastica riduzione della fertilizza-
Tabella 4
Influenza del tasso di ovulazione sulle percentuali di donatrici
che producono embrioni e relativi nati da trapianto,
e sulla sopravvivenza embrionale (nati/embrioni trasferiti)
Specie
Classe di
ovulazione
% Donatrici con:
recupero
nati da
embrioni trapianto
Sopravvivenza
Embrionale
%
Capre
1-8
9-16
>16
85,0
85,0
74,3
95,1
93,4
56,1
98,2
96,4
54,9
Pecore
1-8
9-16
>16
82,8
56,5
45,6
91,7
50,0
32,6
38,3
23,1
16,2
Da: Armstrong et al. (1983)
zione e/o un aumento delle perdite embrionali, che si traducono in una minore produzione di nati (Tab. 4). Gli elevati tassi di ovulazione influenzano negativamente il recupero, e quindi la produzione degli embrioni, e la successiva sopravvivenza embrionale37,81,142. Infatti, le pecore con
un tasso di ovulazione >16 danno origine a una minore
produzione di embrioni e di agnelli successivi al transfer
(Tab. 4).
Regressione prematura dei corpi lutei
Nei caprini è stato rilevato che il prelievo degli embrioni
oltre il 5° giorno (giorno 0 = estro) può determinare una
drastica riduzione della raccolta di uova e di embrioni trasferibili, dovuta alla regressione prematura dei corpi
lutei10.
La regressione prematura dei corpi lutei è un fenomeno
frequente nelle capre, sia in condizioni fisiologiche naturali25 che superovulate (27%134; 25-46%38,83,84) e varia con la
razza10,83,84. Il fenomeno è stato riscontrato anche nelle pecore61,81,82. Alla regressione prematura dei corpi lutei viene
associata la riduzione del numero di embrioni raccolti, per
alterazioni del trasporto embrionale negli ovidotti133 e la
scarsa qualità delle ovulazioni, che influenzano negativamente lo sviluppo e quindi la qualità degli embrioni.
CRIOCONSERVAZIONE E QUALITÀ
DEGLI EMBRIONI
La biotecnologia di crioconservazione degli embrioni
consente: il controllo nel tempo e nello spazio del transfer
nella ricevente, la costituzione di banche di embrioni di
elevato valore genetico, la facilità degli scambi commerciali di animali, con riduzione dei rischi di ordine sanitario,
una più accurata valutazione delle risposte alla selezione
rispetto al seme congelato.
Il congelamento convenzionale prevede l’impiego di
crioprotettori (glicerolo, glicole etilenico, dimetilsulfossido, etc.), il confezionamento dell’embrione entro due ore
dalla raccolta in ampolle o in paillettes (0,25 ml), la crioconservazione lenta mediante un congelatore programmabile. Negli ovini il tasso di sopravvivenza embrionale (nati/embrioni trasferiti) varia tra il 13-25%52,56,93,127,131 e il
ALTRE SPECIE
zio delle ovulazioni153. La ridotta sopravvivenza degli spermatozoi congelati impone quindi una maggiore sincronia
delle ovulazioni ai fini della inseminazione artificiale.
Per sincronizzare le ovulazioni multiple si può somministrare Gn-RH a tempi fissi dopo la rimozione del progestageno, sia nella pecora (30-36 ore dopo la rimozione del
progestageno153) che nella capra3. Va sottolineato che in
uno studio condotto negli ovini, il 60% di pecore superovulate trattate con Gn-RH ha evidenziato un secondo picco di ovulazioni 12-24 ore dopo la prima ondata sincrona
di ovulazioni29. Nella capra, l’efficienza dell’impiego di
Gn-RH sulla produzione di embrioni trasferibili è controversa31; un trattamento efficace si è dimostrato la somministrazione di Gn-RH antagonista 12 ore dopo la rimozione
del progestageno, seguito dalla iniezione di 3 mg di LH
porcino 24 ore dopo, e dalla inseminazione artificiale, 16
ore dopo la somministrazione di LH12.
55
56
Embryo Transfer negli ovini e nei caprini - II
58%55,122,137 e risulta inferiore rispetto a quello ottenuto
con il transfer di embrioni freschi. Nei caprini si è rilevato
un tasso di sopravvivenza embrionale del 35-40%27. Con
gli embrioni freschi si ottengono risultati migliori.
Di recente viene utilizzata la metodologia di crioconservazione per vitrificazione, molto rapida e meno costosa, perché non richiede l’impiego di attrezzature programmabili per il congelamento. Essa è basata sull’impiego di soluzioni molto concentrate di crioprotettore che,
durante il rapido calo di temperatura, sono in grado di
costituire una struttura vetrosa. Le paillette contenenti gli
embrioni vengono immerse direttamente in azoto liquido
(-196°C), con un calo di temperatura di 2500°C114. Il passaggio repentino dalla fase liquida a quella vetrosa evita
così la formazione dei cristalli di ghiaccio. L’efficienza
della tecnica varia in rapporto al crioprotettore, alle caratteristiche dell’embrione, al protocollo di vitrificazione63,88.
Il tasso di sopravvivenza degli embrioni di ovino varia tra
il 21%129 e il 49-64%1,13,35,86. Nei caprini, con la vitrificazione è stato riscontrato un tasso di sopravvivenza embrionale pari al 37%146.
Le alterazioni cellulari provocate dal processo di congelamento-scongelamento sembrano essere correlate alle variazioni delle caratteristiche delle membrane cellulari nel
corso dello sviluppo embrionale129, alla dimensione e al
numero di cellule dell’embrione. Ai fini del congelamento
è consigliabile utilizzare embrioni allo stadio di blastocisti
(6,5-7 giorni nella pecora; 7-8 giorni nella capra; giorno 0=
estro10). Il tasso di sopravvivenza degli embrioni congelati
aumenta con la qualità degli embrioni122 e con lo stadio di
sviluppo degli embrioni al momento del congelamento, risultando più elevato per le blastocisti - blastocisti espanse
- blastocisti schiuse (Tab. 5). Anche con la procedura di
crioconservazione per vitrificazione la sopravvivenza embrionale risulta maggiore per gli embrioni di ovino allo
stadio di blastocisti - blastocisti espansa13,104 ed è stata attribuita alle variazioni, durante lo sviluppo embrionale,
della struttura e della permeabilità delle membrane cellulari ai crioprotettori94,129,130.
Va comunque sottolineato che, per motivi sanitari, le
blastocisti schiuse e gli embrioni con la zona pellucida rotta non possono essere utilizzati per il transfer. Per questo,
alcuni AA. negli ovini consigliano la raccolta degli embrioni non oltre il 6° giorno successivo all’estro150.
In generale, anche con la crioconservazione per vitrificazione, risultati migliori si ottengono con il transfer di
embrioni freschi (ovini86,112). In alcuni studi recenti condotti negli ovini, risultano sovrapponibili i tassi di fertilità
(72-73%), e il tasso di sopravvivenza embrionale (nati/embrioni trasferiti) risulta non statisticamente differente per i
due tipi di embrioni (60-64%, per gli embrioni freschi vs
50-57% per i vitrificati13,35).
Di recente è stata studiata una nuova metodica di vitrificazione denominata OPS (open pulled-straw vitrification147), che consiste nel ridurre a metà il diametro della
paillette di contenimento degli embrioni da 0,25 ml, consentendo, per effetto di capillarità, il caricamento degli
embrioni in un volume ridotto di medium di crioconservazione (0,5 µl). Quando la paillette viene immessa rapidamente in azoto liquido (-196°C), il tasso di raffreddamento è di circa 20.000°C/minuto, rispetto ai 2500°C/minuto riscontrabile con il metodo classico di vitrificazione87. La metodica ha fornito risultati promettenti nella pecora41 e nella capra47.
PRODUZIONE IN VITRO E QUALITÀ
DEGLI EMBRIONI
La produzione in vitro rappresenta una fonte a basso
costo degli embrioni, per le ricerche di base e per l’applicazione di biotecnologie commerciali come il trasferimento nucleare e la produzione di animali transgenici. Inoltre,
risponde alle esigenze di una rapida moltiplicazione dei
migliori genotipi. La tecnica completa prevede la maturazione in vitro (IVM) e la fertilizzazione in vitro (IVF) dell’ovocita, e il successivo sviluppo dello zigote in idonei sistemi di coltura (IVC) sino allo stadio di blastocisti, idoneo per il transfer o la crioconservazione.
Negli ovini, è stato riportato che oltre il 57% di ovociti
prelevati con l’ovum pick-up (OPU) si sviluppa in blastocisti, con una produzione media successiva al transfer di
1,5 agnelli nati per pecora sottoposta all’OPU132. Anche il
recupero di ovociti in pecore e capre non stimolate con
trattamenti ormonali sarebbe elevato (4-6 ovociti/seduta
di recupero31).
Da diversi studi è emerso che la maturazione e fertilizzazione in vitro degli ovociti influenza negativamente il
Tabella 5
Percentuale di sopravvivenza degli embrioni (nati/embrioni trasferiti) in relazione allo stadio di sviluppo degli embrioni prodotti in vivo e congelati
Specie
Morula
Giovane blastocisti
Blastocisti
Blastocisti espansa
Blastocisti schiusa
Autore
Pecora
55,2
(29)
10,0
(10)
62,1
(29)
40
(15)
22,9
(9)
Ali e Shelton (1993)
Pecora
8,3
(12)
10,5
(19)
24
(25)
Capra
22
(45)
Capra
20
(10)
( ): Numero di embrioni.
Szell e Windsor (1994)
62
(29)
50
(18)
Chemineau et al. (1986)
67
(66)
Li et al. (1990)
Large Animals Review, Anno 9, n. 4, Agosto 2003
Tabella 6
Tasso di gravidanza e sopravvivenza degli embrioni di ovino
e di caprino prodotti in vitro e crioconservati per vitrificazione
Specie
Ovini
Caprini
Tipo di
embrione
Gravidanze (%):
a 40 d a termine
Sopravvivenza
Embrionale (%)
In vivo
In vitro
70a
32b
70a
15b
49a
9b
In vivo
In vitro
56
50
52
45
37
30
a, b: P<0,05.
Da: Traldi et al. (1998).
IVF + IVC) e vitrificati111. È stato suggerito100 che le cause di questa ridotta sopravvivenza degli embrioni prodotti
in vitro può essere addebitata a un diverso rapporto del
contenuto in lipidi e proteine73,139, alle caratteristiche della zona pellucida, e quindi alla diversità di flusso dei crioprotettori durante la crioconservazione109, al minor numero e alla più ridotta massa delle cellule embrionali60, forse
più sensibili agli effetti del crioprotettore rispetto alle cellule del trofoblasto.
MANAGEMENT DELLA RICEVENTE
Per il successo del transfer embrionale particolare attenzione deve essere rivolta alle caratteristiche della ricevente.
Le riceventi devono essere in buone condizioni fisiche,
con ciclo regolare ed apparato riproduttivo perfettamente
funzionante138,150 e devono essere osservate le condizioni di
management previste per le donatrici.
Come riceventi sono preferibili le nullipare rispetto alle
pluripare, poiché risultano più fertili (+10%)150.
Diversi fattori come lo stress, le malattie, le condizioni
corporee, la nutrizione, le elevate temperature ambientali,
etc., possono pregiudicare la sopravvivenza embrionale.
Condizioni alimentari
Lo stato nutrizionale della ricevente deve essere adeguato, prima e dopo il transfer. Alti livelli di nutrizione nelle
prime fasi della gestazione della pecora possono ridurre la
sopravvivenza embrionale e determinare un calo del tasso
di gravidanza92. La restrizione alimentare riduce la fertilità
successiva al transfer nelle capre76.
Risposta ovulatoria
La risposta ovulatoria della ricevente è importante,
poiché bassi livelli di progesterone o alterazioni del suo
profilo possono causare mortalità degli embrioni. Nei
bovini è stata rilevata una correlazione positiva tra il tasso di progesterone e l’interferone tau embrionale, l’agente antiluteolitico coinvolto negli eventi fisiologici
della sopravvivenza embrionale77. Tervit et al.134 in capre
con una sola ovulazione non hanno riscontrato variazioni nella sopravvivenza embrionale con il trasferimento di
due embrioni, entrambi nel solo corno ipsilaterale all’ovulazione o di un embrione per corno. In molte altre ricerche, condotte nei caprini, è stato invece rilevato che
la sopravvivenza embrionale aumenta con il tasso di
ovulazione della ricevente6,15,154.
Numero di embrioni trasferiti
Nella capra è stato dimostrato che la sopravvivenza embrionale è superiore con il trasferimento di due embrioni
rispetto a uno (Tab. 7).
Negli ovini i risultati sono contrastanti. In diverse ricerche
non è stato riscontrato alcun vantaggio con il trasferimento
nella ricevente di due embrioni rispetto a uno (Tab. 7). Moo-
ALTRE SPECIE
successivo sviluppo dell’embrione e del feto57 e che l’efficienza della tecnica è ancora ridotta. Negli ovini, la coltura in vitro degli zigoti (IVM-IVF) in media riduce la vitalità embrionale del 15-25% e il tasso di agnelli nati da
transfer di morule - blastocisti prodotte in vitro risulta
basso (25-35%57; 49%113). Nei caprini è riportato un tasso
di sopravvivenza di blastocisti prodotte in vitro pari al
61%110. Peraltro, con il transfer di embrioni prodotti in
vitro si è rilevato un prolungamento della durata di gestazione, un aumento del peso alla nascita e della mortalità
perinatale degli agnelli, e la presenza di malformazioni nei
nati113,143,152. Anche nei bovini l’efficienza del sistema di
produzione in vitro degli embrioni risulta insufficiente.
Solo il 20-30% di ovociti si sviluppa in blastocisti141 mentre il tasso medio di sopravvivenza embrionale (% di parti
successivi al transfer di 1 embrione/ ricevente) risulta pari
al 30% ± 10 (DS)108. Anche nei bovini, sono state riscontrate distocie al parto, dovute allo sviluppo abnorme dei
feti ed all’incremento di peso dei vitelli nati da embrioni
prodotti in vitro54,125.
La ridotta efficienza del sistema di produzione in vitro
degli embrioni e le cause delle alterazioni fisiologiche successive al transfer non sono ben definite108,139,151. Negli embrioni prodotti in vitro sono state riscontrate alterazioni a
livello cellulare e sub-cellulare, nel metabolismo, morfologia ed ultrastruttura72,139 e alterazioni nella espressione dei
geni156,157. La sopravvivenza degli embrioni prodotti in vitro sarebbe inferiore del 15% rispetto a quella degli embrioni prodotti in vivo139. Le differenti esigenze degli embrioni in fase di sviluppo hanno portato alla definizione di
medium “sequenziali” per la coltura in vitro, in rapporto
allo stadio di sviluppo dell’embrione140.
Una considerevole preoccupazione è rappresentata dalla minore vitalità degli embrioni prodotti in vitro, susseguente a successive manipolazioni, come la crioconservazione, e i possibili effetti sullo sviluppo embrionale e sulla
fisiologia del feto, che in teoria potrebbero manifestarsi
anche solo nell’animale adulto. Gli embrioni prodotti in
vitro risultano più sensibili alle basse temperature e la sopravvivenza dopo crioconservazione è minore rispetto a
quella degli embrioni prodotti in vivo73,101,139. Traldi et
al.146 riportano una sopravvivenza (nati/embrioni trasferiti) del 30% per gli embrioni caprini e del 9% per gli embrioni ovini, prodotti in vitro, crioconservati per vitrificazione e trasferiti nelle riceventi (Tab. 6). In una ricerca
più recente è riportato un tasso di sopravvivenza del 24%
per gli embrioni di ovino prodotti in vitro (OPU + IVM +
57
58
Embryo Transfer negli ovini e nei caprini - II
Tabella 7
Percentuale di sopravvivenza embrionale (nati/ embrioni trasferiti)
successiva al trasferimento di 1 o 2 embrioni per ricevente
N. Embrioni per ricevente
1
2
Autori
Tabella 8
Effetto dello stadio di sviluppo degli embrioni di ovino sulla
sopravvivenza successiva al trapianto nella ricevente
Stadio
Embrioni trasferiti
N.
Sopravvivenza embrioni
%
Caprini
58,0
70,0
Tervit et al. (1983)
2-4 cellule
0
0
Caprini
51,6
65,2
Armstrong e Evans (1983)
5-8 cellule
26
28,0
Ovini
35,1
31,8
Armstrong e Evans (1983)
9-16 cellule
39
39,8
Ovini
73,0
76,0
McMillan e Hall (1994)
Morula
14
28,6
Blastocisti
7
50,0
Da: Armstrong e Evans (1983)
re95 ha rilevato che il trasferimento nella ricevente di più di
un embrione non influenza il tasso di gravidanza, anzi deprime il tasso di sopravvivenza embrionale, come evidenziato in altre ricerche96,128. Nella pecora Lacaune, invece, è
riportato che l’impianto di due embrioni fornisce migliori
risultati di sopravvivenza embrionale rispetto al trasferimento di un solo embrione per ricevente10.
Sia nei caprini che negli ovini, il trasferimento nella ricevente di tre embrioni rispetto al trapianto di due embrioni per ricevente non determina alcun miglioramento
nella percentuale dei parti e della sopravvivenza embrionale6,10,71,93,134,136.
Sito di trasferimento e stadio di sviluppo
degli embrioni
Tabella 9
Effetto del giorno dell’embryo transfer
(recupero e trasferimento embrionale) sulla produzione
degli embrioni e sulla sopravvivenza embrionale nei caprini (x ± E.S.)
Per gli embrioni di 3-4 giorni (sino allo stadio di 8 cellule) è consigliabile il trasferimento negli ovidotti, attraverso
il padiglione. Oltre lo stadio di 8 cellule, il transfer può essere effettuato in utero, poiché non sono state riscontrate
differenze rispetto al transfer negli ovidotti6,154. Con il trapianto in utero, gli embrioni vengono trasferiti nel terzo
superiore del corno corrispondente all’ovaia con un numero più elevato di corpi lutei, in prossimità della giunzione
utero-tubarica.
Con il trasferimento di due embrioni, uno per ciascun corno, non migliorerebbe la sopravvivenza embrionale10,134.
Nella capra è stato rilevato che, a uno stadio precoce di
sviluppo (2-4 cellule), il trasferimento di due embrioni in
un solo ovidotto (unilaterale) fornisce una maggiore sopravvivenza rispetto al trasferimento bilaterale (1 per ovidotto) (69,8 vs 61,7%6), forse per un più adeguato scambio di “messaggi” tra l’embrione e la ricevente.
Stadio di sviluppo degli embrioni
Negli ovini, la sopravvivenza degli embrioni trasferiti
aumenta con l’avanzare dello stadio di sviluppo (5-8 cellule: 28% vs 50% per le blastocisti, Tab. 86). Nei caprini, invece, la sopravvivenza embrionale può diminuire con il
transfer di embrioni effettuato dopo il 5° giorno (Tab. 9),
per la regressione prematura dei corpi lutei, che condiziona negativamente lo sviluppo embrionale6.
Embrioni
recuperati
Sopravvivenza
embrionale (2)
2-3
8,7 ± 1,4 A
5,1 ± 0,9
4-5
7,0 ± 2,3 A
4,3 ± 1,7
6-8
2,0 ± 1,4 B
1,1 ± 1,0
A, B: P< 0,01
(1)
(2)
Sito di trasferimento
Giorno dell’embryo
transfer (1)
Giorno 0 = estro
Capretti nati da trasferimento embrionale
Da: Armstrong et al. (1983)
SINCRONIZZAZIONE DONATRICE - RICEVENTE
Per la programmazione degli estri delle riceventi, nella
pecora si effettua un trattamento progestativo seguito dalla somministrazione di dosi moderate di PMSG (300-400
UI)5,82, o un trattamento combinato con progestageno (9
d) + PGF2α (7°d) + PMSG (9°d)35. Anche nella capra si
utilizza un trattamento combinato di sincronizzazione degli estri, con progestageno (11d)+ PGF2α(9º d) + PMSG10.
La sopravvivenza embrionale in generale migliora con la
sincronizzazione degli stadi fisiologici della donatrice con la
ricevente, cioè allorquando la comparsa dell’estro della donatrice coincide il più possibile con quella della ricevente.
Sembra che gli embrioni più giovani (2-3 giorni) siano
più sensibili all’asincronia rispetto a quelli di 5-8 giorni;
questi embrioni, di maggiore età, tollerano meglio il trasferimento in un utero che si trova ad uno stadio fisiologico più avanzato.
L’embrione di capra non risente molto del grado di sincronizzazione tra stadio di sviluppo e condizione fisiologica del tratto riproduttivo della ricevente134 e può tollerare
una asincronia di 24 ore tra donatrice e ricevente (Tab.
106,154). L’embrione di ovino è, invece più sensibile, e migliori risultati di fertilità e di sopravvivenza embrionale si
ottengono con una maggiore sincronizzazione estrale (±12
ore) tra donatrice e ricevente96,119.
Large Animals Review, Anno 9, n. 4, Agosto 2003
Tabella 10
Sopravvivenza embrionale nei caprini in rapporto al grado
di sincronizzazione fisiologica tra ricevente e donatrice
59
Tabella 11
Tasso di sopravvivenza embrionale di blastocisti,
raccolte al 7° giorno (giorno 0 = estro)
e crioconservate per vitrificazione
Sincronia ricevente donatrice
Giorni
Embrioni
trasferiti
N.
Sopravvivenza
embrionale
%
-1
31 (16)
48,4 (50,0)
6°
-24
22
16
0
637 (625)
63,9 (60,0)
7°
0
20
16
Età embrione(1)
Giorno
ore
Embrioni trasferiti
N.
Tasso di sopravvivenza
N.
%
72,7
90,0
*
124 (121)
66,6 (57,2)
> +1
9
11,1
Da: Warnes et al. (1982); Armstrong et al. (1983) valori tra parentesi.
Per gli embrioni crioconservati sembra sussistere la necessità di una maggiore sincronia tra l’età dell’embrione e
lo stato del tratto riproduttivo della ricevente. Negli ovini,
una maggiore percentuale di gravidanza con il trasferimento di blastocisti di 7 giorni crioconservate per vitrificazione, è stata riscontrata con donatrici e riceventi aventi la
stessa comparsa dell’estro103 (Tab. 11).
TEMPI OTTIMALI PER IL TRANSFER
Per preservare le caratteristiche qualitative degli embrioni, si suggerisce di effettuare il trapianto entro 20-30
minuti dallo scongelamento, per gli embrioni crioconservati, non oltre le 2 ore dal prelievo, per gli embrioni
freschi.
PRODUTTIVITÀ DI NATI DA EMBRYO TRANSFER
Negli ovini la potenziale produzione di nati per donatrice varia con la razza (5,8: Scottish Black Face; 5,2:
Wels Mountain8; 4,6: Suffolk45). Un adeguato incremento genetico in razze ovine poco prolifiche presuppone
per ciascuna donatrice una potenziale produzione di 7
agnelli/anno8. Nei caprini, il numero di nati per donatrice (riferito a una sola raccolta di embrioni) è di 3 o 4
capretti con il transfer di embrioni congelati o freschi,
rispettivamente21.
8°
+24
22
10
44,0
(1) Da inizio estro
* P< 0,05
Da: Naitana et al. (1995).
La qualità degli embrioni prodotti in vitro è inferiore
a quella degli embrioni prodotti in vivo. La crioconservazione per vitrificazione è rapida, meno costosa e fornisce risultati comparabili alla conservazione con metodo
convenzionale.
Va sottolineato che il costo di un agnello o capretto, nato da embryo transfer, è 10 volte superiore a quello di un
nato da inseminazione artificiale e risulta ancora basso
l’impatto del MOET sull’incremento genetico delle pecore da latte16. Pertanto, il MOET non è in grado di sostituire la inseminazione artificiale, che rimane ancora la tecnologia riproduttiva più utilizzata negli allevamenti ovini
e caprini dei Paesi dove questi assumono una importante
rilevanza produttiva ed economica.
Il MOET potrebbe essere applicato per una scelta oculata delle femmine, per vantaggi produttivi extra genetici,
mediante il trasferimento di embrioni di maschi riproduttori con indici positivi utilizzati per la inseminazione artificiale32,126; rimane comunque una scelta obbligata per il
controllo sanitario negli scambi commerciali del germoplasma animale.
Parole chiave
Trasferimento embrioni, ovini, caprini.
Key words
Sheep, goats, embryo transfer.
CONCLUSIONI
Per il trapianto degli embrioni, la procedura laparoscopica è meno traumatica e più rapida di quella chirurgica.
Nella pecora la procedura di transfer semi-laparoscopica
ha fornito risultati soddisfacenti.
Per il successo della biotecnologia dell’embryo transfer
assumono importanza diversi fattori: la scelta della donatrice e la produzione media di embrioni in vivo; la qualità
degli embrioni prodotti (in vivo, in vitro, crioconservati);
le condizioni di management e fisiologiche della ricevente;
il grado di sincronizzazione tra lo stadio di sviluppo dell’embrione e le condizioni fisiologiche del tratto riproduttivo della ricevente; l’età dell’embrione, il numero di embrioni trasferiti e il sito del transfer.
Bibliografia
1.
2.
3.
4.
5.
6.
Ali Y., Shelton Y. N. (1993) – Successful vitrification of day-6 sheep
embryos. J. Reprod. Fertil., 99, 65-70.
Akbar A. M., Nett T.M., Niswender G.D. (1974) – Metabolic clearance
and secretion rates of gonadotrophins at different stages of the oestrus cycle in ewes. Endocrinology, 94, 1318-1324.
Akinlosotu B.A., Wilder C.D. (1993) – Fertility and blood progesterone
levels following LHRH-induced superovulation in FSH-treated anestrous goats. Theriogenology, 40, 895-904.
Amoah E.A., Gelaye S. (1991) – Embryo recovery, evaluation, storage
and transfer in goats. Small Rum. Res., 6, 119-129.
Armstrong D.T., Evans G. (1983) – Factors influencing success of embryo transfer in sheep and goats. Theriogenology, 19, 31-42.
Armstrong D.T., Pfitzneir A.P., Warnes G.M., Seamark R.M. (1983) –
Superovulation treatments and embryo transfer in Angora goats. J.
Reprod. Fertil., 67, 403-410.
ALTRE SPECIE
+1
60
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
Embryo Transfer negli ovini e nei caprini - II
Bari F., Khalid M., Haresign W., Murray A., Merrell B. (2000) – Effect
of mating system, flushing procedure, progesterone dose and donor
ewe age on the yield and quality of embryos within a MOET program
in sheep. Theriogenology, 53, 727-742.
Bari F., Khalid M., Haresign W., Merrel B., Murray A., Richards R.I.W.
(1999) – An evaluation of the success of MOET in two breeds of hill
sheep maintained under normal system of hill flock management.
Anim. Sci., 69, 367-376.
Baril G., Vallet J.C. (1990) – Time of ovulation in dairy goats induced
to superovulate with porcine follicle stimulating hormone during and
out of the breeding season. Theriogenology, 34, 303-311.
Baril G., Brebion P., Chesne P. (1993) – Manuel de formation pratique
pour la transplantion embryonaire chez la brebis et la chevre. FAO.
1993, 115, ISSN, 1014-1197.
Baril G., Casamitjiana P., Perrin J., Vallet J.C. (1989) – Embryo production, freezing and transfer in Angora, Alpine and Saanen goats. Zuchtygiene, 24, 101-115.
Baril G., Pougnard J.L., Freitas V.J.F., Leboeuf B., Saumande J. (1996)
– A new method for controlling the precise time of occurrence of the
preovulatory gonadotropin surge in superovulated goats. Theriogenology, 45, 697-706.
Baril G., Traldi A-L., Cognié Y., Leboeuf J.F., Mermillod P. (2001) –
Successful direct transfer of vitrified sheep embryos. Theriogenology,
56, 299-305.
Baril G., Remy B., Leboeuf B., Vallet J.C., Beckers J.F., Saumande J.
(1992) – Comparison of porcine FSH, caprine FSH and ovine FSH to
induce repeated superovulation in goats. Proc. 8th Meeting Ass. Eur.
de Trans. Emb. (AETE). Lyon, France, 1, 126.
Baril G., Leboeuf B., Pougnard J.L., Bernelas D., Bonne J.L., Forgerit
Y., Santi E., Beckers J.F. (2000) – Embryo transfer after freezing with
ethylene glycol from Alpine and Saanen dairy goats. 7th International
Conference on Goats, Tours, France, 1030-1031.
Barillet F. (1997) – Genetics of milk production. In: Piper L., Ruvinsky
A. (Eds.). The genetics of sheep. CAB International, Wallingford, UK,
539-564.
Bilton R.J., Moore N.W. (1976) – In vitro culture, storage and transfer
of goat embryos. Aust. J. Biol. Sci., 29, 125-129.
Boland M.P., Lonergan P., O’Callaghan D. (2001) – Effect of nutrition
on endocrine parameters, ovarian physiology, and oocyte and embryo
development. Theriogenology, 55, 1323-1339.
Borghese A., D’Alessandro A.G., Terzano G.M., Ficco G., Beckers J.F.,
Martemucci G. (2003) – Effect of different FSH/LH ratios on superovulatory response and embryo yield in goats. XV Congresso A.S.P.A.,
Parma.
Borque C., Pintado B., Perez B., Gutierrez A., Munoz I., Mateos E.
(1992) – Progesterone levels in superovulation Murciana goats with
or without successfull embryo collection. Theriogenology, 39, 192.
Brebion P., Baril G., Cognié Y., Vallet J.C. (1992) – Transfert d’embryons chez les ovins et les caprins. Ann. Zootech., 41, 331-339.
Brebion P., Vallet S.G., Cognié Y., Layous D., Baril G. (1989) – Ovine
embryo transfer in the Lacaune breed: Efficiency of new laparoscopic
tecnique. Proc. 5th Meeting Ass. Eur. de Trans. Emb. (AETE). Lyon,
France, 1, 134.
Buckrell B.C., Gartley C.J., Buschbeck C., Jordan P., Walton J.W.
(1993) – Evaluation of a transcervical AI technique for transferring
embryos in sheep. Theriogenology, 39, 197.
Caira M., Manchisi A., Gambacorta M., Toteda F., D’Alessandro A.,
Martemucci G. (1992) – Impiego della tecnica laparoscopica e chirurgica nel trapianto di embrioni in pecore di razza Altamurana. Atti 46°
Convegno S.I.S.Vet., 151-154.
Camp J.C., Wild D.E., Howard P.K., Suart L.D., Chakrabortry P.K.
(1983) – Ovarian activity during normal and abnormal length oestrus
cycles in goats. Biol. Reprod., 28, 673-681.
Cappai P., Branca A., Cognié Y. (1984) – Trattamento di superovulazione nella pecora Sarda. Numero di embrioni ottenuti con l’impiego
di estratti ipofisari porcini e di PMSG nella pecora munta una o due
volte al giorno. Atti 38° Convegno S.I.S.Vet., 216-219.
Chemineau P., Baril G., Leboeuf B., Maurel M.C. Cognié Y. (1996) –
Recent advances in the control of goat reproduction. Proc. 6th Intern.
Conference on Goat, 2, 776-784.
Chemineau P., Procureur R., Cognié Y., Lefevre P. C., Locatelli A., Chupin D. (1986) – Production, freezing and transfer of embryos from a
bluetongue-infected goat herd without bluetongue transmission. Theriogenology, 26, 279-290.
Cognié Y. (1999) – State of the art in sheep-goat embryo transfer.
Theriogenology, 51, 105-116.
Cognié Y., Chupin D., Saumande J. (1986) – The effect of modifying
the FSH/LH ratio during the superovulatory treatment in ewes. Theriogenology, 25, 148.
Cognié Y., Baril G., Poulin N., Mermillod P. (2003) – Current status of
embryo technologies in sheep and goats. Theriogenology, 59, 171188.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
47.
48.
49.
50.
51.
52.
53.
54.
55.
Colleau J.J., Heyman Y., Renard J.P. (1998) – Les biotechnologies de
la reproduction chez les bovines et leurs applications réelles ou potentielles en sélection. INRA Prod. Anim., 11, 41-56.
Correa J.E. (1976) – Use of mass laparotomy for an egg transfer technique to the uterus of the ewe. Vet. Rec., 99, 377.
Cseh S., Seregi J. (1993) – Pratical experience with sheep embryo
transfer. Theriogenology, 39, 207.
D’Alessandro A.G., Martemucci G. (2003) – Employ of purified FSH
and LH for embryo production, cryopreservation by conventional or
vitrification and transfer of embryos in dairy ewes. Ital. J. Anim. Sci.
(in press).
D’Alessandro A.G., Colonna M. A., Borghese A., Martemucci G.
(2000) – Produzione in vivo degli embrioni negli ovini e nei caprini
mediante iperstimolazione ovarica con trattamenti farmacologici. In:
“La Riproduzione in zootecnia”, Vol. III - P. F. R.A.I.Z., Mi. P.A.F., Ed.
Enne G. e Rossi G., 137-154.
D’Alessandro A.G., Colonna A.M., Toteda F., Martemucci G. (1996 a) –
Effetto del rapporto FSH/LH nel preparato ipofisario porcino sulla risposta ovarica e sulla produzione di embrioni in pecore da latte. 8°
Meet. Naz. “Studio della efficienza riproduttiva degli animali di interesse
zootecnico”, Bergamo, 99-103.
D’Alessandro A., Martemucci G., Colonna M.A., Manchisi A., Bellitti
E. (1996 b)- Effect of the PMSG addition to P-FSH treatment or PMSG + P-FSH in a combined single injection on ovarian response and
embryo production in goats. VI Int. Conf. on Goats, Beijing, China,
830-833.
D’Alessandro A.G., Martemucci G., Colonna M.A., Cafueri C., Toteda F.
(1997) – Some effects of adding p-LH in defined amounts to purified
p-FSH to modify FSH/LH ratios during the superovulatory treatment
of anoestrus ewes. Anim. Reprod. Sci., 47, 91-98.
D’Alessandro A.G., Martemucci G., Colonna M.A., Borghese A., Terzano M.G., Bellitti A. (2001) – Superovulation in ewes by a single injection of pFSH dissolved in polyvinilpyrrolidone (PVP): effects of PVP
molecular weight, concentration and schedule of treatment. Anim. Reprod. Sci., 65, 255-264.
Dattena M., Isachenko V., Alabart J.L., Folch J., Accardo C., Cappai P.
(2001) – Comparison between two embryo transfer methods of vitrified sheep blastocysts. Proc. 17th Mtg. Ass. Eur. de Trans. Emb. (AETE). Lyon, France, 114.
Dattena M., Vespignani S., Branca A., Gallus M., Ledda S., Naitana S.,
Cappai P. (1994) – Superovulatory response and quality of embryos
recovered from anestrous ewes after a single injection of porcine FSH
dissolved in PVP. Theriogenology, 42, 235-239.
Deguet M., Joisel F., Boender G., Dobbelaere T.H. (1989) – Transplantation embryonnaire dans l’espèce caprine. Application pratiques dans 3 élevages de chèvres Angora. Rec. Med. Vet., 165 (10),
807-813.
Demoustier M.M., Beckers J.F., Van Der Zwalmen P., Closset J., Gillard J.L., Ectors F. (1988) – Determination of porcine plasma follitropin levels during superovulation treatment in cows. Theriogenology,
30, 379-386.
Dingwall W. S., McKelvey W.A.C., Mile Y., Simm G. (1993) – An evaluation of MOET in Suffolk sheep. Anim. Prod., 56, 444 .
Driancourt M.A. (2001) – Regulation of ovarian follicular dynamics in
farm animals. Implications for manipulation of reproduction. Theriogenology, 55, 1211-1239.
El-Gayar M., Holts W. (2001) – Technical note: vitrification of goat by
the open pulled-straw method. J. Anim. Sci., 70, 2436-2438.
Evans G., Armstrong D.T. (1984) – Reduction of sperm transport in
ewes superovulation treatments. J. Reprod. Fertil., 70, 47-53.
Evans G., Jabbour H.N., Moore N.W. (1986) – Time of intrauterine insemination of superovulated ewes using fresh and frozen semen. Aust. Soc. Reprod. Biol., 8th Annual Conf., Brisbane, Australia, 1, 18.
Flores-Foxworth G., McBride B.M., Kraemer D.C., Nuti C.L. (1992) – A
comparison between laparoscopic and transcervical embryo collection and transfer in goats. Theriogenology, 37, 213.
Flores-Foxworth G., Coonrod S.A., Moreno J.F., Byrd S.R., Kraemer
D.C., Westhusin M. (1995) – Interspecific transfer of IVM IVF- derived
red sheep (Ovis orientalis gmelini) embryos to domestic sheep (Ovis
aries). Theriogenology, 44, 681-690.
Fogarty N.M., Maxwell W.M.C., Eppleston J., Evans G. (2000) – The
viability of transferred sheep embryos after long-term cryopreservation. Reprod. Fertil. Dev., 12, 31-37.
Gambacorta M., Toteda F., Manchisi A., Martemucci G., Bellitti E.
(1990) – Influenza della stagione sulla risposta superovulatoria nella
pecora. Agricoltura Ricerca, 114, 27-32.
Hasler J.F., Henderson W.B., Hurtgen P.J., Jin Z.Q., McCauley A.D.,
Mower S.A., Neely B., Shuey L.S., Stokes J.E., Trimmer S.A. (1995) –
Production, freezing and transfer of bovine IVF embryos and subsequent calving results. Theriogenology, 43, 141-152.
Heyman Y., Vincent C., Garnier V., Cognié Y. (1987) – Transfer of frozen-thawed embryos in sheep. Vet. Rec., 120, 83-85.
56.
57.
58.
59.
60.
61.
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
Hinch G.N., Shackell G.H., Thwaites C.J., Thompson J.M. (1998) – Sire and genotype effects on survival of transferred ovine embryos.
Proc. Aust. Soc. Anim. Prod., 22, 237-240.
Holm P., Walker S.K., Seamark R.F. (1996) – Embryo viability, duration of gestation and birth weight in sheep after transfer of in vitro
matured and in vitro fertilized zygotes cultured in vitro or in vivo. J.
Reprod. Fertil., 107, 175-181.
Hunter G. L., Adams C. E., Rowson L. E. (1955) – Inter-breed ovum
transfer in sheep. J. Agric. Sci., 46, 143-149.
Ishwar A.K., Memon M.A. (1996) – Embryo transfer in sheep and
goats: a review. Small Rum. Res., 19, 35-43.
Iwasaki S., Yoshiba N., Ushijma H., Watanab S., Nakahara T.J. (1990)
– Morphology and proportion of inner cell mass of bovine blastocysts
fertilized in vitro and in vivo. J. Reprod. Dev., 90, 279-284.
Jabbour H. N., Ryan J. P., Evans G., Maxwell W.M.C. (1991) – Effects
of season, Gn-RH administration and Lupin supplementation on the
ovarian and endocrine responses of Merinos ewes treated with PMSG
and FSH-P to induce superovulation. Reprod. Fert. Dev., 3, 699-707.
Jacques P., St.Pierre H., Picard L., Allan King W., Chartrain I., Baronet
D. (1989) – La récolte et le transfert d’embryons chez la chévre Angora. Can. Vet. J., 30, 581-584.
Kasai M. (1996) –Simple and efficient methods for vitrification of
mammalian embryos. Anim. Reprod. Sci., 42, 67-75.
Kelly R.W., Lewes R.P., Allison A.J., Paterson A., Howarth M. (1983) –
Techniques to establish flock from fecund ewes by super-ovulation
with or without ova transfer. Proc., N. Z. Soc. Anim. Prod., 43, 205208.
Keskintepe L., Luvoni G.C., Rzucidlo S.J., Brackett B.C. (1996) – Procedural improvements for in vitro production of viable uterine stage
caprine embryos. Small Rum. Res., 20, 247-254.
Kiessling A.A., Houghes W.H., Blankevoort M.R. (1986) – Superovulation and embryo transfer in the dairy goat. J. Am. Vet. Med. Assoc.,
188, 829-832.
Ko J.C.H., Kastelic J.P., Del Campo M.R., Ginther O.J. (1991) – Effects
of a dominant follicle on ovarian follicular dynamics during oestrus
cycle in heifers. J. Reprod. Fertil., 91, 511-519.
Kraemer D.C. (1989) – Embryo collection and transfer in small ruminants. Theriogenology, 31, 141-148.
Kühholzer B., Müller S., Prokofiev M.I., Ernst L.K., Besenfelder U.,
Brem G. (1998) – Laparoscopic techniques for the recovery and transfer of microinjected goat zygotes. Theriogenology, 49, 245.
Ledda S., Naitana S., Loi P., Dattena M., Gallus M., Branca A., Cappai
P. (1995) – Embryo recovery from superovulated mouflons (ovis
gmelini musimon) and viability after transfer into domestic sheep.
Anim. Reprod. Sci., 39; 109-117.
Lee C.S., Fang N.Z., Koo D.B., Lee Y.S., Zheng G.D., Oh K.B., Youn
W.S., Han Y.M., Kim S.J., Lim J.H., Shin S. T., Jin S.W., Lee K. S., Ko
J.H., Koo J.S., Park C.S., Lee K.S., Yoo O.J., Lee K.K. (2000) – Embryo recovery and transfer for the production of transgenic goats
from Korean native strain, Capra hircus aegagrus. Small Rum. Res.,
37, 57-63.
Leese H.J., Donnay I., Thompson J.G. (1998) – Human assisted conception: a cautionary tale. Lessons from Domestic Animals. Hum. Reprod., 13 (suppl. 4), 184-202.
Leibo SP., Loskutoff NM. (1993) – Cryobiology of in vitro derived bovine embryos. Theriogenology, 39, 81-94.
Li R., Cameron A. W. N., Batt P. A., Trounson A. O. (1990) – Maximum
survival of frozen goat embryos is attained at the expanded, hatching
and hatched blastocyst stages of development. Reprod. Fertil. Dev, 2,
345-350.
Lozano J.M., Boland M.P., O’Callaghan D. (2000) – Effect of nutrition
on embryo development in ewes. Proc. Intern. Congr. Anim. Reprod.
Stockholm, 1, 279.
Mani A.U., Watson E.D., McKelvey W.A.C. (1994) – The effects of subnutrition before or after embryo transfer on pregnancy rate and embryo survival in does. Theriogenology 41, 1673-1678.
Mann G.E., Lamming G.E., Fisher P.A. (1996) – The inter-relationship
between maternal hormone environment and the embryo during early
stages of pregnancy. J. Reprod. Fertil., Abstr. Ser. 21:37.
Martemucci G., D’Alessandro A.G., Colonna M.A. (1998) – Superovulazione e produzione degli embrioni negli ovini. Agricoltura Ricerca,
179, 61-74.
Martemucci G., D’Alessandro A.G., Crovace A., Nardi A. (2003) – Embryo transfer negli ovini e nei caprini. I. Tecniche di prelievo degli embrioni. Large Anim. Review, …-….
Martemucci G., Gambacorta M., Toteda F., Manchisi A., Bellitti E.
(1987) – Influenza della secrezione lattea nella pecora sulla risposta
alla superovulazione con PMSG. Terra Pugliese, 36, 3-11.
Martemucci G., Gambacorta M., Toteda F., Manchisi A., Bellitti E.
(1988 a) - Induzione della superovulazione nella pecora con PMSG,
FSH-P, hMG, per il trapianto di embrioni. Zoot. Nutr. Anim., 15, 379386.
82.
83.
84.
85.
86.
87.
88.
89.
90.
91.
92.
93.
94.
95.
96.
97.
98.
99.
100.
101.
102.
103.
104.
61
Martemucci G., Toteda F., Manchisi A., Lacalandra G.M., Bellitti E.
(1988 b) – Risposta al trattamento di superovulazione con PMSG in
pecore di razza Gentile di Puglia e Altamurana. Fecondità successiva a
trapianto di embrioni. Zoot. Nutr. Anim., 14, 165-172.
Martemucci G., D’Alessandro A.G., Colonna M. A., Cafeuri C., Casamassima D. (1996) – Effect of the FSH/LH ratio of purified P-FSH on
superovulation and embryo production in goats. Proc. VI Int. Conf. on
Goats, Beijng, China, 834-837.
Martemucci G., D’Alessandro A.G., Gambacorta M., Toteda F., Bellitti
E. (1992) – Superovulation response of FSH-P to different treatments
in donor goats. Proc. V Intern. Conference on Goat, New Delhy, 13281335.
Martemucci G., D’Alessandro A.G., Cognié Y., Beckers J.F., Neri M.G.,
Nardi A. (2001) – Potential use of Gn-RH antagonist (Antarelix) as
strategy to improve ovarian stimulation with purified gonadotrophins
in dairy ewes. XIV Congr. Naz. A.S.P.A., 606-608.
Martinez A.G., Matkovic M. (1998) – Cryopreservation of ovine embryos: slow freezing and vitrification. Theriogenology, 49, 1039-1049.
Massip A. (2000) – Cryopreservation of embryos of farm animals.
Proc. 7th Intern. Conference on Goats, Tours, France, 1030.
Massip A., Van der Zwalmen P., Sheffen B., Ectors F. (1989) – Some
significant steps in the cryopreservation of mammalian embryos with
a note on a vitrification procedure. Anim. Reprod. Sci., 19, 117-129.
McEvoy T.G., Robinson J.J., Aitken R.P., Kyle C.E., Roberston I.S.
(1993) – The effect of feeding level during a 12-day progesterone-priming period on the viability of embryos collected from superovulated
ewes. Anim. Prod. 56, 432.
McEvoy T.G., Robinson J.J., Aitken R.P., Findlay P.A., Palmer R.M.,
Roberston I.S. (1995) – Dietary-induced suppression of pre-ovulatory
progesterone concentrations in superovulated ewes impairs the subsequent in vivo and in vitro development of their ova. Anim. Reprod.
Sci., 39, 89-107.
McKelvey W.A.C., Bhattacharrya N.K. (1992) – Embryo – Biothecnology in goats. Proc, 5th Int. Cong. On Goat, New Delhi, 51-70.
McKelvey W.A.C., Robinson J.J., Aitken R.P. (1988) – The use of reciprocal embryo transfer to separate the effects of pre-and post-mating
nutrition on embryo survival and growth of the ovine conceptus. Proc.
11th Int. Cong. Reprod. and A.I., Dublin, 17.
McMillan W.H., Hall D.R.H. (1994) – Laparoscopic transfer of ovine
and cervine embryos using the transpic technique. Theriogenology,
42, 137-146.
Miyake T., Kasai M., Zhu S.E., Sakurai T., Machida T. (1992) – Vitrification of mouse oocytes and embryos at various stage of development in an ethylene glycol-based solution by a simple method. Theriogenology, 40, 121-134.
Moore N.W. (1968) – The survival and development of fertilized eggs
transferred between Border Leicester and Merinos. Aust. J. Agric.
Res., 19, 295-302.
Moore N.W., Shelton J.N. (1962) – The application of the technique of
embryo transfer to sheep breeding. Aust. J. Agric. Res., 13, 718-724.
Moore N.W., Shelton S.N. (1964) – Egg transfer in sheep: effect of degree of synchronization between donor and recipient, age of egg and
site of transfer on the survival of transferred eggs. J. Reprod. Fert., 7,
145-152.
Mukherjee T.K., Horst P., Mathur P.K. (1996) – Current status and future perspectives of genetic improvement of goats in Asia. VI Int.
Cong. on Goat, Beijng, China, 110-118.
Naitana S., Cappai P. (1988) – Incremento dell’efficienza riproduttiva degli ovini e dei caprini. 1° Meeting Naz. “Studio della efficienza riproduttiva degli animali di interesse zootecnico”, Bergamo,
23-35.
Naitana S., Ledda S., Leoni G., Bogliolo L. (2000) – Vitrificazione degli embrioni nei piccoli ruminanti: risultati e prospettive. In: “La Riproduzione in zootecnia”, Vol. III - P. F. R.A.I.Z., Mi. P.A.F., Ed. Enne
G. e Rossi G., 155-163.
Naitana S., Ledda S., Loi P., Cappai P. (1994) – Le nuove tecnologie
riproduttive per la tutela del muflone sardo/corso. Atti 2° Conf. Naz.
Su: “Stato dell’arte delle ricerche Italiane nel settore delle biotecnologie applicate alle scienze veterinarie e zootecniche”, Milano, 163168.
Naitana S., Ledda S., Sini A., Loi P., Dattena M., Cappai P. (1994) –
Development potential of in vivo and in vitro produced ovine embryos
after vitrification. Proceeding of First Integrated European Conference
on “Progress in Embryo Technology and Genetic Engineering in Cattle
and Sheep Breeding”, 244-245.
Naitana S., Dattena M., Gallus M., Loi P., Branca A., Ledda S., Cappai
P. (1995) – Recipient synchronization affects viability of vitrified ovine
blastocysts. Theriogenology, 43, 1371-1378.
Naitana S., Ledda S., Loi P., Leoni G., Bogliolo L., Dattena M., Cappai
P. (1997) – Polyvinil alchol as a defined substitute for serum in vitrifications solutions to cryopreserve ovine embryos at different stages of
development. Anim. Reprod. Sci., 48, 247-256.
ALTRE SPECIE
Large Animals Review, Anno 9, n. 4, Agosto 2003
62
Embryo Transfer negli ovini e nei caprini - II
105. Nellenschulte E., Niemann H. (1992) – Collection and transfer of ovine
embryos by laparoscopy. Anim. Reprod. Sci., 27, 293 - 304.
106. Nowshari M.A., Beckers J.F., Holtz W. (1995) – Superovulation of
goats with purified pFSH supplemented with defined amounts of pLH.
Theriogenology, 43, 797-802.
107. O’Brien J.K., Catt S. L., Ireland K.A., Maxwell W.M.C., Evans G. (1997)
– In vitro and in vivo developmental capacity of oocytes from prepubertal and adult sheep. Theriogenology, 47, 1433-1443.
108. Peterson A.J., Lee R.S-F. (2003) – Improving successful pregnancies
after embryo transfer. Theriogenology, 59, 687-697.
109. Pollard J.W., Leibo S.P. (1993) – Comparative cryobiology of in vitro
and in vivo derived bovine embryos. Theriogenology, 39, 287.
110. Poulin N., Guler A., Pignon P., Cognié Y. (1996) – In vitro production
of goat embryos: heparin in IVF medium affects developmental ability.
Proc. 6th Int. Conf. On Goats, Bejing, 2, 838-840.
111. Ptak G., Loi P., Dattena M., Tischner M., Cappai P. (1999 a) – Offspring from 1-month-old lambs: studies on the developmental capability of prepubertal oocytes. Biol. Reprod., 61, 1568-1574.
112. Ptak G., Loi P., Dattena M., Tischner M., Cappai P. (1999 b) – Ovum
pick-up in sheep: efficiency of in vitro embryo production, vitrification
and birth of offspring. Theriogenology, 52, 1105-1114.
113. Ptak G., Loi P., Dattena M., Tischner M., Cappai P. (2000) – Follow-up
of lambing after transfer of in vitro-produced embryos. Theriogenology, 53, 316 .
114. Rall W.F. (1987) – Factors affecting the survival of mouse embryos
preserved by vitrification. Criobiology, 24, 387-402.
115. Remy B., Baril G., Vallet J.C., Dufour R., Chouvet C., Saumande J.,
Chupin D., Beckers J.F., Are antibodies responsible for a decreased
superovulatory response in goat which have been treated repeatedly
with pFSH? Theriogenology, 36, 389-399.
116. Riera G.S. (1984) – Some similarities and differences in female sheep
and goat reproduction. 10th Intern. Cong. on Anim. Reprod. and Artif.
Insem., Urbana-Champaign, USA, IV, VII-1 - VII-7.
117. Robinson J.J. (1996) – Nutrition and reproduction. Anim. Reprod.
Sci., 42, 25-34.
118. Roy F., Maurel M.C., Combes B., Vaiman D, Cribiu E.P., Lantier I., Pobel T., Deletang F., Combarnous Y., Guillou F. (1999) – The negative
effect of repeated equine chorionic gonadotropin treatment on subsequent fertility in goats is due to a humoral response involving the
major histocompatibility complex. Biol. Reprod., 60, 805-813.
119. Rowson L.E.A., Moor R.M. (1966) - Embryo transfer in sheep: the significance of synchronizing oestrus in the donor and recipient animal.
J. Reprod. Fert., 11, 207-212.
120. Rubianes E., Ibarra D., Ungerfeld R., Carbajal B., De Castro T. (1995)
– Superovulatory response in anestrous ewes is affected by the presence of a large follicle. Theriogenology, 43, 465-472.
121. Ryan J.P., Hunton J.R., Maxwell W.M.C. (1991) – Increased production of sheep embryos following superovulation of Merino ewes with
a combination of PMSG and FSH-P. Reprod. Fert. Dev., 3, 551-560.
122. Sakul H., Bradford G.E., BonDurant R.H., Anderson G.B., Donahue
S.E. (1993) – Cryopreservation of embryos as a means of germ plasm
conservation in sheep. Theriogenology, 39, 401-409.
123. Samartzi F., Boscos C., Vainas E., Tsakalof P. (1995) – Superovulatory
response of Chios sheep to PMSG during spring and autumn. Anim.
Reprod. Sci., 39, 215-222.
124. Senn B.J., Richardson M.E. (1992) – Seasonal effects on caprine response to synchronization of estrus and superovulatory treatment.
Theriogenology, 37, 579- 685.
125. Sinclair K.D., Broadbent P.J., Dolman (1995) – In vitro-produced-embryos as a means of achieving pregnancy and improving productivity
in beef cattle. Anim. Sci., 60, 55-64.
126. Smith C. (1986) – Use of embryo transfer in improvement in sheep.
Anim. Prod., 42, 81-88.
127. Songsasen N., Buckrell B.C., Plante C., Leibo S.P. (1995) – In vitro
and in vivo survival of cryopreserved sheep embryos. Cryobiology,
32, 78-91.
128. Stefani J.S., Palho M.D.C., Christmann L., Rosa J.M., Silveria M.C.,
Rodriguez Y.L. (1990) – Laparoscopic versus surgical transfer of ovine embryos. Theriogenology, 33, 320.
129. Szell A., Windsor D.P. (1994) – Survival of vitrified sheep embryos in
vitro and in vivo. Theriogenology, 42, 881-889.
130. Szell A., Shelton J.N., Szell K. (1989) – Osmotic characteristics of
sheep and cattle embryos. Criobiology, 26, 297-301.
131. Tervit H.R. (1984) – Techniques for importing new genotypes. N.Z.
Agric. Sci., 18, 24-27.
132. Tervit H.R. (1996) – Laparoscopy/laparotomy oocyte recovery and juvenile breeding. Anim. Reprod. Sci, 42, 227-238.
133. Tervit H. R. (1987) – Factors affecting the success of goat embryo
transfer. Proc. 4th. AAAP Anim. Sci. Congr., 262-266.
134. Tervit H.R., Goold P.G., McKenzie R.D. (1986 a) – Development of an effective goat embryo transfer regime. Proc. N. Z. Soc. Anim. Prod., 46,
233-236.
135. Tervit H.R., Goold P.G., McKenzie R.D., Clarkson D.J. (1983) – Techniques and success of embryo transfer in Angora goats. N. Z. Vet.
Journ., 31, 67-70.
136. Tervit H.R., Goold P.G., McKenzie R.D., Clarkson D.J., Drummonds J.
(1984) – Embryo transfer in Angora and Saanen goats. N. Z. Vet.
Journ., 33, 78-80.
137. Tervit H.R., Baker R.L., Hoff-Jorgenson R., Lintukangas S., MacDiarmid S.C., Rainio V. (1986 b) – Viability of frozen sheep embryos and
semen imported from Europe. Proc. N. Z. Soc. Anim. Prod., 46, 245250.
138. Thibier M., Nibart M. (1992) – Clinical aspects of embryo transfer in
some domestic farm animals. Anim. Reprod. Sci., 28, 139-148.
139. Thompson G.J. (1997) – Comparison between in vivo derived and in
vitro produced preelongation embryos from domestic ruminants. Reprod. Fertil Dev. 9, 341-354.
140. Thompson J.G. (2000) – In vitro culture and embryo metabolism of
cattle and sheep embryos – a decade of achievement. Anim. Reprod.
Sci., 60-61, 263-275.
141. Thompson J.F., Duganzich D. (1996) – Analysis of culture systems for
bovine in vitro embryo production reported in abstracts of the Proceedings of the International Embryo Transfer Society (1991 – 1995).
Theriogenology, 45, 195.
142. Thompson J.G., Bell A.C.S., McMillan W.H., Peterson A.J., Tervit H.R.
(1995 a) – Donor and recipient ewe factors affecting in vitro development and post-transfer survival of cultured sheep embryos. Anim. Reprod. Sci., 40, 269-279.
143. Thompson G.J., Gardner K.D., Pugh P.A., McMillan W.H., Tervit H.R.
(1995 b) – Lamb birth weight is affected by culture system utilized
during in vitro pre-elongation development of Ovine Embryos. Biol.
Reprod., 53; 1385-1391.
144. Torrès S., Cognié Y. Colas G. (1987) – Transfer of superovulated
sheep embryos obtained with different FSH-P. Theriogenology, 27,
407-418.
145. Toteda F., D’Alessandro A.G., Colonna M.A., Bellitti E., Martemucci G.
(1996) – Influenza della stagione sulla risposta ovulatoria e sulla produzione di embrioni in pecore superovulate con un preparato ipofisario porcino con attività FSH/LH definita. Archiv. Vet. Ital., 46, 260-266.
146. Traldi A.L., Leboeuf B., Baril G., Cognié Y., Poulin N., Evans G., Mermillod P. (1998). Comparative results after transfer of vitrifies in vitro
produced goat and sheep embryos, Proc. 14th Meeting Ass. Eur. de
Trans. Emb. (A.E.T.E.), Lyon, France, 258.
147. Vajta G., Booth P.J., Holm P., Greve T., Callesen H. (1997) – Successful vitrification of early stage bovine in vitro produced embryos with
the open pulled straw (OPS) method. Cryo-Letters, 18, 191-195.
148. Vallet J.C., Baril G. (1990) – Effect of time of laparoscopic intrauterine
insemination in superovulated dairy goats. Proc. 6th Meeting Ass.
Eur. de Trans. Emb. (AETE). Lion, France, 1, 188.
149. Vallet J.C., Baril G., Loisel C. (1989) – Efficiency of laparoscopic embryo transfer in goats. Proc. 5th Meeting Ass. Eur. de Trans. Emb.
(A.E.T.E.). Lyon, France, 1, 60.
150. Vallet J.C., Casamitjana P., Brebion P., Perrin J. (1991) – Techniques
de production, de conservation et de transfert d’embryons chez les
petits ruminants. Rec. Med Vet., 167, 293-301.
151. Walker S.K., Hartwich K.M., Seamark R.F. (1996) – The production of
unusually large offspring following embryo manipulation: concepts
and challanges. Theriogenology, 45, 111-120.
152. Walker S.K., Heard T.M., Seamark R.F. (1992) – In vitro culture of
sheep embryos without co-culture: success and perspectives. Theriogenology, 37, 111-126.
153. Walker S.K., Smith D.H., Frensham A., Ashman R.J., Seamark R.F.
(1989) – The use of synthetic GnRH treatment in the collection of
sheep embryos. Theriogenology, 31, 741-752.
154. Warnes G.M., Pfitzneir A.P., Armstrong D.T. (1982). Embryo transfer
procedures in the goat: factor which have a major influence on success rate. Proc. Symp. Embryo transfer in cattle, sheep and goats.
Canberra, Australia, Aust. Soc. Reprod. Biol., 44-46.
155. Warwick B.L., Berry R. O., Horlacher W. R. (1934) – Results of mating
rams to Angora female goats. Proc. 27th Ann. Meet. Am. Soc. Anim.
Prod., 227.
156. Wrenzycki C., Herrman D., Carnwarth J.W., Niemann H. (1996) – Expression of the gap junction gene connexin43 (C x 43) in preimplantation bovine embryos derived in vitro or in vivo. J. Reprod. Fertil., 108,
17-24.
157. Wrenzycki C., Herrman D., Carnwarth J.W., Niemann H. (1999) – Alterations in the relative abundance of gene transcripts in preimplantation bovine embryos cultured in medium supplemented with either
serum or PVA. Mol. Reprod. Dev., 53, 8-18.
158. Yaakub H., O’Callaghan D., O’Doherty J.V., Hyttel P. (1997) – Effect of
dietary intake on follicle numbers and oocyte morphology in unsuperovulated and superovulated ewes Theriogenology, 47, 182 .
159. Younis A.I., Zuelke K.A., Harper K.M., Oliveira M.A.L., Brackett B.G. (1991)
– In vitro fertilization of goat oocytes. Biol. Reprod. 44, 1177-1182.