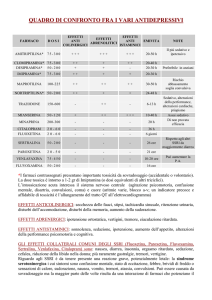
TRATTAMENTO CON SSRI DEI DISTURBI D’ ANSIA E DELL’ UMORE IN
GRAVIDANZA E DURANTE L’ALLATTAMENTO
La gestione medica di una qualunque situazione clinica che emerga nella donna in gravidanza
necessita sempre dell’esigenza di bilanciare attentamente i rischi connessi alla patologia con i
benefici attesi da un trattamento specifico. Non sempre però il rapporto rischio/beneficio è
attentamente valutato nelle varie patologie che possono affliggere una paziente in dolce attesa. Ad
es. spesso vengono concessi dai medici curanti farmaci non sicuri per il trattamento di patologie
minori come cefalea, nausea,insonnia e le infezioni localizzate. Al contrario le donne con una
patologia psichiatrica vengono spesso incoraggiate dai medici di medicina generale,dalle ostetriche,
dagli psichiatri e dai familiari a sospendere i trattamenti psicofarmacologici in atto. L’intenzione di
tali raccomandazioni è lodevole ma purtroppo sono fatte sulla base di conoscenze limitate dei
potenziali effetti avversi delle patologie psichiatriche materne e sono spesso frutto di pregiudizi.
Infatti anche la patologia depressiva in gravidanza può essere causa di problematiche gestionali che
evidentemente non possono essere trascurate.
Ad esempio la depressione materna può rallentare la crescita fetale,determinare una circonferenza
cranica inferiore,aumentare il rischio di parto prematuro e di altre complicanze ostetriche. La
depressione materna ha correlati neurobiologici che si riflettono sul feto,come verrà
successivamente illustrato. Tra l’altro l’insorgenza di patologie ansioso-depressive non è
infrequente: gli studi riportano nelle donne gravide un tasso di prevalenza complessivo del 14,1%
per i disturbi affettivi e del 6,6 % per i disturbi d’ansia.( Anderson et al.2003).
TERATOGENESI nella generalità delle gravidanze
La prevalenza per le malformazioni maggiori nella generalità delle gravidanze viene stimata tra il 24% ma può arrivare fino al 12% per quelle minori. La maggior parte delle malformazioni più gravi
si verifica durante il periodo embrionale (dalla terza all’ottava settimana di gestazione ) perchè la
maggior parte degli organi si sviluppa entro l’undicesima settimana di gestazione. Fanno eccezione
il SNC, gli occhi, i denti, le orecchie e i genitali esterni.
Per una miglior comprensione dei danni al Sistema Nervoso Centrale abbiamo qui trascritto una
BREVE REVISIONE del normale sviluppo prenatale.
MICROSVILUPPO
Le varie regioni neuroanatomiche e i sistemi neurotrasmettitoriali si sviluppano in differenti tappe
e tempi (Teicher e Baldessarini 1987). Lo sviluppo neurale si può tracciare attraverso 4 principali
tappe.
1) nascita delle cellule o neurogenesi.
2) Migrazione cellulare.
3) Formazione di connessioni (elaborazione di processi, formazione di sinapsi, morte di alcune
cellule, apoptosi, regressione neuronale.
4) Mielinizzazione ( Insel, 1995)
PLASTICITA’ E PERIODI SENSIBILI
La complementarietà dei concetti di plasticità neuronale e periodi sensibili è fondamentale per la
comprensione di molti aspetti dello sviluppo cerebrale.
La plasticità si può definire come la capacità del cervello di modificarsi da solo in presenza di
stimoli ambientali o chimici durante i periodi sensibili e l’abilità di compensare danni corticali,
tramite una riconnessione ipsilaterale o controlaterale. Nella maggioranza degli animali immaturi
studiati è stata rilevata la capacità di sopportare danni ad ampie aree corticali e manifestare
minimi deficit. Questo fenomeno è da attribuire al potenziale riorganizzativo del cervello in via
di sviluppo ed è conosciuto come effetto Kennard. Nel cervello dei mammiferi, a causa della
connessione interemisferica si possono ristabilire collegamenti tra aree corticali. Il grado di
compensazione dipende da a) età dell’organismo:più immaturo è,
più sono alte le possibilità di compensazione. b) dalla posizione della lesione c) dal periodo
sensibile,per specifiche patologie, in cui accade il danno.
APOPTOSI
Alcuni degli eventi intracellulari dei neuroni sono geneticamente programmati alla
sopravvivenza o alla morte. Tale processo delle cellule di vivere o morire può essere indicato
come apoptosi. Questo evento è una normale funzione dello sviluppo cellulare che può
autodistruggersi per ottenere una migliore omeostasi del sistema. Jacobsen et.altri hanno
individuato diverse funzioni dell’apoptosi come sviluppare una struttura funzionalmente
necessaria, disattivare una funzione inutile, controllo del numero delle cellule, eliminare cellule
anomale o dannose, produrre cellule differenziate.
MIGRAZIONE CELLULARE E SVILUPPO
La migrazione cellulare, la crescita degli assoni e la formazione di una patologia neuronale sono
sotto il controllo genetico.( Morlak.95 ) I neuroni hanno bisogno di trovare la loro destinazione
precisa nella corteccia. Questo avviene tramite un’impalcatura di cellule gliali radiali che si
estendono fino alle Pie e alle superfici ventricolari. E’ stato ipotizzato che la migrazione
neuronale lungo l’impalcatura gliale costituisca lo sviluppo di base nei vertebrati. Il processo
descritto è influenzato positivamente dal fattore di crescita nervoso.
NEUROTRASMISSIONE
Le catecolamine appaiono nell’embrione di 5 settimane ( Zecevic e Verney,1995 ). Nella
corteccia le fibre serotoninergiche sono le prime vie afferenti ad arrivare e le ultime a stabilire il
loro definitivo assetto d’innervazione.( Lindow e Molliver,1982 ). Questi dati rivelano la grande
importanza assunta dalla serotonina come sistema guida per lo sviluppo del cervello; per esempio
lo sviluppo dei neuroni dopaminergici mesencefalici è influenzato dalla serotonina, lo stesso vale
per altri neuroni monoaminergici.
RECETTORI
I recettori sviluppano le loro differenti funzioni secondo la maturazione dell’organismo.
Whitaken-Azmitia,(1991) hanno proposto 2 categorie o ruoli dei recettori:1) recettori di
programmazione che necessitano di appropriate stimolazioni per sviluppare le loro funzioni.
2) recettori transitori che svolgono, durante lo sviluppo, la funzione di altri tipi di recettori che
non si sono ancora formati,.( Nosin e Thomas ). Insel (95 ) parla di recettori in sviluppo
transitori.
E’ stato evidenziato che il tipo di legame è diverso e transitorio a seconda delle regioni cerebrali,
dalla prima alla terza settimana post-natale. Il legame del recettore può essere indipendente dal
tipo d’innervazione. L’espressione del legame precede la coppia recettore-effettore (secondo
messaggero ).
Whitaker et Azmitia nel 1991 hanno evidenziato, nel feto di ratto e nei suoi primi giorni di vita,
alti quantitativi di recettori serotoninergici che decrescono durante la vita adulta. Occorre un
grande numero di recettori nel cervello in sviluppo anche se non sono presenti le specifiche
sinapsi. Nel neurone serotoninergico il recettore 5ht1c può regolare la divisione delle cellule
mentre il 5ht1a ne può regolare la differenziazione.( Whitaker et Azmitia 1991).Il recettore 5ht1a
e i suoi sottotipi hanno un ruolo chiave nella crescita dei neuroni, della glia e dei fattori di
crescita neuronali. I farmaci che agiscono come agonisti del recettore 5ht1a promuovono la
maturazione delle cellule astrogliali, impalcatura necessaria per la migrazione neuronale. Anche
il recettore 5ht2 mostra alti livelli prenatali, dal17 giorno prenatale al 13 giorno post-natale,
successivamente decresce fino al 27 giorno post-natale stabilizzandosi sui livelli adulti. Questo
schema corrisponde all’innervazione della corteccia che cresce fino al 14 giorno post-natale
effettuando la potatura neuronale verso il 27 giorno.
Da questa veloce ricognizione sul neurosviluppo, emerge la grande importanza del sistema
serotoninergico nel periodo fetale. Se la madre presenta un grave deficit di funzionamento in tale
sistema ( disturbi depressivi e/ o ansiosi), la domanda inevitabile è: cosa può accadere allo
sviluppo del sistema nervoso del feto?
CONSEGUENZE NEUROBIOLOGICHE della depressione materna sul feto
EFFETTI DELLO STRSS; ESPERIENZE PRECOCI E NEUROGENESI
Gli effetti dello stress ambientale precoce sono rilevanti sullo sviluppo dei neurotrasmettitori del
SNC, sugli ormoni e sulle strutture anatomiche. Esiste un notevole impatto dello stress precoce
attraverso il CRF ipotalamico, ACTH e cortisolo sul sistema libico. Gli adulti che hanno subito
una precoce, severa e prolungata esperienza negativa da bambini sono più predisposti, da adulti, a
disturbi d’ansia e dell’umore. Lo stress acuto e cronico aumenta la concentrazione del CRF in
molte aree cerebrali come l’amigdala e il locus coeruleus. Alti livelli degli ormoni dello stress
come il CRF e i glucocorticoidi si sono rivelati tossici per lo sviluppo cerebrale. Balazs e
Cotterrell.1972 hanno trovato un ridotto numero di neuroni. L’esposizione allo stress nell’utero è
stata associata ad un ridotto numero di cellule piramidali e diramazioni dendritiche
nell’ippocampo ( Uno et al.1990). Sempre nell’ippocampo si assiste ad un’anomala potatura
neuronale, rispetto all’età; ciò comporta una riduzione dell’apprendimento, del comportamento di
evitamento dei pericoli. ( De Kloe et al, 1988 ) L’esposizione agli ormoni dello stress agisce
negativamente sulle cellule non neurali come astroglia ( Scheff et al, 1986 ) e macroglia, (Vijayan
et Cotman 1997 ) danneggiando il tessuto cerebrale.
L’esposizione prenatale allo stress appare essere associata ad una interferenza nella maturazione
dei neuroni e ad una risposta abnorme agli stimoli negativi, durante la vita adulta. Nel 1949 Hebb
fù il primo a suggerire che l’ influenza dell’ambiente sui disturbi mentali “può essere una
funzione dell’esperienza e della costituzione che si influenzano reciprocamente”. Ipotizzò che la
costituzione vulnerabile era collegata allo stress durante il periodo pre, o, postnatale e ad
alterazioni in zone chiave come il circuito cortico-limbico.
A tutt’oggi non è stato dimostrato chiaramente che lo stress gestazionale sia correlato all’esordio
di disturbi psichici nell’infanzia e nella vita adulta, a causa della difficoltà nel condurre studi
sull’uomo. Negli animali molti autori hanno dimostrato tale correlazione. (Weinstock, 2001) e
sembra ragionevole ipotizzarlo pure nell’uomo.
TRATTAMENTO DEI DISTURBI DEPRESSIVI E D’ANSIA CON SSRI
Revisione della letteratura
Premettiamo che è stato calcolato che solo il 35% di tali disturbi viene trattato e che quindi, anche
nelle gestanti, esiste un ampia popolazione di pazienti nelle quali viene sottovalutata la
sintomatologia depressiva.
Nella revisione della letteratura più recente verranno valutati gli aspetti di teratogenesi, le
conseguenze sul feto, sul neonato e sul suo sviluppo neuro-comportamentale durante la crescita
Nel Marzo 2006 la casa farmaceutica produttrice della paroxetina comunica che l’uso di tale
sostanza nel primo trimestre di gravidanza è stato associato all’insorgenza di malformazioni
cardiache fetali nella percentuale pari al 4 e 2 %. La maggior parte delle malformazioni era
rappresentata da difetti del setto interventricolare.
Chambers CD, Hernandeez.-S, et al pubblicano sul New Engl J Med 2006; 354 (6) 579-587 che
il trattamento in gravidanza con SSRI induce il rischio nel neonato di una persistente
ipertensione polmonare in un 1 caso su 1000.
Un importante studio canadese è stato condotto per la FDA sull’uso degli SSRI e altri
antidepressivi in gravidanza e potenziali effetti avversi sul neonato ( Einarson A, Bollano E,
Koreng, Schachtschneider AK, Halil R.) BMC Pregnancy and Chilbirth 20 /05 / 2005.
Le conclusioni dedotte dallo studio sono:
1) L’esposizione al trattamento non è dannosa né per la madre né per il bambino.
2) Viceversa il NON trattamento dei disturbi depressivi ed ansiosi è associato ad eventi avversi
sia per la madre che per il neonato. Per la madre il rischio principale è quello di sviluppare una
depressione post-partum, per il bambino manifestare un comportamento simil-depressivo:
dimostrato dalla diminuzione delle espressioni facciali, minore capacità di
orientamento,eccitabilità e riflessi abnormi.
3) Il trattamento discontinuo nell’assunzione degli antidepressivi ha rivelato in alcuni bambini
una sindrome d’astinenza.
-Einarson TR, Einarson A.( Pharmacoepidemiol Drug Saf 2005 Dec ) hanno condotto 7 studi su
una popolazione di 1774 gravide che hanno assunto vari antidepressivi nel primo trimestre di
gravidanza ( citalopram, escitalopram, fluoxetina, fluvoxamina, paroxetina, sertralina, reboxetina,
venlafaxina, nefazodone, mirtazapina, trazodone e bupropione. Hanno concluso che nessun
antidepressivo era associato ad un maggiore rischio di gravi malformazioni rispetto alla
popolazione generale ( 1-3% ).
-Morrison J L., Riggs K W, Rurak DW,Rerod, Fertil Dev 2005, 17 (6) hanno studiato l’impatto
sullo sviluppo fetale, in madri che assumevano la fluoxetina in gravidanza. Hanno inoltre
controllato in pecore gravide il comportamento fetale e la funzione cardiovascolare. La fluoxetina
produce un acuto incremento dei livelli plasmatici di serotonina che induce una transitoria
riduzione del flusso sanguigno intrauterino. Diminuisce la disponibilità di ossigeno e elementi
nutritivi nel feto riducendone l’accrescimento e, o,inducendo un parto prematuro. Aumenta nel
nascituro il comportamento dei movimenti oculari non rapidi, interferendo col neurosviluppo. La
fluoxetina ,nelle pecore, altera la funzione ipotalamica adulta, aumenta il rischio di alti livelli di
cortisolo fetale nel preparto. Non altera il ritmo circadiano della melatonina e della prolattina.
Comunque gli studi, a lungo termine, sul nascituro sono ancora insufficienti. La fluoxetina che è
l’ssri più studiato non ha rivelato effetti chiaramente dannosi nel feto se non una possibile
diminuzione del peso o un parto prematuro.
-Moses-Kolko EL, Bogend, Perez J, Bregar A, Uhl K, Levin B, Wisner KL, JAMA2005 nov. Gli
autori di questo studio hanno individuato una sindrome comportamentale neonatale dopo
l’esposizione ad ssri nel terzo trimestre di gravidanza. Hanno effettuato una medeline dal1966 al
febbraio2005 e Psyc Info dal 1974 al febbraio 2005. L’assunzione nel terzo trimestre di
gravidanza di ssri espone il neonato ad una sindrome comportamentale. I farmaci di questa
indagine erano: fluoxetina e paroxetina I neonati hanno rivelato disturbi a carico del sistema
nervoso, respiratorio, gastrointestinale e all’apparato motorio. Tali sintomi scompaiono dopo 2
settimane. Non è stato rilevato alcun decesso dei bambini a causa dell’esposizione agli ssri.
Cissoko H, Swortfiguer D, Girardeau B, Jonville-Bera AP, Autret-Leca E, (arch pediatr 2005 jun)
Gli autori riportano 27 gravidanze esposte fino al parto agli ssri.
Risultato: 27 bambini nati senza malformazioni, 2 ospedalizzati perché prematuri, 8 ricoverati
perché esposti ad altri farmaci: benzodiazepine, neurolettici, antagonisti H1, 5 presentavano
irritabilità, agitazione, ipotonia, brividi, sintomi di incerta interpretazione (da sindrome
d’astinenenza o da impregnazione serotoninergica.)
Conclusioni: questo studio indica una relativa benignità dell’esposizione agli ssri nella tarda
gravidanza. La raccomandazione degli Autori è di monitorare il neonato nel periodo postatale. Il
rischio di sintomi emorragici o di iponatremia non è ben conosciuto dai pediatri. Occorre un team
specializzato che segua con attenzione i nati dopo esposizione agli ssri.
-Maciag D, Simpson KL, Coppinger D, Lu Y, Wang Y, Lin RC, Paul Ja. Neuro
Psychopharmacology gennaio 2006 .Gli autori hanno osservato che i bambini nati da madri che
hanno assunto ssri dimostrano segni d’astinenza; questo indica che tali farmaci, presenti
nell’utero, penetrano nel cervello fetale a livelli biologicamente significativi. Studi coi ratti
dimostrano che la precoce esposizione fetale,ad alcuni antidepressivi, può esitare in persistenti
anomalie nel comportamento adulto e negli indici di attività monoaminergica. L’esposizione al
citalopram, potente e selettivo inibitore della ricaptazione della serotonina, conduce a una
consistente riduzione dell’ enzima triptofano idrossilasi nel rafe dorsale e nell’espressione del
trasportatore della serotonina, nella corteccia, persistente anche nell’adulto. L’esposizione al
citalopram produce nei ratti, divenuti adulti, modificazioni del comportamento, come
l’incremento dell’attività locomotoria e una ridotta attività sessuale, simili ai comportamenti
indotti da inibitori non selettivi delle monoamine. Questi dati indicano che gli effetti
neurocomportamentali degli antidepressivi sono una conseguenza della loro azione sul
trasportatore della serotonina. Una precoce esposizione agli ssri può distruggere la normale
maturazione del sistema serotoninergico e alterare i processi neuronali sertonino-dipendenti.
Questi studi sui ratti fanno supporre che anche nell’uomo la precoce esposizione agli ssri in utero
possa indurre conseguenze neurocomportamentali a lungo termine.
Uno studio svedese condotto da Hogberg U, Wang H, (Lakartidnigen 2005 marzo 7) mette in
evidenza che l’esposizione, in utero durante il secondo e terzo trimestre di gravidanza agli ssri, è
associata a transitori sintomi tossici neonatali, tipo un eccesso di serotonina nel sistema nervoso
centrale. Tale tossicità, durante il neurosviluppo, è correlata ad una interferenza degli ssri con
alcuni neurotrasmettitori come la serotonina e il gaba. E’ stato rilevato anche un effetto a lungo
termine come l’evitamento, da parte del bambino, dell’esplorazione delle novità.
Nordeng H, Spigseto (drug saf, 2005 (28) 7 sottolineano la necessità, in circostanze gravi, di
trattare le donne gravide depresse o troppo ansiose. I numerosissimi studi, nelle fasi precoci della
gravidanza, non hanno evidenziato rischi significativi di teratogenesi; questo ha contribuito al
diffondersi dell’uso degli ssri in gravidanza. Il problema si pone nel terzo trimestre. L’uso degli
ssri in questo periodo ha dimostrato varie complicazioni perinatali: respiratorie, irritabilità e
problemi dell’alimentazione. Gli autori si pongono il quesito se questi disturbi siano una diretta
conseguenza dell’assunzione dei farmaci o della loro sospensione. Diversi studi hanno dimostrato
risultati conflittuali rispetto ad una diminuzione del peso del feto e ai parti prematuri in seguito al
trattamento con ssri. L’interpretazione degli autori, vista l’ampia letteratura, è che il rischio di non
ricevere un adeguato trattamento antidepressivo nel terzo trimestre, quando è necessario, pesa di
più del rischio di eventi avversi nel bambino. Gli autori suggeriscono un adeguato monitoraggio
del neonato.
Uno studio interessante condotto da Gilbert Evans SE, Ross Le, Sellers Em, Purdy Rh, Romach
Mk, (Gynecol Endocrinol 2005 nov) spiega come donne che soffrono di disturbi d’ansia stiano
bene durante la gravidanza fino al secondo trimestre o fino al parto. Le manifestazioni ansiose
ricompaiono o durante l’ultimo trimestre o dopo il parto. Questo succede perché gli steroidi
neuroattivi (allopregnalone,pregnalone,potenti ansiolitici endogeni) aumentano significativamente
dalla decima alla trentaseiesima settimana per decrescere nella tarda fase della gravidanza. A sei
settimane dal parto tutti gli steroidi sono significativamente ridotti e comparabili al periodo
pregravidico. Solo i disturbi d’ansia hanno una certa percentuale di remissione ,gli altri no.
- JAMA 2006 riporta che la gravidanza non è protettiva per le ricadute depressive, contrariamente
al pensiero comune.
Oberlander TF, Grunan RE, Fitzgerald C, Papsdorf M, Rurak D, Riggs W. (Pediatric 2005 feb;)
hanno messo a confronto 3 gruppi di neonati. Il primo gruppo è rappresentato da bambini esposti
solamente nel periodo prenatale a ssri: 2 alla fluoxetina, 9 alla paroxetina. Il secondo gruppo
comprende bambini esposti agli ssri sia nel periodo prenatale che postnatale tramite il latte
materno (6 esposti alla fluoxetina, 20 esposti alla paroxetina, 4 esposti alla sertralina). Il terzo
gruppo comprende 22 bambini non esposti agli ssri.
Conclusioni: nei bambini esposti agli ssri solo nel periodo prenatale si evidenzia una risposta
attenuata ai movimenti facciali. Nel primo e secondo gruppo è presente una diffusa riduzione
dell’attività parasimpatica ed un aumento della modulazione parasimpatica cardiaca dopo un
evento acuto nocivo. Queste scoperte sono correlabili ad un’alterata risposta al dolore
Dalla revisione della letteratura emerge 1) la depressione materna non trattata induce conseguenze
nocive sia per il feto che per il neonato a causa di una successiva depressione post-partum 2 )il
trattamento in gravidanza con SSRI ha evidenziato una percentuale di teratogenesi pari alla
percentuale 2-4% delle gravidanze senza tali farmaci,3) gli effetti avversi a breve termine sul
neonato appaiono transitori e reversibili. Rimangono aperti i quesiti sul neurosviluppo a lungo
termine del bambino.
La Food and Drug Administration non ha finora approvato alcun psicofarmaco per la gravidanza
e l’allattamento. Pone gli SSRI in classe C:” il rischio non può essere escluso, mancano studi sugli
esseri umani, le osservazioni sugli animali sono positive per rischio fetale o mancano. Tuttavia i
potenziali benefici possono giustificare i potenziali rischi” .
Quando si ritiene necessario somministrare un farmaco in corso di gravidanza o allattamento è
importante somministrare la dose minima efficace, però un dosaggio inadeguato espone il
bambino inutilmente ai rischi sia del farmaco sia della patologia materna. Gli obiettivi della
terapia farmacologia devono essere: 1) eliminare l’esposizione del bambino alla patologia materna
raggiungendo una remissione clinica, 2)ridurre al minimo l’esposizione del bambino al farmaco.
Per raggiungere tali obiettivi occorre tenere presente gli effetti delle modificazioni fisiologiche
della gravidanza sugli effetti farmacologici di tali farmaci e comprendere i fattori che regolano il
passaggio placentare e l’escrezione dei farmaci psicotropi nel latte. Può essere necessario fare
aggiustamenti posologici, alla fine della gravidanza per mantenere la remissione dei sintomi (
Hostetter et al 2000) La gravidanza altera la farmacocinetica dei farmaci psicotropi ( Frederiksen
2001; Little 1999: Wyska e Jusko2001 ).Ciascuna delle quattro fasi della farmacocinetica (
assorbimento, distribuzione, metabolismo,eliminazione ) è influenzata dalla gravidanza. Il tessuto
di distribuzione del farmaco in corso di gravidanza è aumentato, vi è un aumento fino al 50%
della gittata cardiaca. (Less et al.1997..) L’eliminazione in corso di gravidanza è alterata
dall’aumento del flusso ematico renale ( Metcalfe et al.1955 ) e dalla velocità di filtrazione
glomerulare (Dunlop 1981).
Il grado di esposizione fetale agli psicofarmaci è in larga misura regolata dal passaggio placentare
del farmaco stesso e tutti i farmaci psicotropi si pensa attraversino la placenta. Le concentrazioni
sieriche fetali non sono la misura fondamentale dell’esposizione agli psicofarmaci ma quelle
cerebrali. Nel feto l’elevata gittata cardiaca, l’aumentata permeabilità della barriera ematoencefalica, la bassa concentrazione di proteine plasmatiche e la bassa affinità di legame delle
stesse e la bassa attività enzimatica epatica ( Bertossi et al.1999) possono determinare una
maggiore concentrazione di farmaci psicotropi nel SNC fetale.
PROBLEMA del 5HTT
La forza dell’attività serotoninergica sui recettori serotoninergici è inversamente proporzionale al
numero delle molecole funzionanti del trasportatore sulle membrane presinaptiche. Gli ssri e altri
antidepressivi simili esprimono questa relazione attraverso il blocco della ricaptazione della
serotonina mediante i trasportatori della serotonina, fino ad aumentare il segnale serotoninergico.
. Questo fenomeno dipende dalla regione cerebrale e dalla localizzazione cerebrale dei
trasportatori; possono manifestarsi risposte differenti. Per esempio, bloccando i SERT nei campi
di proiezione degli assoni serotoninergici come la corteccia cerebrale o l’amigdala, aumentano i
livelli di serotonina e i segnali a tutti i recettori serotoninergici. Al contrario, bloccando i SERT in
sedi, come nel nucleo del Rafe Mediano, dove risiedono i nuclei serotoninergici, si verifica un
aumento di attivazione degli autorecettori 5H1a, ciò diminuisce la conduzione elettrica dei
neuroni che contengono la serotonina e riduce la funzione serotoninergica.
La manipolazione del SERT con gli SSRI ha un impatto sul trasportatore diverso a seconda
del periodo dello sviluppo neuronale( finestre critiche del neurosviluppo come il periodo
intrauterino, quello dopo la nascita e l’adolescenza ). Nei topi il picco dei livelli del SERT è nel
periodo perinatale e decresce fino a stabilizzarsi nell’età adulta. E’ riconosciuta l’azione trofica
della serotonina nella regolazione della neurogenesi, nei processi di crescita e nella
programmazione della morte cellulare. Queste osservazioni suggeriscono che le manipolazioni
precoci nell’attività del SERT durante lo sviluppo possono distruggere la formazione delle
connessioni neuronali importanti per un normale funzionamento adulto. Studi sui topi hanno
evidenziato che il blocco del SERT in un periodo che corrisponde al terzo trimestre di gravidanza
umana induce cambiamenti del comportamento adulto correlati allo stress e alla paura. ( Etienne
Sibille, Ph.D.e David A, M.D.American Journal of Psychiatry jan 2006)
http://ajp.psychiatryonline.org/cgi/content/full/163/1/8
Questo articolo richiama lavori precedenti come quello di Xu Y. Sari Y. Zhou FC pubblicato sul
Dev Brain Res.2004 Jun. Gli Autori hanno evidenziato nei topi che il blocco del SERT durante lo
sviluppo distrugge l’organizzazione dei circuiti Talamocorticali diretti alla corteccia
somatosensoriale. Ansorge MS. Zhou M.et al. Science 2004, sempre nei topi, evidenziano come
un blocco precoce del trasportatore della 5-HT induca alterazioni del comportamento emozionale,
nell’adulto. I dubbi sollevati da Sibille nell’articolo sull’American aprono inquietanti quesiti che
necessitano di ulteriori ricerche.
ALLATTAMENTO
Dopo il parto il neonato continua ad avere caratteristiche fisiologiche uniche, inclusa l’attività
degli enzimi epatici relativamente bassa. La maturazione del fegato dei lattanti sembra avvenire in
maniera variabile ( Warner 1986) ed è più ritardata nei prematuri. Alla nascita sia l’ossidazione
che la glucuronizzazione sono immature,inferiori del 20% rispetto all’adulto L’ossidazione
matura attorno ai tre mesi. La velocità di filtrazione glomerulare e di secrezione tubulare sono
relativamente basse nei neonati ( 30-40%) inferiori ai livelli adulti.
Poiché i farmaci passano nel latte materno principalmente per diffusione passiva della frazione
non ionizzata e non legata, il gradiente di ph tra il siero materno e il latte svolge un ruolo
importante nella quantità di farmaco escreto nel latte stesso. Inoltre meccanismi attivi di
secrezione possono aumentare la concentrazione di farmaci nel latte.Gli approcci più comuni
utilizzano le concentrazioni sieriche materne e/o del latte per calcolare il rapporto latte plasma
che viene usato per determinare la dose giornaliera assunta dal bambino. Purtroppo molti studi
calcolano il rapporto latte-plasma da un solo campione random di latte. La previsione accurata del
livello di esposizione del bambino attraverso l’allattamento impone di considerare due gradienti
d’escrezione: il gradiente di distribuzione e il gradiente tempo ( Stove et al..1997, 2000). Esiste un
gradiente di distribuzione della concentrazione del farmaco nel latte materno nel corso di ogni
singola poppata. Di norma i farmaci psicotropi sono altamente lipofili e sono presenti nel latte
grasso a fine poppata. Esiste anche un gradiente tempo tra una dose e un’altra per l’escrezione
dello psicofarmaco nel latte materno. Il tempo in cui gli psicofarmaci sono escreti nel latte
materno dipende dalla fase di assorbimento gastrointestinale del farmaco e può essere predetto in
base alla loro farmacocinetica, per esempio il picco della sertralina nel latte è dopo otto ore dalla
assunzione.
Uno studio di Berle JO, Steen VM, Aamo TO, et al pubblicato sul J Clin Psychiatry 2004 sep ha
rilevato che gli SSRI non evidenziabili nel latte materno erano la Paroxetina e la Sertralina.
Gli studi pubblicati riguardanti gli SSRI e l’allattamento sono numerosissimi, abbiamo riferito
solo quello di Berle perché rappresenta, al momento, il punto di vista più accreditato.
CONCLUSIONI
Il titolo dell’editoriale dell’American Jounal of Psychiatry di Giugno 2006 scritto da David R.
Rubinow,M.D.” Antidepressant treatment during pregnancy : between Scylla and Charybdis”
esprime molto bene le difficoltà che gli specialisti incontrano nel trattare le patologie psichiatriche
in gravidanza e nell’allattamento.
Con competenza e massima attenzione occorre valutare qual’è il male minore per ogni singola
situazione e mai generalizzare. Occorre un approccio multidisciplinare:1) il ginecologo che vede
per primo la gestante deve prestare la massima cura nell’indagare la psicopatologia spesso celata
dalla paziente o per vergogna o per mancanza di informazione, 2)lo psichiatra o lo psicologo che
valuta la gravità della sintomatologia psichica e gli eventuali trattamenti, 3) il pediatra che segue
il neonato e con attenzione particolare la puerpera. La prevenzione delle malattie mentali
comincia nell’utero materno e continua con un monitoraggio del rapporto madre figlio che deve
essere “sufficientemente buono”( Winnicott pediatra e psicoanalista )
LA BIBLIOGRAFIA è stata citata accanto ad ogni studio descritto. Sono state di grande aiuto
letture come il libro del prof C. Bellantuono : Gli psicofarmaci in gravidanza e nell’allattamento,
pubblicato nell’Agosto 2005 e la terza edizione del trattato di psicofarmacologia: Alan F.
Schatzberg e Charles B.Nemeroff, tradotto magistralmente in italiano dal prof R.Torta.