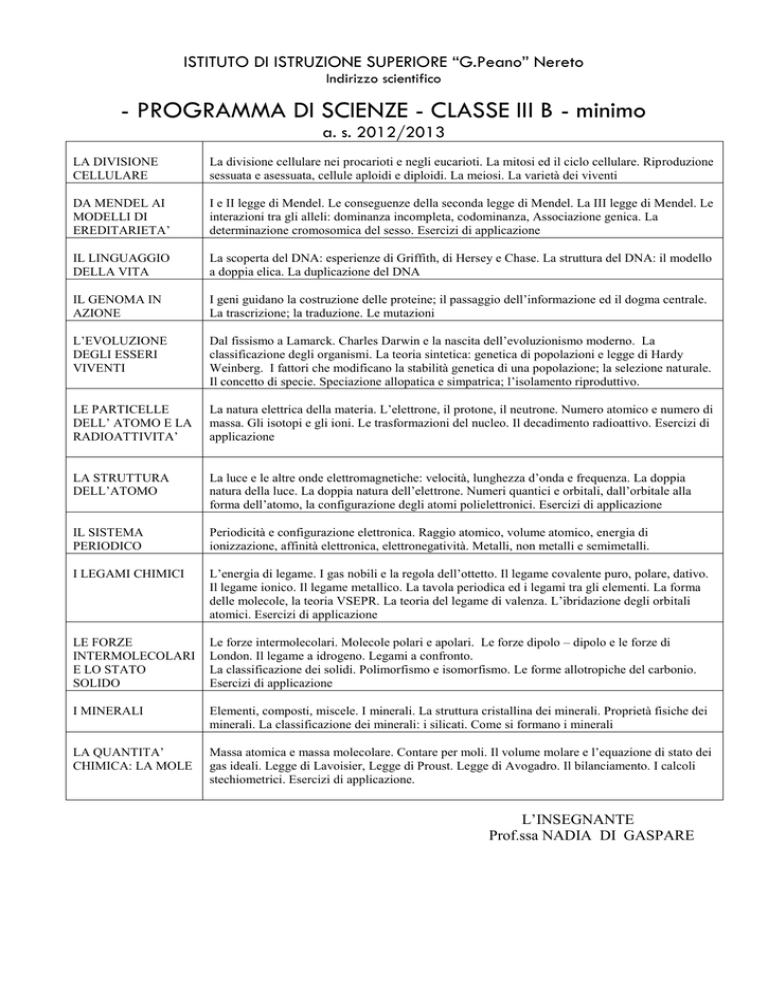
ISTITUTO DI ISTRUZIONE SUPERIORE “G.Peano” Nereto
Indirizzo scientifico
- PROGRAMMA DI SCIENZE - CLASSE III B - minimo
a. s. 2012/2013
LA DIVISIONE
CELLULARE
La divisione cellulare nei procarioti e negli eucarioti. La mitosi ed il ciclo cellulare. Riproduzione
sessuata e asessuata, cellule aploidi e diploidi. La meiosi. La varietà dei viventi
DA MENDEL AI
MODELLI DI
EREDITARIETA’
I e II legge di Mendel. Le conseguenze della seconda legge di Mendel. La III legge di Mendel. Le
interazioni tra gli alleli: dominanza incompleta, codominanza, Associazione genica. La
determinazione cromosomica del sesso. Esercizi di applicazione
IL LINGUAGGIO
DELLA VITA
La scoperta del DNA: esperienze di Griffith, di Hersey e Chase. La struttura del DNA: il modello
a doppia elica. La duplicazione del DNA
IL GENOMA IN
AZIONE
I geni guidano la costruzione delle proteine; il passaggio dell’informazione ed il dogma centrale.
La trascrizione; la traduzione. Le mutazioni
L’EVOLUZIONE
DEGLI ESSERI
VIVENTI
Dal fissismo a Lamarck. Charles Darwin e la nascita dell’evoluzionismo moderno. La
classificazione degli organismi. La teoria sintetica: genetica di popolazioni e legge di Hardy
Weinberg. I fattori che modificano la stabilità genetica di una popolazione; la selezione naturale.
Il concetto di specie. Speciazione allopatica e simpatrica; l’isolamento riproduttivo.
LE PARTICELLE
DELL’ ATOMO E LA
RADIOATTIVITA’
La natura elettrica della materia. L’elettrone, il protone, il neutrone. Numero atomico e numero di
massa. Gli isotopi e gli ioni. Le trasformazioni del nucleo. Il decadimento radioattivo. Esercizi di
applicazione
LA STRUTTURA
DELL’ATOMO
La luce e le altre onde elettromagnetiche: velocità, lunghezza d’onda e frequenza. La doppia
natura della luce. La doppia natura dell’elettrone. Numeri quantici e orbitali, dall’orbitale alla
forma dell’atomo, la configurazione degli atomi polielettronici. Esercizi di applicazione
IL SISTEMA
PERIODICO
Periodicità e configurazione elettronica. Raggio atomico, volume atomico, energia di
ionizzazione, affinità elettronica, elettronegatività. Metalli, non metalli e semimetalli.
I LEGAMI CHIMICI
L’energia di legame. I gas nobili e la regola dell’ottetto. Il legame covalente puro, polare, dativo.
Il legame ionico. Il legame metallico. La tavola periodica ed i legami tra gli elementi. La forma
delle molecole, la teoria VSEPR. La teoria del legame di valenza. L’ibridazione degli orbitali
atomici. Esercizi di applicazione
LE FORZE
INTERMOLECOLARI
E LO STATO
SOLIDO
Le forze intermolecolari. Molecole polari e apolari. Le forze dipolo – dipolo e le forze di
London. Il legame a idrogeno. Legami a confronto.
La classificazione dei solidi. Polimorfismo e isomorfismo. Le forme allotropiche del carbonio.
Esercizi di applicazione
I MINERALI
Elementi, composti, miscele. I minerali. La struttura cristallina dei minerali. Proprietà fisiche dei
minerali. La classificazione dei minerali: i silicati. Come si formano i minerali
LA QUANTITA’
CHIMICA: LA MOLE
Massa atomica e massa molecolare. Contare per moli. Il volume molare e l’equazione di stato dei
gas ideali. Legge di Lavoisier, Legge di Proust. Legge di Avogadro. Il bilanciamento. I calcoli
stechiometrici. Esercizi di applicazione.
L’INSEGNANTE
Prof.ssa NADIA DI GASPARE












