6. Malattia da reflusso
gastro-esofageo ed ernia iatale
scelta, con risultati funzionali sovrapponibili. La tecnica
consiste nell’isolare la parte distale dell’esofago o del
fondo gastrico erniato in torace, per riportalo in addome, nel totale rispetto dei nervi vaghi che decorrono
anteriormente e posteriormente all’esofago.
L’intervento si basa sulla necessità di riportare in addome una porzione adeguata di esofago, circa 2-3 cm,
senza eccessiva tensione, sulla riduzione dell’orifizio
iatale con due o più punti di sutura non riassorbibili
(iatoplastica; a volte può essere necessario rinforzare tale
sutura con una rete in materiale non riassorbibile)
(Figura 7), e sul confezionamento della plastica antireflusso. Nel caso della plastica sec. Nissen, il fondo gastrico viene avvolto a modo di sciarpa intorno all’esofago
distale. Le due emivalve così ottenute vengono fissate
anteriormente tra di loro e alla parete anteriore dell’esofago con una fila di punti non riassorbibili, per evitare un
eventuale scivolamento e successiva invaginazione dell’esofago e dello stomaco nella sciarpa formata dal fondo
gastrico (effetto telescoping). Per agevolare il confezionamento di una plastica antireflusso comoda, senza eccessiva tensione, si opta, generalemte, per sezionare i primi
2-3 vasi gastrici brevi ottenendo così una miglior mobilizzazione del fondo gastrico (Tavola 2; Figura 8)
Dal punto di vista endoscopico il buon esito dell’intervento è dimostrato da un passaggio agevole dello strumento attraverso il cardias (che per la presenza della
valva appare più lungo che non nel paziente non operato), senza scatto, ma neppure senza osservare un cardias
ipotonico; in retroversione si osserva il fondo dello stomaco che avvolge a 360° il tratto terminale dell’esofago.
In una plastica ben confezionata il fornice della valva del
versante della grande curva è stirato proprio per avvolgere a 360° l’esofago (Figure 9-10).
Quella qui descritta è la cosiddetta “floppy” Nissen, corta
e morbida, secondo la metodica proposta soprattutto
dagli autori americani (DeMeester, Donahue) e più utilizzata, specie in laparoscopia. La variante di Rossetti (la
c.d. Nissen-Rossetti) prevede l’utilizzo della parete anteriore del fondo gastrico, senza sezione dei vasi gastrici
brevi; la fundoplicatio non viene fissata all’esofago, ma
un punto (punto di Rossetti) viene passato tra valva sinistra e corpo gastrico, sempre a evitare la migrazione
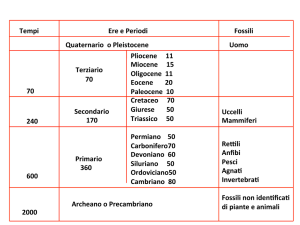
La malattia da reflusso gastro-esofageo (MRGE) è una
condizione patologica molto comune nella pratica
ambulatoriale, con un ampio spettro di manifestazioni
cliniche.
Dal punto di vista endoscopico interessano le modificazioni dell’anatomia del giunto esofago-gastrico (Figure
1-2) e le alterazioni della mucosa legate al reflusso
acido, alcalino o misto: l’esofagite (oggi comunemente
classificata secondo la scala di Los Angeles) (Tavola 1;
Figura 3) e l’esofago di Barrett (Figura 4), ovvero modificazione dell’epitelio di rivestimento dell’esofago distale che da squamoso diventa colonnare con presenza di
metaplasia intestinale.
Si noti che il Barrett può essere sospettato all’esame
endoscopico, ma deve essere sempre confermato all’esame istologico.
All’ernia può associarsi un anello di Schatzki, anello
mucoso-sottomucoso per alcuni autori determinato dal
reflusso, che può essere asintomatico, ma che può
anche causare disfagia (Figure 5-6).
Indicazioni all’intervento
- Correzione dell’ernia iatale
- Cura della malattia da reflusso gastro-esofageo in alternativa alla terapia medica
Interventi
- Plastica antireflusso sec. Nissen e sua variante Nissen-Rossetti
- Plastica antireflusso sec. Toupet
- Plastica antireflusso sec. Collis-Nissen
Descrizione
Plastica antireflusso sec. Nissen e sue varianti
L’intervento si può eseguire sia per via laparotomica sia
laparoscopica, anche se oggi si preferisce questa seconda
95
La refertazione endoscopica nel digerente operato
della fundoplicatio o il fenomeno del telescoping.
Endoscopicamente non è distinguibile dall’intervento
precedente.
Risultati
In mani esperte il successo dell’intervento è dell’8590% a distanza di un anno. Studi con follow-up più lunghi hanno riportato che a 5 anni il tasso di successo dell’intervento si attesta intorno al 75-80% e che circa il
20% dei pazienti ritorna ad assumere farmaci antisecretivi. Non c’è differenza tra approccio open e approccio
laparoscopico
La maggiore causa di insuccesso dell’intervento è legata
alla recidiva di ernia iatale: si deve considerare infatti che
l’intervento di plastica antireflusso viene eseguito anche
per pazienti con voluminose ernie iatali o paraesofagee,
per le quali il rischio di non riuscire a riportare in addome
un segmento esofageo adeguato e senza tensione è alto.
Plastica antireflusso sec. Toupet
Nel caso della plastica sec. Toupet, l’intervento è del
tutto analogo al precedente: in questo caso la valva,
però, non risulta di 360°, ma di 270°. La plastica viene
portata dietro all’esofago e fissata con due file di punti ai
lati dello stesso. Di norma il punto più prossimale, per
ogni lato, serve anche per fissare la valva al pilastro diaframmatico omolaterale (Tavola 3; Figura 11).
Endoscopicamente in retroversione la valva non appare
avvolgere completamente l’esofago; in particolare non si
osserva il fornice dx stirato (cfr. Figure 12-9). In tutti e
due i casi l’ospedalizzazione è generalmente di 3 giorni
e l’alimentazione per os con dieta morbida viene ripresa
già in prima giornata postoperatoria.
Complicanze
Plastica antireflusso sec. Collis-Nissen
E’ richiesta nei casi in cui il paziente presenti una voluminosa ernia iatale o una condizione acquisita, chiamata
“brachiesofago”, sostenuta da grave esofagite e periesofagite, che hanno determinato un accorciamento dell’esofago. In queste condizioni l’esofago, anche se
mobilizzato nella sua parte mediastinica inferiore, non
può essere riportato in addome per un tratto di circa 23 cm, e si rende necessaria una gastroplastica di allungamento. Nell’era della chirurgia open, questa procedura
aggiuntiva veniva eseguita usualmente per via toracotomica sinistra in circa l’8-10% dei pazienti sottoposti a
plastica antireflusso. La gastroplastica di allungamento
(sec. Collis) si può attualmente eseguire per via laparoscopica, grazie a una suturatrice circolare con cui viene
creato un piccolo opercolo a livello del fondo gastrico a
tutto spessore. Successivamente si crea un neoesofago,
tubulizzando il fondo gastrico mediante una suturatrice
lineare posta parallelamente alla piccola curvatura gastrica sulla guida di un dilatatore Savary® da 14 mm, precedentemente posto in esofago. La plastica antireflusso
sec. Nissen viene quindi eseguita attorno al neo-esofago
così ottenuto (intervento di Collis-Nissen) (Tavola 4).
Endoscopicamente si differenzia dalla Nissen classica per
la sede della ingiunzione esofagogastrica, che non corrisponde al passaggio diaframmatico e alla valva, costruita
intorno al tubulo gastrico (Figure 13-14).
Fondamentalmente le complicanze che possono interessare l’endoscopista sono la comparsa di disfagia, più
o meno precoce, il disfacimento o lo scivolamento della
plastica in torace con ricomparsa della sintomatologia e
la gas bloat sindrome.
Disfagia
La sua causa principale risiede in una plastica antireflusso troppo stretta, ma può essere legata anche ad altre
cause. Bisogna pertanto distinguere tra:
- disfagia dell’immediato postoperatorio: legata alla plastica stessa, in genere si risolve nel primo mese. Il semplice passaggio dell’endoscopio può risolvere il problema;
- disfagia persistente oltre un mese dall’intervento: legata
a errori tecnici nel confezionamento della valva antireflusso. Endoscopicamente il passaggio del cardias con
lo strumento standard risulta difficoltoso (substenosi,
angolazione, lateralità, ecc.). Con il passare del tempo
l’esofago si dilata (scompenso) con possibile ristagno
alimentare e assume un aspetto simil-acalasico. In questo caso una migliore valutazione si ha con una radiografia del tubo digerente prime vie con bario (Figure
15-16). Come terapia iniziale è indicata una dilatazione con dilatatori rigidi (Savary®) o con Rigiflex®,
facendo particolare attenzione in caso di iatoplastica
con rete (Figura 17);
- disfagia che insorge a distanza dall’intervento chirurgico: può essere legata alla migrazione della plastica
(scivolamento) in torace o a una invaginazione dello
stomaco nella plastica stessa (effetto telescoping) in
presenza di uno iato stretto. Endoscopicamente si
96
Malattia da reflusso gastro-esofageo ed ernia iatale
PUNTI
osserva uno sfintere risalito in torace con una substenosi a valle dovuta al passaggio diaframmatico. In altri
casi è dovuta a modificazioni (riduzione, incoordinazione, assenza) della peristalsi esofagea. All’esame
endoscopico l’esofago risulta dilatato, pur con un passaggio transcardiale regolare e una valva normalmente
rappresentata. Radiologicamente si ha un quadro tipo
acalasia (Figura 18);
- disfagia legata a una stenosi peptica: se nel tempo la
plastica si disfa, può comparire un reflusso che qualora non trattato può determinare una stenosi peptica
(Figura 19). Endoscopicamente dal versante gastrico
si può osservare la scomparsa della valva, mentre dal
versante esofageo l’aspetto è del tutto sovrapponibile
alle stenosi peptiche che insorgono nel paziente non
operato. Un primo trattamento può essere la dilatazione endoscopica, con associata terapia medica, ma
solo il reintervento può risolvere la complicanza;
- disfagia per iatoplastica stretta: se lo iato è troppo
largo, questo viene chiuso con dei punti. Talora,
soprattutto in caso di recidiva, viene posto un rinforzo con una rete in materiale non riassorbibile.
L’aspetto endoscopico non differisce significativamente da quello di una plastica stretta. Si può tentare una
cauta dilatazione endoscopica, ma difficilmente risulta
risolutiva. Da tener presente che se la rete posta a rinforzo della iatoplastica non è posizionata correttamente, può migrare all’interno della plastica (Figure 2021).
CHIAVE
Diagnosi
Valutare:
a. presenza di esofagite;
b. livello dello sfintere;
c. passaggio cardiale;
d. valva, in particolare la possibile invaginazione
dello stomaco (telescoping).
Terapia
- Iniziale tentativo endoscopico solo nel caso di
plastica stretta (errore tecnico)
- Chirurgica negli altri casi
Disfacimento/scivolamento della plastica
Nei mesi successivi all’intervento la plastica può
(Tabella 5):
- disfarsi, totalmente o parzialmente, risultando non più
ben rappresentata in retroversione. Dal punto di vista
endoscopico scompare o si appiattisce la valva antireflusso, visibile in retroversione, con sfintere ipotonico
o addirittura beante. Può recidivare l’ernia iatale
(Figure 22-23);
- risalire completamente in torace (slipped Nissen).
Endoscopicamente la si identifica al di sopra dell’impronta dei pilastri diaframmatici con risalita della linea
Z e della giunzione esofago-gastrica (Figure 24-25);
- lo stomaco può invaginarsi all’interno della plastica
(effetto telescoping). Anche in questo caso come conseguenza si ha la risalita dello sfintere in torace mentre le valve rimangono sotto diaframmatiche (Figure
26-27-28);
- in presenza di uno iato ampio e non corretto chirurgicamente si può formare una ernia paraesofagea
(Figure 29-30).
Come abbiamo detto precedentemente la conseguenza
può essere un senso di difficoltoso passaggio del cibo,
ma più spesso compare reflusso gastro-esofageo, che se
non trattato può portare alla stenosi peptica.
Suggerimenti di terapia
In caso di plastica stretta (errore tecnico) come nel caso
della Gas Bloat Syndrome si consiglia di tentare con una
dilatazione endoscopica con Rigiflex® da 35 mm gonfiato a 5 e 8 PSI per 1’ ciascuno. Nel dubbio sulla causa
della stenosi iniziare con Rigiflex® da 30 mm e dopo 1
mese passare al 35 mm. La procedura non deve essere
eseguita prima dei 2 mesi, prima cioè che la plastica si
sia consolidata. Come nell’acalasia noi consigliamo la
dilatazione sotto controllo visivo endoscopico per verificare tempestivamente eventuali lacerazioni. In caso di
insuccesso la plastica va smontata chirurgicamente e
rifatta.
In caso di stenosi di probabile origine peptica si consiglia dilatazione endoscopica con Savary®, e successivo
controllo pH-manometrico.
Suggerimenti di terapia
Se la plastica è insufficiente, con recidiva della sintomatologia clinica o comparsa di esofagite, la terapia medica costituisce il primo approccio, ma l’intervento chirurgico rappresenta l’unica alternativa possibile alla
terapia medica “ad vitam”.
97
La refertazione endoscopica nel digerente operato
PUNTI
Follow-up
CHIAVE
Diagnosi
- Sempre Rx TD con Bario in caso di malfunzionamento della plastica
- Valutare altezza e tono dello sfintere e la morfologia della valva
- Valutare la mucosa dell’esofago distale
Il follow-up deve essere intenso nel primo periodo
postoperatorio. A un mese è importante esaminare gli
esiti dell’intervento abbinando la sintomatologia con
una valutazione radiologica mediante radiografia del
tubo digerente prime vie con bario, per verificare la
geometria della plastica antireflusso confezionata.
Successivamente, a sei mesi, può essere utile uno studio
della funzionalità esofagea ripetendo una manometria e
una pH-metria esofagea. Il controllo, quindi, può essere solamente clinico a cadenza annuale. In presenza di
esofago di Barrett, il follow-up deve seguire le indicazioni adottate dalla comunità scientifica mondiale, sia
per lo stadio della malattia sia per quanto riguarda il
protocollo dei prelievi bioptici da eseguire.
L’esame endoscopico è indicato al di fuori di protocolli specifici solo in presenza di sintomatologia clinica.
Terapia
- In caso di plastica non competente, reintervento chirurgico
Gas Bloat Syndrome
Il paziente è incapace di eruttare e accumula aria nello
stomaco. Compare nel 2-5% dei pazienti a seconda della
tecnica chirurgica. Si risolve generalmente in 2-4 settimane, ma talora persiste (Figura 31). É dovuta a una
plastica stretta, ma la dieta (carboidrati) e l’aerofagia
possono aggravarla.
Dieta, corretta deglutizione, procinetici ed eventuale
dilatazione endoscopica (del cardias e/o del piloro)
costituiscono la terapia di questa sindrome.
98
Malattia da reflusso gastro-esofageo ed ernia iatale
Letture consigliate
1) Zaninotto G, Portale G, Costantini M, Fiamingo P, Rampado S, Guirroli E, Nicoletti L, Ancona E. Objective follow-up after
laparoscopic repair of large type III hiatal hernia. Assessment of safety and durability. World J Surg 2007
Nov;31(11):2177-83
2) Zaninotto G, Portale G, Costantini M, Rizzetto C, Guirroli E, Ceolin M, Salvador R, Rampado S, Prandin O, Ruol A,
Ancona E. Long-term results (6-10 years) of laparoscopic fundoplication. J Gastrointest Surg 2007 Sep;11(9):1138-45
3) Zaninotto G, Rizzetto C. Surgical options and outcomes in Barrett’s esophagus. Curr Opin Gastroenterol 2007
Jul;23(4):452-5. Review
4) Fumagalli U, Bona S, Battafarano F, Zago M, Barbera R, Rosati R. Persistent dysphagia after laparoscopic fundoplication
for gastro-esophageal reflux disease. Dis Esophagus 2008;21(3):257-61
5) Rantanen TK, Oksala NK, Oksala AK, Salo JA, Sihvo EI. Complications in antireflux surgery: national-based analysis of
laparoscopic and open fundoplications. Arch Surg 2008 Apr;143(4):359-65; discussion 365
6) Salminen P, Gullichsen R, Ovaska J. Subjective results and symptomatic outcome after fundoplication revision. Scand J
Gastroenterol 2008;43(5):518-23
7) Wong AS, Myers JC, Jamieson GG. Esophageal pH Profile Following Laparoscopic Total Fundoplication Compared to
Anterior Fundoplication. J Gastrointest Surg 2008 Feb 26
8) Richter JE, Dempsey DT. Laparoscopic antireflux surgery: key to success in the community setting. Am J Gastroenterol
2008 Feb;103(2):289-91
9) Koivusalo AI, Pakarinen MP, Lindahl HG, Rintala RJ. The cumulative incidence of significant gastroesophageal reflux in
patients with congenital diaphragmatic hernia-a systematic clinical, pH-metric, and endoscopic follow-up study.
J Pediatr Surg 2008 Feb;43(2):279-82
10) Meneghetti AT, Tedesco P, Galvani C, Gorodner MV, Patti MG. Outcomes after laparoscopic Nissen fundoplication are
not influenced by the pattern of reflux. Dis Esophagus 2008;21(2):165-9
11) Zaninotto G, Cassaro M, Pennelli G, Battaglia G, Farinati F, Ceolin M, Costantini M, Ruol A, Guirroli E, Rizzetto C, Portale
G, Ancona E, Rugge M. Barrett’s epithelium after antireflux surgery. J Gastrointest Surg 2005; 9:1253-126 (IF 2.265)
99
La refertazione endoscopica nel digerente operato
Scheda sinottica
Valutazione endoscopica
In sintesi
A livello esofageo bisogna descrivere:
Esofago
- calibro e motilità dell’esofago;
- distanza dall’AD della giunzione esofago-gastrica;
- distanza dall’AD della linea Z (o giunzione squamo-colonnare) che in genere combacia con la precedente se non si
è in presenza di un esofago di Barrett;
- distanza dall’AD dell’impronta dei pilastri, che in genere
coincide con le precedenti se non si è in presenza di un’ernia iatale recidiva;
- passaggio transcardiale, che non deve presentare difficoltà pur senza essere troppo beante;
- presenza o meno di esofagite, in particolare facendo un
confronto con il quadro precedente l’intervento;
- in caso di diagnosi pregressa di esofago di Barrett seguire
gli standard normali di refertazione (classificazione di
Praga) e di prelievo bioptico (protocollo di Seattle). Anche
in questo caso è importante descrivere le eventuali variazioni rispetto al controllo pre-operatorio.
- Calibro, motilità
- Mucosa precardiale (Esofagite, Barrett)
- Livello dall’AD di: linea Z, SEI, impronta dei pilastri
A livello gastrico bisogna:
esaminare il fondo in retroversione e valutare la presenza
della valva antireflusso, che se si è disfatta scompare completamente. Nel caso di insuccesso dell’intervento per il
cosiddetto fenomeno del telescoping è possibile talora
osservare l’invaginazione dello stomaco nella valva.
Cardias
- Passaggio strumentale (con o senza scatto) ricordando di
segnalare il calibro dello strumento
Stomaco
- Ampiezza e altezza valva (in retroversione) e posizione
rispetto il passaggio diaframmatico
Esempio di referto
Esofago: regolare per mucosa, calibro e motilità.
Cardias: neoiato a 40 cm con linea Z regolare. Impronta dei
pilastri a 41 cm dagli incisivi.
Stomaco: in retroversione si osserva plastica ben rappresentata, circonferenziale (360°) con valva di circa 1 cm di
altezza. Regolari le restanti porzioni del viscere esplorate
fino alla seconda porzione duodenale.
Conclusioni: esiti stabilizzati di intervento di plastica antireflusso sec. Nissen.
100