Costruzione della Tavola Periodica
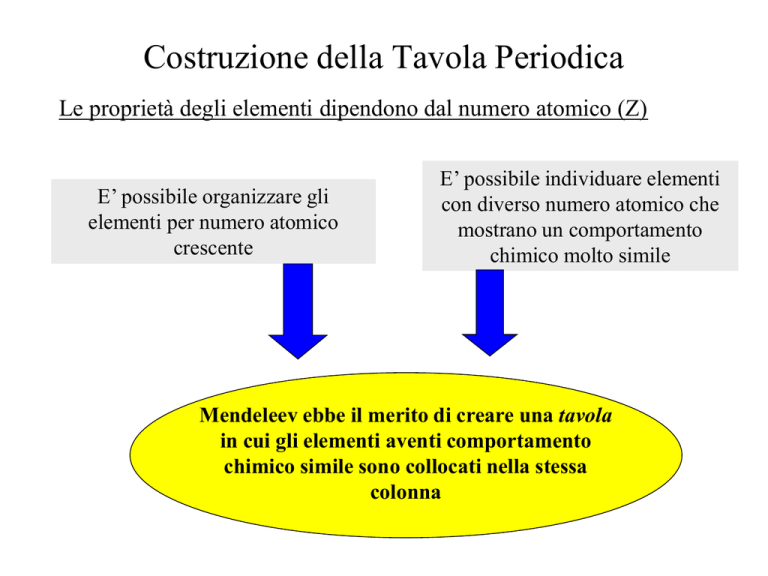
Le proprietà degli elementi dipendono dal numero atomico (Z)
E’ possibile organizzare gli
elementi per numero atomico
crescente
E’ possibile individuare elementi
con diverso numero atomico che
mostrano un comportamento
chimico molto simile
Mendeleev ebbe il merito di creare una tavola
in cui gli elementi aventi comportamento
chimico simile sono collocati nella stessa
colonna
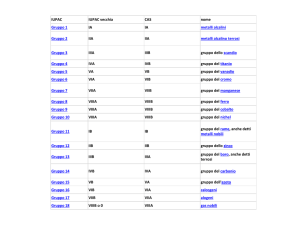
Categorie di elettroni
Elettroni interni: sono quelli del gas nobile precedente e in ogni serie di transizione
completata. Riempiono i livelli energetici inferiori
Elettroni esterni: sono quelli del livello energetico a più alto valore di n
Elettroni di valenza: intervengono nelle formazione dei legami. Per i gruppi principali
gli elettroni di valenza sono gli elettroni esterni; per gli elementi di transizione
intervengono spesso anche elettroni d interni che vengono annoverati tra quelli di
valenza
Giustificazione delle similitudini di gruppo
Gli elementi con proprietà
simili sono disposti sulla
stessa colonna
Le proprietà degli elementi
dipendono dagli elettroni di
valenza
Gli elementi dello stesso
gruppo hanno gli elettroni di
valenza nello stesso tipo di
orbitali
Tavola Periodica degli Elementi: Gruppi e Periodi
Periodi: Proprietà variabili con continuità
Gruppi: Proprietà Chimiche simili
Periodi (righe)
Gruppi
(colonne)
Proprietà periodiche degli elementi
Le proprietà atomiche degli elementi dipendono dalla loro configurazione elettronica
Le proprietà atomiche che variano in maniera ricorrente lungo ciascun periodo e
gruppo della tavola periodica sono chiamate proprietà periodiche degli elementi
Carica nucleare (Zeff o Z*)
Dimensioni atomiche o raggio
atomico
Energia di ionizzazione
Affinità elettronica
Elettronegatività
Carattere metallico
• Reattività
• Caratteristiche di legame
• Configurazione cristallina
• Proprietà acido-base
• Densità
• …..
Carica nucleare effettiva
La carica nucleare effettiva è la carica reale che l’elettrone “sente” dal nucleo positivo
La carica nucleare effettiva è la risultante della forza attrattiva esercitata dal nucleo
sull’elettrone e le forze repulsive generate dagli elettroni dei gusci più interni
Zeff è minore della carica nucleare
Zeff aumenta man mano che ci si avvicina al nucleo: ns > np > nd > nf
Carica nucleare effettiva
Raggio atomico
Raggio atomico
Lungo un gruppo: aumenta n, aumenta ra
Lungo un periodo: aumenta Zeff, diminuisce ra
Giustificazione della variazione del raggio atomico lungo un Gruppo
La dimensione di un atomo
dipende dalla distanza media
degli elettroni di valenza dal
nucleo
Lungo un gruppo il numero di
elettroni di valenza si mantiene
costante, mentre aumenta il loro
livello energetico (aumenta il
numero quantico principale)
L’aumento di livello energetico
corrisponde ad un aumento della
distanza media dal nucleo
Il raggio atomico aumenta
lungo un gruppo
Giustificazione della variazione del raggio atomico lungo
un Periodo
La dimensione di un atomo
dipende dalla distanza media
degli elettroni di valenza dal
nucleo
Lungo un periodo il
numero di elettroni di
valenza aumenta,
mentre si mantiene
costante il numero
quantico principale
Il raggio atomico diminuisce
lungo un periodo
Lungo un periodo la
carica nucleare
aumenta.
L’attrazione del
nucleo sugli elettroni
di valenza aumenta.
Gli elettroni tendono
a contrarsi sul nucleo
Raggio atomico e carica nucleare effettiva
Raggio ionico
Il raggio di un catione di un atomo diminuisce
Raggio ionico
Il raggio di un anione di un atomo aumenta
Raggio ionico
Gruppo IA della tavola periodica
Gruppo IIA della tavola periodica
Raggio ionico
Gruppo VIIA della tavola periodica
Dimensioni degli cationi (a sinistra) e degli atomi (a destra) in pm
Energia o potenziale di ionizzazione
Energia minima necessaria per togliere un elettrone dall’ultimo livello energetico di un
atomo neutro isolato nello stato gassoso
A(g)
+
A (g) +
e
E’ sempre > 0: nessun elemento isolato ha tendenza a perdere spontaneamente un
elettrone, e quindi bisogna spendere energia
diminuisce
Energia o potenziale di ionizzazione
aumenta
Lungo un periodo: aumenta Zeff, aumenta il potenziale di ionizzazione
Lungo un gruppo: aumenta n, diminuisce il potenziale di ionizzazione
Giustificazione della diminuzione dell’Energia di
Ionizzazione lungo un gruppo
Lungo un gruppo il numero di elettroni di valenza si mantiene costante, mentre
aumenta il loro livello energetico (aumenta il numero quantico principale)
L’energia di attrazione tra l’elettrone e il nucleo diminuisce
L’Energia di ionizzazione diminuisce lungo un gruppo
Giustificazione dell’aumento dell’Energia di Ionizzazione
lungo un periodo
Lungo un periodo la carica nucleare
aumenta.
Lungo un periodo il numero di
elettroni di valenza aumenta,
mentre si mantiene costante il
numero quantico principale
L’attrazione del nucleo sugli
elettroni di valenza aumenta.
Diminuisce l’energia dell’orbitale
L’Energia di Ionizzazione
aumenta lungo un periodo
Energie di ionizzazione successive
Mg
1s22s22p63s2
I ionizzazione
Mg+
1s22s22p63s1
II ionizzazione
Mg2+
1s22s22p63s0
Mg (g)
Mg+(g)
Mg2+(g)
Mg+(g) + e- IE (1) = 738 kJ/mol
Mg2+(g) + e- IE (2) = 1451 kJ/mol
Mg3+(g) + e- IE (3) = 7733 kJ/mol
Affinità elettronica
E’ la variazione minima di energia che si ha quando un elettrone viene attratto
da un atomo isolato allo stato gassoso
L’affinità elettronica aumenta lungo un periodo e diminuisce lungo un gruppo
Proprietà Periodiche: Affinità Elettronica
Energia connessa con il processo di formazione di uno ione negativo a
partire da un atomo gassoso
X(g) + e-
X-(g) + Ea.e.
La maggior parte degli elementi chimici nel formare uno
ione negativo cede energia
Ea.e. < O
Processo esotermico
diminuisce
aumenta
Proprietà metalliche
Classificazione degli elementi: Metalli, Non Metalli, Metalloidi
Metalli: Elementi con Bassa Energia di Ionizzazione e Bassa Affinità Elettronica
Non Metalli: Elementi con Alta Energia di Ionizzazione e Alta Affinità
Elettronica
Semi - Metalli: Elementi con Alta Affinità Elettronica
In natura gli elettroni si conservano
Il processo di ionizzazione
comporta sempre la formazione di due ioni di segno contrario.
Tutti gli atomi tendono a comportarsi come i sistemi meccanici
a ridurre la propria Energia Potenziale
I metalli formano solo ioni positivi
I non metalli formano facilmente Ioni Negativi,
ma molto difficilmente ioni positivi.
I semi-metalli formano difficilmente ioni
Tendono
Esercizio
Disporre in ordine di dimensioni crescenti i seguenti elementi:
Al (Z=13); B (Z=5); C (Z=6); K (Z=19); Na (Z=11)
Il raggio atomico decresce lungo un periodo
Al < Na
C<B
Il raggio atomico cresce lungo un gruppo
B < Al
Na < K
C < B < Al < Na <K