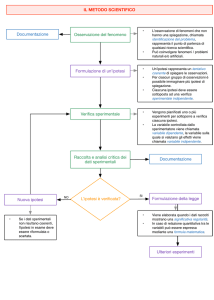
FENTANIL e SICUREZZA D’USO
In parecchie occasioni sono emerse richieste di chiarimenti da parte dei MMG relative
all’uso del Fentanil, in formulazione transmucosale, per indicazioni terapeutiche non
riportate in scheda tecnica o nel foglietto illustrativo.
In generale si ricorda che l’uso off-label dei medicinali, ovvero al di fuori delle indicazioni
previste dalla scheda tecnica, espone i pazienti a rischi che non sono previsti nei trial
clinici che precedono l’autorizzazione all’immissione in commercio da parte dell’AIFA.
Nello specifico, per quanto riguarda l’utilizzo off-label del Fentanil, si richiama un articolo
apparso sul quotidiano web del medico italiano “DoctorNews” n. 148 del 17 settembre
2007 al seguente indirizzo: http://www.doctornews.it/cm/arch/archivio.asp
“L'azienda statunitense Cephalon ha inviato una lettera ai camici bianchi per allertarli sull'uso di Fentora, il
suo farmaco a base di fentanile, al di fuori delle indicazioni. Sembra, infatti, che alcune morti siano state
associate all'uso di questo medicinale, destinato esclusivamente a trattare il dolore acuto nei malati di
cancro, ma di fatto usato da molti medici off-label, per trattare pazienti alle prese con emicranie e dolori di
schiena lancinanti. Secondo l'azienda, il farmaco è stato finora associato a quattro decessi. Per tre di questi
decessi, sopraggiunti per problemi respiratori, il farmaco era stato prescritto in modo inappropriato, in due
casi per curare dei forti mal di testa. L'azienda ha poi spiegato di aver ricevuto il report del quarto caso di
morte collegato all'assunzione di Fentora: una persona che si era suicidata mentre assumeva il farmaco, che
tuttavia non gli era mai stato prescritto……“
Versione originale sul sito: http://www.fda.gov/medwatch/safety/2007/safety07.htm#Fentora
La versione completa della dear doctor letter che da indicazioni sulla scelta dei pazienti,
sulla non prescrivibilità in determinate condizioni cliniche, sulla posologia e sull’intervallo di
tempo tra due somministrazioni, è reperibile sul sito:
http://www.fentora.com/pdf/fentora_ddl.pdf
Il Fentanil in formulazione transdermica, non generica, è autorizzato “nel trattamento del dolore
cronico da cancro e del dolore ribelle che necessita di un'analgesia a base di sostanze oppiacee”; le
formulazioni generiche sono autorizzate “nel dolore cronico grave, come quello da cancro, che
richiede il trattamento con analgesici oppiacei”.
La formulazione transmucosale è autorizzata “per il trattamento dei picchi di dolore acuto in pazienti
già in terapia di mantenimento con un oppioide per il dolore cronico da cancro. Per picco di dolore acuto si
intende una esacerbazione transitoria del dolore che si ha in aggiunta al dolore persistente controllato”
L’andamento dei consumi di Fentanil nelle due formulazioni in commercio, a livello locale,
regionale e nazionale evidenzia un maggior consumo nell’ASL di Brescia di Fentanil in
formulazione transdermica mentre il consumo della formulazione transmucosale è
confrontabile con quello regionale.
Il maggior consumo della formulazione transdermica è coerente con le indicazioni
terapeutiche autorizzate; invece, per la formulazione transmucosale, essendo limitata a
ben specifiche situazioni cliniche, caratterizzate dalla esacerbazione transitoria del grave
dolore acuto, è presumibile prevederne un uso minore, come risulta dai consumi riportati
nel grafico.
E’ pertanto plausibile supporre che i prescrittori bresciani siano maggiormente attenti nella
prescrizione della terapia del dolore.
Settembre 2007