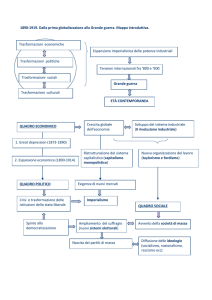
I° PRINCIPIO DELLA TERMODINAMICA
1
Indice
PREMESSA ....................................................................................................... 3
SISTEMA CHIUSO CHE DESCRIVE UN CICLO DI TRASFORMAZIONI ........ 3
SISTEMA CHIUSO CHE DESCRIVE TRASFORMAZIONI APERTE ................ 5
ENUNCIATO DEL I° PRINCIPIO ....................................................................... 7
CONSERVAZIONE DELL’ENERGIA .............................................................. 10
Sistema isolato ............................................................................................................... 10
Sistema chiuso dinamico .............................................................................................. 10
2
Premessa
Le considerazioni svolte nella parte introduttiva di richiami e definizioni consentono di
poter fare riferimento ad un sistema termodinamico particolarmente semplice qual’è
quello chiuso, classico e operativo.
A tale sistema sono riconducibili gran parte degli studi svolti nel secolo scorso e
tendenti a chiarire come calore e lavoro fossero due aspetti della stessa entità fisica:
l’energia.
I Principi della Termodinamica (I° e II°) sono qui illustrati cercando di seguire
l’evoluzione storica che ha portato agli enunciati enfatizzando le conclusioni più
significative.
Una rivisitazione dei fatti storici alla luce delle conoscenze attuali consente di cogliere
quanto di più concettualmente essenziale vi è nella sostanza dei due principi.
In quest’ottica, l’introduzione del I° P. partirà dall’esame prima dei sistemi chiusi e a
riposo per estendere in un secondo momento le considerazioni, attraverso la
conservazione dell’energia, ai sistemi chiusi e dinamici e successivamente ai sistemi
aperti, includendo eventualmente anche altre forme di energia (Termodinamica
Generalizzata).
L’enunciato si articola in due parti: la prima fa riferimento ai cicli, la seconda alle
trasformazioni aperte. Ciò consente di trarre indicazioni di carattere generale sugli
eventi che caratterizzano i sistemi nella loro evoluzione ciclica prescindendo dalla
diversità degli stati iniziale e finale, diversità che rappresenterebbe una variabile in più
nell’analisi dei fenomeni.
Sistema chiuso che descrive un ciclo di trasformazioni
Affinché un sistema possa descrivere un ciclo di trasformazioni occorre creare squilibri
nelle variabili intensive (p,T) tra il sistema e il mezzo.
In conseguenza di tali squilibri fluiscono, attraverso la superficie che delimita il sistema
dal mezzo, due entità: calore ( a causa degli squilibri di temperatura) e lavoro
meccanico (a causa degli squilibri di pressione).
Ciascuna entità può essere espressa con le proprie unità di misura (ad esempio kcal e kJ)
attribuendo i segni secondo la convenzione introdotta (calore positivo se ceduto al
sistema e lavoro positivo se compiuto dal sistema).
3
L’osservazione dell’insieme di esperienze comunque condotte con riferimento sia a
trasformazioni reversibili o reali sia ai più svariati sistemi, mette in evidenza i seguenti
due fatti:
1. I bilanci delle quantità di calore Q=Qi e L=Li non chiudono, salvo casi
particolari, a zero;
2. Se Q>0 anche L>0, ovvero se Q<0 anche L<0, ossia i bilanci chiudono sempre
con lo stesso segno.
Ciò significa che se, come avviene nei cicli cosiddetti diretti, il calore
complessivamente ricevuto dal sistema è superiore a quello ceduto (Q>0), accade
sempre che anche il lavoro complessivamente ceduto dal sistema è superiore a quello
ricevuto (L>0).
In definitiva, il sistema riceve calore e cede in cambio lavoro.
Viceversa, se, come avviene nei cicli cosiddetti inversi, il calore complessivamente
ceduto dal sistema è superiore a quello ricevuto (Q<0), accade sempre che anche il
lavoro complessivamente ricevuto dal sistema è superiore a quello ceduto (L<0).
In definitiva, il sistema riceve lavoro e cede in cambio calore.
Come prima conclusione si deve supporre che tra Q e L debbano esistere, almeno sotto
l’aspetto qualitativo, dei legami che giustifichino come la comparsa di una delle due
entità sia compensata dalla scomparsa dell’altra.
L’ipotesi di legame diventa certezza allorché si constata che il rapporto, sempre
positivo, Q/L (oppure L/Q) assume sempre un valore costante (e positivo) .Ad ogni
unità di calore ricevuto in più dal sistema corrisponde un numero fisso di unità di lavoro
ceduto in più dal sistema e viceversa.
Indicando tali rapporti Q/L=A e L/Q=E con A=1/E si ha:
Q AL = 0 (in unità termiche, per esempio kcal)
EQ L = 0 (in unità meccaniche, per esempio kJ)
I valori di A e di E dipendono dalle unità di misura considerate:
Scegliendo la kcal quale unità di misura per il calore e il kJ per il lavoro, E=4.187
kJ/kcal, mentre A=1/4.187 kcal/kJ = 3600/4.187 = 860 kcal/kWh ricordando che 1 kW
= 1 kJ/s e quindi 1 kWh = 3600 kJ
4
Scegliendo invece ancora la kcal quale unità di misura per il calore ma il kgfm per il
lavoro e ricordando che 1kgfm =9,81 J, E =4187/9,81 = 427 kgfm/kcal, mentre A=1/427
kcal/kgfm = 75x3600/427 = 632 kcal/CVh ricordando che 1 CV = 75 kgfm/s e quindi 1
CVh = 75x3600 kgfm
Riassumendo, almeno per i cicli chiusi di trasformazioni, calore e lavoro si comportano
come se fossero due aspetti diversi della stessa entità fisica: l’energia.
Questa affermazione, tuttavia, non significa che calore e lavoro siano equivalenti.
Sotto l’aspetto della trasformabilità da una forma all’altra mediante processi continui,
calore e lavoro non hanno lo stesso comportamento, come sarà chiarito dal II° P.
Esiste, in altre parole, una equivalenza metrologica tra calore e lavoro ma non
operativa.
Non è quindi corretta, a rigore, la formulazione del I° P. in termini di “Principio
dell’equivalenza”, sarebbe più corretto chiamarlo “Principio della reciproca
trasformabilità del calore e del lavoro”.
Con riferimento ai cicli, il I° P. si può enunciare affermando:
“Tutto va come se (interpretazione dei fatti sperimentali) calore e lavoro potessero
trasformarsi reciprocamente secondo un rapporto di trasformazione (A o E)
indipendente dalla natura dei sistemi (purché chiusi e a riposo) e indipendente dalle
trasformazioni (purché cicliche). Fissate le unità di misura, il rapporto di
trasformazione assume valori costanti.”
La grande novità insita in questa enunciazione è che il calore è una forma di energia.
Prima si credeva che fosse una sostanza (il calorico) che permeava i corpi e che fluiva
da un corpo all’altro sotto l’azione di una differenza di temperatura.
Sistema chiuso che descrive trasformazioni aperte
Considerando gli stessi sistemi sperimentati che descrivono però trasformazioni aperte,
si osserva che non si verificano più i fatti sintetizzati nella formulazione precedente.
In particolare, il rapporto di trasformazione (A o E) non si mantiene costante ma in
generale per un sistema qualsiasi si ha:
5
EQi Li 0, ossia a seconda della i-ma trasformazione considerata, ossia:
L1/Q1 = E1 ; L2/Q2 = E2 ; L3/Q3 = E3 , ecc…
Tale circostanza si giustifica se:
1. Si continua ad ammettere che calore e lavoro si trasformino ancora
reciprocamente ma secondo un rapporto di trasformazione (Ai o Ei) diverso da
trasformazione a trasformazione:
Ei Qi Li = 0 ovvero
Qi Ai Li = 0
2. Il rapporto di trasformazione continua ad essere quello già trovato per i cicli (E o
A), e il fatto che EQi – Li 0 dipende dalla diversità degli stati iniziale e finale.
Scartando la prima ipotesi perché inverosimile in quanto ogni trasformazione aperta
costituisce la premessa per una trasformazione ciclica. Appare privo di senso pensare
che E1, E2, E3, … assumano lo stesso valore E quando il sistema venga ricondotto allo
stato di partenza.
Seguendo invece la seconda ipotesi si osserva sempre che, fissando gli stati iniziale e
finale di un sistema e considerando le diverse trasformazioni che li collegano, la
differenza EQ – L 0 ma assume lo stesso valore per tutte le trasformazioni
considerate. E lo stesso accade per ogni altra coppia di stati iniziale e finale: cambia il
valore della differenza EQ–L ma per la stessa coppia assume il medesimo valore
indipendentemente dalle trasformazioni (reversibile o reale) che collegano gli stati
iniziali e finale. Dunque:
EQ – L è una funzione degli stati iniziale e finale e non dipende dalla
trasformazione che li collega
Anche questa conclusione è di fondamentale importanza perché presuppone l’esistenza
di una grandezza di stato (proprietà dei corpi), i cui valori dipendono solo dagli stati di
equilibrio del sistema, che, al pari di Q e L, rappresenta un’energia.
6
Si tratta di una nuova forma di energia, a cui Kelvin diede il nome di energia interna in
quanto non direttamente visibile. Tale energia, connessa con gli stati del sistema, chiude
con le sue variazioni il bilancio energetico:
EQ – L = Uf Ui ovvero in forma infinitesima EQ – L = dU
con dU differenziale esatto al contrario di Q e L.
Il calore Q>0 fornito ad un sistema si suddivide in due quote: una viene restituita come
lavoro al mezzo circostante (L>0), la restante incrementa la sua energia interna
(dU>0).
Parimenti il lavoro L<0 fornito ad un sistema si suddivide in due quote: una viene
restituita sotto forma di calore al mezzo circostante (Q<0), la restante parte incrementa
la sua energia interna (dU>0).
E’ anche possibile fornire contemporaneamente calore e lavoro determinando
l’immagazzinamento di energia interna e viceversa.
Se il sistema è adiabatico tutto il lavoro deriva (o determina) da variazioni di energia
interna e lo stesso dicasi se non c’è scambio di lavoro: tutto il calore deriva (o
determina) da variazioni di energia interna.
Se infine il sistema evolve isodinamicamente (dU=0) tutto il lavoro fornito al sistema
viene ceduto all’esterno e, viceversa, tutto il calore ricevuto dal sistema viene restituito
al mezzo sotto forma di lavoro1.
Enunciato del I° Principio
L’enunciato del I° P. è compendiato in due affermazioni:
1) tutto va come se il calore fosse una forma di energia potendosi trasformare in
lavoro secondo un rapporto costante di trasformazione indipendente dai sistemi e
delle trasformazioni, siano esse reversibili o irreversibili;
2) ogni corpo possiede un’energia interna U dipendente dal suo stato (i cui valori
dipendono unicamente dagli stati di equilibrio del sistema). Passando da uno stato
Non c’è contrasto in questa affermazione con il II P. perché la trasformazione calorelavoro non
avviene secondo un ciclo.
1
7
iniziale ad uno finale l’energia interna U subisce una variazione (Uf – Ui) misurabile
attraverso la differenza (EQ – L) con riferimento ad una qualsiasi trasformazione che
collega i due stati.
Quest’ultima affermazione equivale, come si è detto, a dire che dU è un differenziale
esatto (forma estremamente sintetica di enunciare il I° P.).
Oltre a introdurre una proprietà dei corpi, il I° P. ne dà una definizione operativa,
fornisce cioè uno strumento operativo per calcolare le sue variazioni tra due stati
qualsiasi: la differenza EQ – L misurata (o calcolata) con riferimento ad una qualunque
trasformazione che collega gli stati.
Osservazioni:
-
la relazione EQ – L = U consente di calcolare le sole variazioni e non i
valori assoluti dell’energia interna che, come tutte le grandezze di stato, è
nota a meno di una costante;
-
se le trasformazioni sono reversibili e il lavoro si limita a semplice lavoro di
espansione (o contrazione) in presenza di una frontiera mobile, allora dL =
pdV e quindi:
EdQ – dL = EdQ – pdV = dU per trasformazioni infinitesime
EQ –
2
1
pdV = U2 – U1
Nel caso di lavoro isobaro:
EQp – P(V2 – V1) = U2 – U1
EQp = P(V2 – V1) + U2 – U1 = (U2 + P2V2) – (U1 + P1V1) = H2 – H1
avendo introdotto una nuova proprietà denominata entalpia che interviene come
caso del tutto particolare in presenza di lavoro isobaro.
- con riferimento all’unità di massa:
8
Ed(Q/m) – pd(V/m) = d(U/m)
Edq – pdv = du
con le posizioni q = Q/m, v = V/m, u = U/m (si usano ove possibile lettere
minuscole)
- Se poi il sistema è anche un gas ideale per il quale valgono le equazioni di
stato:
pV = mRT oppure pv = RT
U
u
0 oppure 0
v T
v T
si ha:
u
U
du dT oppure dU
dT
T v
T v
che rappresenta la quantità di calore fornita a volume costante dq v = cvdT in
quanto pdv=0 e quindi:
u
U
cv oppure Cv
mcv
T v
T v
La relazione differenziale del I° P. valida per i gas ideali in condizioni di
reversibilità e lavoro di e è dunque:
Edq – pdv = cvdT
o più semplicemente:
9
dq – pdv = cvdT oppure dQ – pdV = CvdT
sottintendendo implicitamente che i termini siano espressi nelle stesse unità
(kcal o kJ).
Conservazione dell’energia
Il 1° Principio consente di estendere la conservazione dell’energia meccanica a tutti
quei fenomeni dissipativi (in cui è presente l’attrito) nei quali la conservazione
dell’energia, in senso ristretto, sembrava non conservarsi.
Il principio di conservazione dell’energia meccanica investe, attraverso il 1° Principio,
un campo di applicazione notevolmente più vasto che può essere ulteriormente esteso
comprendendo tutte le altre forme di energia note (elettrica, chimica, …).
La conservazione dell’energia, che costituisce una delle leggi più generali che si
conoscano in natura, può così enunciarsi:
In un sistema sede di trasformazioni energetiche la somma di tutte le forme di energia
possedute (ivi compresa l’energia interna, ma non calore e lavoro che sono grandezze
di scambio o di processo) alla fine del processo è uguale alla corrispondente somma
iniziale aumentata (in senso algebrico) delle quantità di energia scambiate con il
mezzo esterno (ivi compreso il calore)
Sistema isolato
Se il sistema è isolato, l’energia totale posseduta è costante quali che siano i fenomeni
che avvengano al suo interno. Essa dunque è un’invariante. Il 2° Principio, come è noto,
afferma che tale energia pur conservandosi va progressivamente degradandosi.
Sistema chiuso dinamico
Per un sistema chiuso di massa m e dinamico, il cui baricentro sia dotato di velocità e
suscettibile di variare la sua posizione nello spazio, la conservazione dell’energia tra
due stati 1 e 2 si esprime come segue:
10
U2
1 2
1
mc2 mgz2 U 1 mc12 mgz1 Q L
2
2
ovvero
1
U m c22 c12 mg z 2 z1 U EC E P E Q L
2
dove c1 e c2 sono le velocità del baricentro della massa di controllo nei due stati e z 1 e z2
le quote del baricentro rispetto ad un piano arbitrario di riferimento. I termini EC e
E P sono chiamati anche termini macrospici in quanto direttamente visibili.
Si osservi come rispetto alla formulazione classica (sistema chiuso a riposo) il bilancio
energetico si modifica sostituendo la variazione di energia interna U con la variazione
di energia totale E comprendente anche i termini macroscopici EC e E P . Per una
massa di controllo unitaria si ha:
e u eC eP u
1 2
c2 c12 g z 2 z1 q l
2
11