1
1. Problema di: Termodinamica - n◦ 41
Testo
(a) Da quale variabile di stato dipende l’energia interna di un gas?
(b) In quali modi posso fornire energia ad un gas?
(c) Come varia l’energia interna di un gas durante una trasformazione isoterma? Perchè?
(d) Durante una espansione il gas compie o riceve lavoro? e durante una compressione?
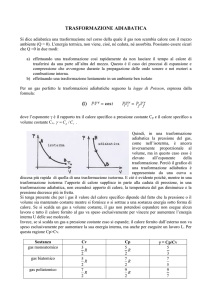
(e) Quanto calore scambia un gas durante una trasformazione adiabatica?
(f) Quando un gas fa lavoro verso l’esterno?
(g) Quando un gas riceve del lavoro dall’esterno?
(h) Disegna un ciclo di Carnot, indicandone le trasformazioni e i flussi di energia durante ogni
trasformazione.
(i) C’è scambio di calore durante una espansione isoterma? Quel calore entra nel gas o esce?
(j) Come cambia la temperatura di un gas durante una compressione adiabatica? e durante
un’espansione adiabatica?
(k) Da dove prende energia un gas che compie lavoro durante una espansione adiabatica?
(l) Da dove prende energia un gas che compie lavoro durante una espansione isoterma?
(m) In una trasf. isocora: δL =?∆U =? Se il gas cede calore, da dove prende quell’energia? Che
conseguenza ha questo sulla temperatura?
(n) In una trasf. isoterma: ∆U =?δL =? Da dove viene presa l’energia per compiere lavoro?
(o) In una trasf. adiabatica: δQ =?∆U =? Da dove viene presa l’energia per compiere lavoro?
(p) Cos’è il rendimento di un ciclo? Quanto vale per il ciclo di Carnot? Disegna il diagramma che
descrive il flusso di calore da una sorgente ad alta temperatura ad una a bassa temperatura
durante un ciclo termodinamico. Modifica quel diagramma per descrivere un ciclo frigorifero.
(q) Il calore scambiato ad alta temperatura è più o meno pregiato di quello scambiato a bassa
temperatura? Perchè?
(r) Cosa rappresenta la superficie dell’area delimitata da una trasformazione ciclica in un diagramma Pressione-Volume?
Spiegazione A tutte queste domande è possibile rispondere conoscendo pochi semplici concetti
di termodinamica.
(a) la legge fondamentale dei gas perfetti
P V = N KT
(b) le quattro principali trasformazioni termodinamiche: isoterma, isocora, isobara ed adiabatica
(c) la legge fondamentale della termodinamica
∆U = δQ − δL
(d) il legame tra variazione di volume e lavoro fatto: se il gas si espande fa lavoro verso l’esterno;
se si comprime riceve lavoro dall’esterno
(e) il legame tra temperatura ed energia interna: queste due variabili di stato sono direttamente
correlate tra loro, se varia una, varia in proporzione anche l’altra.
Svolgimento
(a) Da quale variabile di stato dipende l’energia interna di un gas?
i. L’energia interna dipende dalla temperatura. La temperatura di un gas indica infatti la
velocità delle molecole del gas e di conseguenza la loro energia cinetica, cioè l’energia
interna del gas.
(b) In quali modi posso fornire energia ad un gas?
2
i. Si può fornire energia ad un gas o tramite uno scambio di calore o tramite uno scambio di
lavoro, come indicato dalla legge fondamentale della termodinamica ∆U = δQ − δL
(c) Come varia l’energia interna di un gas durante una trasformazione isoterma? Perchè?
i. in una trasformazione isoterma la temperatura non cambia e quindi non cambia neanche
l’energia interna.
(d) Durante una espansione il gas compie o riceve lavoro? e durante una compressione?
i. Durante una espansione il gas compie lavoro; durante una compressione lo riceve.
(e) Quanto calore scambia un gas durante una trasformazione adiabatica?
i. Zero, perché si chiama adiabatica quella trasformazione nella quale non c’è scambio di
calore con l’esterno
(f) Quando un gas fa lavoro verso l’esterno?
i. Quando si espande
(g) Quando un gas riceve del lavoro dall’esterno?
i. Quando si comprime
(h) Disegna un ciclo di Carnot, indicandone le trasformazioni e i flussi di energia durante ogni
trasformazione.
i. Dovete disegnare una espansione isoterma (esce lavoro ed entra calore), successivamente
un’espansione adiabatica (esce lavoro), successivamente una compressione isoterma (entra lavoro ed esce calore), ed infine una compressione adiabatica (entra lavoro)
(i) C’è scambio di calore durante una espansione isoterma? Quel calore entra nel gas o esce?
i. Si. In una trasformazione isoterma non cambia l’energia interna del gas, quindi visto che
nell’espansione esce del lavoro, quell’energia deve essere presa dal calore in ingresso.
(j) Come cambia la temperatura di un gas durante una compressione adiabatica? e durante
un’espansione adiabatica?
i. In una compressione del lavoro entra; visto che la trasformazione è adiabatica e non scambia calore, quel lavoro diventa energia interna del gas e quindi la temperatura aumenta.
(k) Da dove prende energia un gas che compie lavoro durante una espansione adiabatica?
i. Visto che la trasformazione è adiabatica ed il gas non scambia calore, se cede lavoro prende
quell’energia dall’energia interna.
(l) Da dove prende energia un gas che compie lavoro durante una espansione isoterma?
i. In un’espanzione isoterma l’energia interna del gas non cambia, quindi se il gas cede
lavoro, prende quell’energia dall’esterno sotto forma di calore.
(m) In una trasf. isocora: δL =?∆U =? Se il gas cede calore, da dove prende quell’energia? Che
conseguenza ha questo sulla temperatura?
i. In una trasformazione isocora il volume non cambia, quindi ∆L = 0. Dalla legge fondamentale della termodinamica otteniamo che ∆U = δQ. Quindi se il gas cede calore lo
prende dall’energia interna e quindi la temperatura diminuisce
(n) In una trasf. isoterma: ∆U =?δL =? Da dove viene presa l’energia per compiere lavoro?
i. In una trasformazione isoterma la temperatura non cambia, quindi ∆U = 0. Dalla legge
fondamentale della termodinamica otteniamo che δQ = −δL. Quindi se il gas cede lavoro
prende quell’energia dal calore in ingresso
(o) In una trasf. adiabatica: δQ =?∆U =? Da dove viene presa l’energia per compiere lavoro?
i. Per definizione di adiabatica δQ = 0; quindi ∆U = −δL. l’energia per compiere lavoro
viene quindi presa dall’energia interna.
(p) Cos’è il rendimento di un ciclo? Quanto vale per il ciclo di Carnot? Disegna il diagramma che
descrive il flusso di calore da una sorgente ad alta temperatura ad una a bassa temperatura
durante un ciclo termodinamico. Modifica quel diagramma per descrivere un ciclo frigorifero.
i. Il rendimento di un ciclo è il rapporto tra il lavoro fatto dal ciclo ed il calore da esso
assorbito: η = δQδL
ass
ii. per il ciclo di Carnot la formula precedente, calcolata su due isoterme e due adiabatiche,
diventa ηcarnot = 1 − TTbassa
alta
iii. Dalla sorgente ad alta temperatura viene assorbito del calore; una parte di questo viene
trasformato in lavoro, la parte restante data ad un pozzo di calore a bassa temperatura.
3
iv. Nel ciclo frigorifero, l’utilizzo di una piccola quantità di lavoro permette di assorbire del
calore a bassa temperatura e metterlo, insieme al lavoro, in un luogo ad alta temperatura.
(q) Il calore scambiato ad alta temperatura è più o meno pregiato di quello scambiato a bassa
temperatura? Perchè?
i. Il calore scambiato ad alta temperatura è più pregiato in quanto con esso si riescono ad
ottenere rendimenti maggiori
(r) Cosa rappresenta la superficie dell’area delimitata da una trasformazione ciclica in un diagramma Pressione-Volume?
i. Come verificabile anche in base all’unità di misura dell’area in un simile grafico, l’area di
un ciclo termodinamico indica il lavoro fatto dal ciclo.