Silvano Tordini © by Mondadori Education S.p.A.
Primo principio della termodinamica
Esercizio 102
Una massa d’aria subisce una espansione adiabatica dalla temperatura di 800 °C fino alla
temperatura di 237 °C. Determinare il lavoro specifico e la variazione di energia interna subita
dal gas.
SOLUZIONE COMPLETA
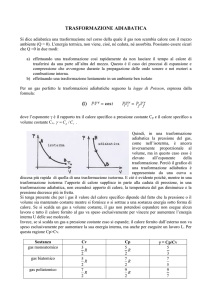
Un sistema adiabatico può rappresentarsi con un cilindro-pistone con pareti perfettamente isolate
dall’esterno in modo da non consentire nessuno scambio di calore.
Dalla tabella a pagina 245 si rilevano i valori dei calori specifici e
della costante caratteristica dell’aria; si ha:
J
J
c p = 1004,5
cv = 717,5
kg ⋅ K
kg ⋅ K
J
R = 287
kg ⋅ K
2
T2
1
aria
T1
parete
adiabatica
Le condizioni assegnate consentono l’utilizzo diretto
dell’espressione del lavoro specifico in funzione delle condizioni
iniziale e finale della temperatura:
R ⋅ (T1 − T2 ) ⎡ J ⎤
⎢ kg ⎥
k −1
⎣ ⎦
Sono da determinare le temperature assolute T1 , T2 (per omogeneità delle grandezze anche se non
sarebbe necessario) e l’esponente k dell’adiabatica:
L=
T1 = t1 + 273 [ K ]
T1 = 800 + 273 = 1073 K
T2 = t2 + 273 [ K ]
T2 = 237 + 273 = 510 K
L=
287 ⋅ (1073 − 510 )
1, 4 − 1
= 403.952,5
J
kg
Pagina 1 di 2
k=
cp
cv
1004,5
k=
= 1, 4
717,5
Si determina ora la variazione dell’energia interna; essendo Q = 0 si ha dal primo principio della
termodinamica:
0 = L + (U 2 − U1 )
e quindi
(U 2 − U1 ) = − L
(U 2 − U1 ) = −403.952,5
J
kg
La variazione dell’energia interna può determinarsi anche per altra via, come riportato a pagina
247:
⎡ J ⎤
J
(U 2 − U1 ) = 717, 4 ⋅ ( 510 − 1073) = − 403.952,5
(U 2 − U1 ) = cv ⋅ (T2 − T1 ) ⎢ ⎥
kg
⎣ kg ⎦
Pagina 2 di 2