FUNZIONI PRINCIPALI DEL RE
ACCESSO DELLE PROTEINE NEL PATHWAY SECRETORIO
ACQUISIZIONE DELLA TOPOLOGIA DELLE PROTEINE DI
MEMBRANA
FORMAZIONE DI PONTI DISOLFURO
AGGIUNTA E RIELABORAZIONE DI OLIGOSACCARIDI
(GLICOSILAZIONE)
CONTROLLO DI QUALITA’
OPPORTUNI TAGLI PROTEOLITICI
ASSEMBLAGGIO DI PROTEINE MULTIMERICHE
FORMAZIONE DI PONTI DISOLFURO
IgG
Ponti
disolfuro
GLUTATIONE (GSH) è un tripeptide costituito da glicina e
cisteina, legate da un normale legame peptidico, e acido
glutammico che è legato alla cisteina con un legame
peptidico atipico tra il gruppo carbossilico della sua catena
laterale ed il gruppo amminico della cisteina.
G-SH
G-SH
GS-SG
Forma ridotta
Forma ossidata
Nel citoplasma la formazione dei ponti disolfuro non può avvenire perché il
rapporto GSH:GSSG è di 50:1. Il glutatione ridotto, infatti, serve a prevenire la
formazione di ponti S-S. Gli alti livelli di GSH sono assicurati dalla glutatione
reduttasi citosolica. Nel reticolo questo rapporto cambia e si ha la formazione dei
ponti disolfuro. Se si formano ponti inesatti interviene la proteina disolfuro
isomerasi (Protein Disulfide Isomerase, PDI).
Nel sistema compartimentale RE->Golgi alcune proteine diventano
glicoproteine. Avviene, cioè, una delle più importanti modificazioni delle
proteine: la GLICOSILAZIONE.
La GLICOSILAZIONE, è il processo con il quale una catena
oligosaccaridica viene legata covalentemente ad un peptide
(glicoproteine) o ad un lipide (glicolipidi).
Una catena oligosaccaridica è costituita da monosaccaridi legati
covalentemente. Queste catene vengono formate grazie a
glicosiltransferasi.
I monosaccaridi sono l’unità strutturale di base di tutti i glicani
Un monosaccaride è un carboidrato che non può essere
idrolizzato in unità più semplici.
Un monosaccaride è chimicamente un’idrossi-aldeide o un idrossi-chetone
La gliceraldeide è il più semplice aldoso e il diidrossiacetone il più semplice chetoso
La gliceraldeide può essere considerata il precursore di numerosi aldosi
Il diidrossiacetone può essere considerato il precursore di numerosi chetosi
(Glc)
(Gal)
(GlcNAc)
(Man)
(GalNAc)
LEGAME
GLICOSIDICO
+ H2O
Le catene oligosaccaridiche
possono essere
N-linked
O-linked
N-LINKED: aggiunti alle Asn che fanno parte di una sequenza-segnale
denominata glicone costituita da Asn-X-Ser/Thr (X: tutti gli aa, esclusa la
prolina). La sintesi ha inizio nel RE e la rielaborazione continua nel Golgi.
O-LINKED: aggiunti a livello di ser o thr. La sintesi avviene nel Golgi.
SINTESI DEGLI
N-LINKED
Gli oligosaccaridi di tipo N-linked vengono
aggiunti cotraduzionalmente a partire da
un precursore comune assemblato nel RE.
I monosaccaridi
utilizzati per la
polimerizzazione
sono attivati.
CORE PENTASACCARIDICO
(2GLCNAC + 3MAN)
GLICOSILTRANSFERASI: nota
Le glicosiltransferasi agiscono
sequenzialmente, in maniera
tale che il prodotto di un
enzima risulta essere il
substrato per l’azione di
un’altra transferasi. Il risultato è
una catena lineare e/o
ramificata di monosaccaridi
legati l’uno all’altro.
“one enzyme–one linkage” hypothesis
(Saul Roseman et al.): ciascun legame
glicosidico è prodotto da un singolo
enzima.
OST (oligosaccaril-transferasi): trasferisce il precursore degli oligosaccaridi Nlinked in blocco sulla proteina in corrispondenza del glicone.
Il precursore viene rielaborato nel RE prima di essere passato all’apparato di Golgi.
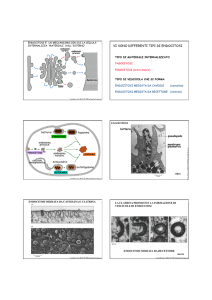
CONTROLLO DI QUALITÀ NEL RETICOLO
ENDOPLASMATICO
• Calnexina e calreticulina
• glucosidasi II
• glucosiltransferasi
Il ciclo di deglucosilazione e
riglucosilazione continua finché la
proteina non raggiunge il corretto
ripiegamento.
Controllo di qualità delle proteine nel reticolo endoplasmatico
Rappresentazione schematica di una proteina ancora in
sintesi nel reticolo endoplasmatico a cui è stata legata
una catena oligosaccaridica N-linked precursore in cui
sono evidenziati i tre glucosi terminali (triangoli viola). La
N-glicosilazione è cotraduzionale.
Modificazione degli N-linked
nell’apparato di Golgi
MANNOSIDASI
MANNOSIDASI, GLCNAC
TRANSFERASI, FUCOSILTRANSFERASI
GALATTOSIL-TRANSFERASI,
SIALIL-TRANSFERASI
CATENE OLIGOSACCARIDICHE N-LINKED
COMPLESSE
IBRIDE
ALTO
MANNOSIO
MAN6P: INDIRIZZO PER I LISOSOMI
Nelle proteine lisosomiali, come la catepsina b, esistono dei segmenti segnale
(tratti in rosso) che vengono riconosciuti da precisi siti di riconoscimento
presenti nell’enzima N-acetilglucosammina fosfotransferasi dell’apparato di
Golgi. Una volta che il legame fra segmenti segnale e siti di riconoscimento è
avvenuto, la fosfotrasferasi trasferisce una N-acetilglucosammina fosfato alla
catena oligosaccaridica della proteina lisosomiale. Successivamente viene
rimossa l’N-acetilglucosammina e resta così un mannosio 6-fosfato terminale
che costituisce il segnale per le proteine lisosomiali.
I residui di mannosio 6-fosfato costituiscono l’indirizzo per le
proteine che devono andare ai lisosomi.
MOLECOLA DI CLATRINA
Triskelion di clatrina al microscopio
elettronico dopo ombreggiatura
con platino
(riprodotta con autorizzazione da Macmillan
Publisher Ltd: Nature, E. Ungewickell e D.
Branton, Assembly units of clathrin coats,
©1981).
Clathrin- coated vesicles
Canestri di clatrina visti dopo colorazione
negativa
La freccia indica il centro di un esamero di
clatrina (triskelion). ×280.000 (riprodotta da
The Journal of Cell Biology, 1981, 91: 790-7,
R.A. Crowther e B.M. Pearse, Assembly and
packing of clathrin into coats).
Per la polimerizzazione della clatrina è
necessario l’intervento di ARF quale
proteina legante il GTP.
MECCANISMI DEI TRE DIVERSI TIPI DI ENDOCITOSI
pseudopodi
Fagocitosi (a), pinocitosi (b) ed endocitosi mediata da recettori (c)
FAGOCITOSI
Microfotografia al microscopio a
scansione di un macrofago murino che
sta fagocitando due globuli rossi
danneggiati. Le frecce mostrano le
estremità di sottili processi del
macrofago (pseudopodi) che si
estendono come un collare per
inglobare i globuli rossi. (Courtesy of
Jean Paul Revel.)
Macrofago al microscopio elettronico che sta fagocitando un globulo rosso
(GR). RER, reticolo rugoso; L, lisosomi; P, pseudopodi. ×11.000
La fagocitosi prevede un
riconoscimento specifico da
parte di una cellula
specializzata.
Il fagosoma si fonde con il lisosoma
formando un fagolisosoma che
degrada le macromolecole.
PINOCITOSI
La pinocitosi non prevede un
riconoscimento specifico. La
cellula incorpora in vescicole il
fluido extracellullare e alcune
molecole in esso disciolte.
ENDOCITOSI MEDIATA DA RECETTORI
L’endocitosi
mediata
da
recettori è un processo
specifico in cui la molecola che
viene incorporata deve prima
essere riconosciuta da un
recettore.
ENDOCITOSI MEDIATA DA RECETTORI
Nell’endocitosi mediata da recettori le
vescicole rivestite di clatrina si formano
per invaginazione della membrana
plasmatica. Un esempio è rappresentato
dall’incorporazione delle LDL.
particella di LDL (Low Density Lipoprotein,
lipoproteina a bassa densità)
ENDOCITOSI MEDIATA DA RECETTORI
Fotografie al microscopio elettronico a trasmissione di quattro fasi
dell'endocitosi di particelle lipoproteiche di tuorlo nell'oocito di pollo. Le
particelle lipoproteiche legate ai recettori formano la zona densa e ispessita
legata alla zona concava della fossetta, mentre la zona densa e ispessita sul
lato convesso rappresenta il rivestimento di clatrina. La fossetta diviene
sempre più profonda (a, b), per poi chiudersi (c) e infine distaccarsi (d)
formando una vescicola rivestita (da M.M. Perry e A.B. Gilbert, Yolk
transport in the ovarian follicle of the hen (Gallus domesticus): lipoproteinlike particles at the periphery of the oocyte in the rapid growth phase, J Cell
Sci 39: 257-72, 1979).
ENDOCITOSI MEDIATA DA RECETTORI
Al pH neutro del sangue la
transferrina (Tf) lega lo ione ferro
(Fe) formando il complesso ferrotransferrina (Fe-Tf) che viene
legato dai recettori per la
transferrina (TfR) ed endocitato.
All'interno
dell'endosoma
l'intervento
delle
pompe
protoniche acidifica l'ambiente fino
al valore di pH 5; questo provoca il
rilascio del ferro dalla transferrina.
Attraverso specifici canali di
membrana il ferro passa al citosol,
mentre il recettore rilascia la
transferrina ormai scarica. La
successiva esocitosi riporta il
recettore in superficie, dove la
transferrina, trovandosi di nuovo a
pH neutro, può legare altro ferro
per iniziare un nuovo ciclo. Apo-Tf,
apotransferrina.
Gli oligosaccaridi di tipo O-LINKED vengono aggiunti in maniera posttraduzionale uno per volta nell’apparato di Golgi. Nel Golgi ci sono proteine
trasportatrici specifiche per i monosaccaridi attivati che dal citoplasma
vengono trasportati nel lume delle cisterne.
I GRUPPI SANGUIGNI: UN ESEMPIO DI
O-GLICOSILAZIONE
L’enzima fucosiltransferasi aggiunge
un fucosio ad un precursore prodotto
ad opera di altri enzimi con
formazione dell’ANTIGENE H (gruppo
sanguigno 0).
Proteggono il polipeptide
dall’azione delle proteasi
RUOLO STRUTTURALE
DEGLI OLIGOSACCARIDI
Favoriscono il corretto
ripiegamento della proteina
Mediano l’interazione
proteina-proteina
RUOLO BIOLOGICO
DEGLI OLIGOSACCARIDI
VIRUS
sono ligandi specifici
di recettori esogeni e mediano
l’interazione con
BATTERI
PARASSITI
INTERAZIONI CELLULAMATRICE
sono ligandi specifici
di recettori endogeni e mediano
INTERAZIONI CELLULACELLULA
TRAFFICO INTRACELLULARE
(ENZIMI LISOSOMIALI)