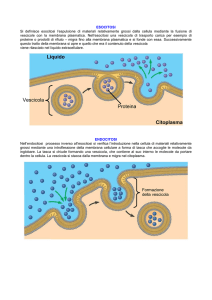
Endocitosi
internalizzazione di materiale mediante invaginazione di membrana e
formazione di vescicole
(1) pinocitosi (o endocitosi propriamente detta soluti e fluidi )
(2) fagocitosi (materiale particolato es. detriti cellulari, batteri, etc).
(A) endocitosi in fase fluida (no selezione del materiale captato)
(B) endocitosi mediata da recettore (selezione e concentrazione delle
molecole da trasportare, processo + efficiente)
Endocitosi (o pinocitosi) 4 modalità
•Mediata da clatrina
•Macropinocitosi
•Mediata da caveolina
•Indipendente da clatrina e caveole
ENDOCITOSI MEDIATA DA CLATRINA
(endocitosi di nutrienti e molecole regolatrici es Ferro e LDL)
La clatrina è un tipo di proteina di rivestimento: associandosi con le
membrane ne determina incurvatura necessaria a formazione di vescicole.
Clatrina riveste anche vescicole secretorie
Il rivestimento serve anche a selezionare il carico della vescicola
infatti le proteine di rivestimento interagiscono con il recettore di
membrana specifico mediante adattine
Proteine accessorie alla formazione di vescicole rivestite
•L’adattina media riconoscimento del recettore
•La dinamina consente distacco della vescicola formando strozzatura
FASI e compartimenti dell’endocitosi
1) Vescicola si fonde con endosoma precoce di sistamento (pH leggermente acido
favorisce distacco recettore-ligando)
2) Endosoma riciclante riporta recettore vs membrana (anche rivestimento è riciclato)
3) Ligando prosegue verso endosoma tardivo (o prelisosoma) lisosomi attivati e
digestione contenuto
NB endosoma tardivo scambia vescicole con Golgi
Endosoma: comparto che
riceve materiale endocitico
Endocitosi mediata da recettori e clatrina per LDL (lipoproteina
contenente colesterolo)
recettore è riciclato verso membrane- il colesterolo viene liberato nel
citosol
Rilevanza clinica
Mutazioni a carico del recettore per LDL (su dominio citosolico o su
extracellulare) sono causa di ipercolesterolemia familiare
Mutazioni impediscono corretta endocitosi di LDL
LDL restano nel sangue
alti livelli ematici di colesterolo
MACROPINOCITOSI
Sulla membrana si formano protusioni (“increspature”) dovute a
rimodellamento del citoscheletro (actina)
inglobano materiale extracellulare in macropinosomi vie diverse
Tipica di cellule immunitarie coinvolte nella presentazione degli antigeni (es
cell. dendritiche)
ENDOCITOSI MEDIATA DA CAVEOLE
Le invaginazioni (caveole) si
formano in corrispondenza di
zolle di membrana (rafts) ricche
di colesterolo e caveolina
(proteina che forma il
rivestimento) grazie a dinamina
Il materiale endocitato segue
varie strade: endosomi or
caveosomi direttamente
Golgi-RE
•via endocitica tipica di cellule
endoteliali (vasi sanguigni)
•Via endocitica lenta
Via endocitica mediata da caveole è sfruttata da alcuni virus,
batteri, protozoi e tossine per introdursi nella cellula attaccata!
In questa via endocitica evitano comparti degradativi!!
Infatti vanno direttamente al RE e/o al Golgi
Nelle cellule polarizzate (epitelio, neuroni, endotelio,…) la membrana (e la
cellula) è suddivisa in domini strutturalmente e funzionalmente distinti ( es
apicale e basolaterale)
Anche le vie endocitotiche sono separate, almeno fino a livello di endosomi
precoci, per poi ricongiungersi a livello di endosoma tardivo
Transcitosi:traslocazione vescicole-mediata da un lato all’altro di cellula polarizzata
Importante per assorbimento da parte dell’epitelio intestinale (intestino vasi), e di
endotelio (trasferimento vasi tessuti) ( scambio macromolecole sangue/tessuti)
Es transcitosi di Ig da ghiandole al latte materno e da questo, a livello intestinale, al
plasma del neonato immunità passiva
Recettori specifici indirizzano le proteine internalizzate vs transcitosi, evitando
comparti degradatativi (endosomi tardivi e lisosomi)
FAGOCITOSI
ingestione/distruzione di
materiale particolato
•Meccanismo di nutrimento in Eucarioti
unicellulari e animali inferiori (amebe, ciliati)
•Meccanismo di difesa in organismi
superiori (cellule specializzate: macrofagi,
cell dendritiche, neutrofili)
Processo specifico e finemente regolato (non costitutivo)
FASI
1.Riconoscimento e legame tra materiale-recettore specifico
2.Internalizzazione in un grosso vacuolo (fagosoma) che si forma per
riorganizzazione locale del citoscheletro (estroflessione di pseudopodi)
3.Maturazione graduale-multi step del fagosoma fusione con
lisosoma fagolisosoma
4.Degradazione del materiale fagocitato
Autofagia
Degradazione di molecole e compartimenti interni alla cellula
Processo specificamente regolato/attivato (non costitutivo)
Fondamentale per vari aspetti della vita cellulare
•Selettiva: stimolo induce degradazione di specifici comparti cellulari
•Non selettiva: stimoli esterni (starvation-ormoni) degradazione di
comparti non selezionati produzione nutrienti.
Modalità di autofagia
a)Macroautofagia: digestione di organello isolato da una doppia membrana
(vacuolo autofagico o “autofagosoma”) che si fonde con lisosoma
b)Microautofagia: lisosoma ingloba direttamente organello da digerire
c)Autofagia mediata da chaperon molecolari: proteine da degradare sono veicolate
al lisosoma mediante chaperon
CITOSOL
LISOSOMA
Normalmente la cellula elimina per
autofagia microorganismi penetrati
nel suo citoplasma (A)
Alcuni agenti infettivi però eludono
(come?) questo processo e lo
sovvertono in modo da crearsi
“nicchia” protetta in cui
sopravvivere e replicarsi (B)
Esocitosi:
movimento vescicole-mediato
verso esterno cellula
Riguarda proteine uscenti dal TGN
che possono seguire 3 vie
alternative :
1) Secrezione o esocitosi
costitutiva
2) Secrezione regolata
3) Trasporto ai lisosomi
•
•
Esocitosi costitutiva
Riguarda proteine continuamente secrete nel mezzo esterno (p. solubili
componenti di matrice extracellulare, es collagene o p. di membrana
plasmatica)
Le vescicole viaggiano direttamente verso membrana senza fermarsi e sono
guidate dai filamenti citoscheletrici
Esocitosi regolata
Solo cellule secretrici
specializzate;
stimolo specifico
determinano rilascio
della vescicola
Nelle cellule polarizzate le vie di
esocitosi costitutiva sono
differenziate in base a
destinazione.
Es nell’epitelio gastro
intestinale c’è zona apicale (a
contatto con il lume) e zona
basolaterale (a contatto con
matrice sottostante), separate
fisicamente e per funzione
Esistono meccanismi che
permettono alle vescicole
esocitiche di viaggiare
specificamente verso una delle
2 zone.
Esocitosi regolata
Avviene solo in alcuni tipi cellulari specializzati (es. neuroni, cellule
ghiandolari e muciparie, ecc.)
Il prodotto di secrezione si accumula in granuli di secrezione fino a che
uno specifico stimolo ne provoca rilascio all’esterno
Es pancreas esocrino produce precursori di enzimi digestivi (zimogeni)
che si accumulano nei granuli e sono secreti in risposta a stimolo nervoso
Cellule secernenti muco nel colon di mammifero
Polarità evidente
Nella zona apicale accumulo di granuli contenenti mucogeno pronto per il
rilascio
Endocitosi ed esocitosi fanno parte del “traffico vescicolare”:
continuo flusso di vescicole di trasporto che connette i vari
compartimenti membranosi della cellula.
Macchinario molecolare complesso
garantisce:
•Formazione della vescicola dal
comparto donatore
•Selezione del carico
•Distacco e spostamento vescicola
•Fusione col corretto compartimento
target
Il traffico vescicolare veicola le proteine dal RE al Golgi, ai lisosomi, alla membrana
plasmatica e allo spazio extracellulare (e viceversa!)
Scambio continuo e dinamico tra vari comparti membranosi
Curvatura di membrana alla base della formazione di vescicole dipende
dall’aggregazione di proteine di rivestimento
La curvatura è indotta da specifiche proteine di rivestimento che si assemblano per
dare “gabbie sferiche”
•Clatrina (vescicole endocitiche, che originano da membrana e da Golgi trans vs endosomi,
lisosomi)
•COP I e COPII (vescicole dal Golgi e dal RE)
Anche la geometria e la composizione lipidica contribuiscono ad indurre la
curvatura della membrana!
Il distacco della vescicola è mediato dalle dinamine
Una volta formatesi le vescicole viaggiano nel citosol sfruttando le strutture
citoscheletriche (es i microtubuli piste)
La fusione tra vescicole (eso-endocitiche e/o del traffico vescicolare) e
membrana target è controllata da proteine Rab (proteine G che in forma
attiva sono associate alle membrane) ed è fisicamente mediata da
famiglia di proteine SNARE (=trappola).
V e T SNARE si avvolgono strettamente le une sulle altre in modo da
«forzae « fusione tra le due membrane (vescicola e targe)
traffico vescicolare RE Golgi
le proteine dal RE al Golgi grazie all’interazione
di corte sequenze segnale con adattatori del
rivestimento COPII (via anterograda)
Le proteine “residenti” del RE sono recuperate
e riavviate vs RE, grazie alla seq. KDEL che
interagisce con adattatori del rivestimento
COPI incanalandosi su via retrograda
NB: legame tra seq. KDEL e adattatore CopI
(nel Golgi) e rilascio delle KDEL
dall’adattatore CopI (nel RE) dipende dalle
diverse condizioni ioniche e di pH dei vari
compartimenti
Bilanciamento tra via anterograda e
retrograda permette recupero anche di
componenti (lipidi e proteine) di membrana
evitando accrescimento sproporzionato del
Golgi Trans
cis Golgi trans Golgi
Nel Golgi le proteine subiscono varie
modifiche post-traduzionali (soprattutto a
livello di gruppi glucidici: o-glicosilazione
e rielaborazione gruppi N-glucidici)
Composizione biochimica e morfologia
del Golgi varia a seconda del settore
All’uscita dal Golgi le proteine
carico seguono 3 vie alternative
•
Secrezione costitutiva (1) o
regolata (2)
•
Trasporto ai lisosomi (3)
Marcatura delle idrolasi lisosomali
con residui di mannosio-6P
Gli enzimi destinati ai lisosomi
(idrolasi acide) sono riconosciuti e
“marcati” con un gruppo glucidico
specifico (: mannosio 6P) all’interno
del cis Golgi.
2 enzimi coinvolti in questa
modificazione
Le proteine marcate M6P sono
indirizzate ai lisosomi
•Nel trans Golgi un recettore
specifico lega il M6P e recluta il
rivestimento di clatrina
•La vescicola viaggia vs
compartimento pre-lisosomale
(“endosoma tardivo”) dove recettore
si dissocia dall’enzima a causa del
pH + acido
•Recettore poi riciclato con
vescicola retrograda
Rilevanza clinica
Malattia delle cellule I: difetto
genetico per cui non funziona
enzima che marca le idrolasi
idrolasi non raggiungono lisosoma
accumulo di sostanze indigerite
nelle inclusioni e morte cellulare