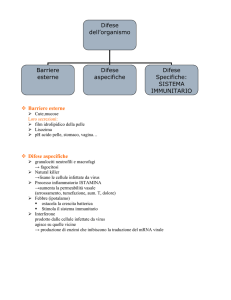
SEMAFORINE
E
CHEMOTASSI
Federica Nicoletta Sepe
PREMESSA:Studi sull’orientamento del cono di crescita
degli assoni commissurali hanno consentito di individuare
il ruolo molecolare delle semaforine.Delle 8 classi
esistenti,solo quelle dalla 3 alla 7 sono presenti nei
vertebrati,differenziate in base alla modalità di ancoraggio
alla membrana:le Classi 2,3sono secrete ;le Classi,4,5 e 6
sono proteine integrali di membrana;mentre la Classe 7 ha
un’ancora di GPI.
Esse regolano la chemotassi attraverso un riarrangiamento
citoscheletrico mediato da proteine di membrana tirosinachinasi, le plexine, associate a loro volta a co-ricettori,le
neuropiline.
DISCUSSIONE:Oltre a essere coinvolte nello sviluppo del
sistema nervoso,sono implicate in molteplici processi quali
l’adesione e la migrazione di cellule tumorali,l’angiogenesi
e la risposta immunitaria.
FIG.1.I
coni
di
crescita
vengono
prima attratti verso
la
piastra
del
pavimento
dalla
netrina,secreta dalle
cellule
ivi
presenti,per
poi
venire bloccati da
un’altra
proteina
Slit,che inibisce la
netrina e funge da
repellente assonico.Il
cono stesso accende
l’espressione
dei
ricettori
della
semaforine,trovandosi,così,costretto tra due segnali in uno
stretto fascicolo verso il cervello.
La cristallografia a raggi x ha determinato,in tutte le classi
di semaforine,un dominio extracellulare N-terminale di
circa 500 aa,detto Sema. All’interno sono presenti ponti
disolfuro,che nel caso di Sema3a costituiscono un
sottodominio di 70 aa atti a bloccare le pompe Ca/K
presenti
sul
plasmalemma.Numerose
molecole
intracellulari,quali la GTP-asi Rho e Rac1 e alcune
chinasi(Mec-3,LIM)sono coinvolte nella modulazione
delle semaforine.Come illustra lo schema che segue,il
loro meccanismo d’azione (nel caso specifico Sema 3A,
coinvolta nel differenziamento dei monociti umani in
macrofagi e promotrice dell’aptotosi nel fenotipo Fasresistente)avviene sia attraverso di una cascata di eventi
correlati alla segnalazione intracellulare sia alterando il
trasporto bidirezionale microtubulare.Nel primo caso
NIP(o CRMP62)interagisce con il dominio citoplasmatico
del
complesso
NP-1/Plex-A1,provocandone
la
dimerizzazionee e regolandone l’efficacia nonché l’
inibizione. Infatti, essa ha affinità per il dominio
citoplasmatico di Sema 4D(sembra che lo squilibrio tra
quest’ultima e Sema 3A
sia legato all’artrite
reumatoide),che compete con l’omologa proteina per le
GTP-asi che inducono una polimerizzazione locale
dell’actina,che a propria volta, agendo sui microtubuli
nella zona perinucleare, sposta il centrosoma. I
microtubuli si localizzano con l’estremità più verso la
protusione e attivano Rac1,promuovendo,con un feedback
positivo,l’ulteriore
polimerizzazione
dell’actina.
L’espressione di NP1/Plex A1 è inibita da INF-γ o da
alcune lipoproteine solubili secrete dalla cellula ad
acta.La chinasi citosolica,LIM,viene attivata dalla chinasi
Rho fosforilando la treonina 508. Questa a sua volta
fosforila la cofilina consentendo a Sema 3A,in questo
caso,di promuovere la depolimerizzazione dell’actina. É
stato dimostrato in vitro che inibendo LIM viene persa
l’attività depolimerizzatrice di Sema 3A(osservata sulla
retrazione di lamellopodi e filopodi).NP-1 è anche un
recettore per il VEGF,giocando,così,un ruolo chiave
nell’angiogenesi embrionale e nella sopravvivenza delle
cellule tumorali. Sema 3A e VEGF competono per lo
stesso sito su NP-1 ma mentre la prima inibisce la motilità
delle cellule vascolari,il secondo la promuove. Il
medesimo complesso,a basse concentrazioni di collagene
e trombina,inibisce l’aggregazione piastrinica. Le
piastrine esprimono sulla propria superficie anche Sema
4D,la plexina B1 e CD72. Il dominio extracellulare di
Sema 4D viene liberato durante la formazione di un
trombo,per mezzo di MMP specifiche e l’evento sembra
accelerare il contatto cellula cellula. In topi che difettano
di questa semaforina viene ridotta l’aggregazione
piastinica.
Le immuno-semaforine,come viene definita la sottoclasse
di molecole i cui effetti influenzano la proliferazione,il
differenziamento e l’attività dei linfociti T e B,sono Sema
4D,4A e Sema 7A.
Sema 4D/CD100 è una proteina transmembrana di 150
kDa ed è anche espressa su natural killer,monociti e
neutrofili.Il proprio dominio citoplasmatico porta un sito
per la fosforilazione della tirosina e siti multipli per la
fosforilazione della serina;inoltre può venire solubilizzata
per mezzo di MMP(solo a seguito di dimerizzazionee
come dimostrato in vitro su linfociti T).Essa è coinvolta
nello sviluppo dei linfociti B,della loro aggregazione e ne
prolungano la sopravvivenza in vitro, mediante
l’associazione con la chinasi CD42.Invece,associata con
CD45,una proteina di superficie tirosina-fosfatasi(PTP),
costituisce un complesso la cui attività aumenta
considerevolmente dopo l’attivazione dei linfociti
T.Infine,Sema 7A su i linfociti T activated interagisce con
le integrine α1β1 regolandone l’attivazione al sito di
infiammazione a seguito del richiamo dei macrofagi.
CONCLUSIONI:La ricerca sulle semaforine consente di
fornire nuovi orizzonti terapeutici su molteplici fronti e di
conoscere meglio i meccanismi di differenziamento e
chemotassi cellulare.
REFERENCES:Biologia molecolare della cellulaAlberts,Johnson,Lewis,Raff-quarta
edizione
da
Zanochelli(pag.1043-1319);Expression and funcion of
semaphorin and its receptor in human macrofagesL.B.Ivashkiv;immagini-www.jci.org
.