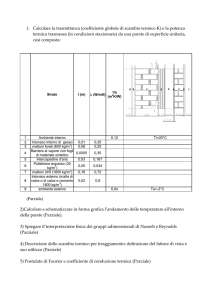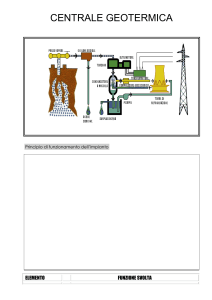
BILANCI DI ENERGIA
Capitolo
2 pag 70
BILANCI DI ENERGIA
Le energie in gioco sono di vario tipo: energia associata ai flussi entranti e
uscenti (potenziale, cinetica, interna), Calore scambiato con l’ambiente, lavoro
effettuato dal sistema, ecc..
2
BILANCI DI ENERGIA
Anche in questo caso per semplificare si possono fare le seguenti ipotesi:
considerare il sistema in uno stato stazionario, in cui si possa applicare il
principio di conservazione dell’energia;
considerare le singole apparecchiature, o l’impianto stesso, come fossero un
sistema aperto agli scambi di energia;
valutare un tipo di energia alla volta (o due se sono in possesso di equazioni
semplici che le mettono in relazione)
Energia entrante nell’unità di tempo
Energia uscente
nell’unità di tempo
=
Accumulo di
energia
Ei/Dt – Eu /Dt = DE /Dt
3
EQUAZIONI DI BILANCIO DI ENERGIA
Rappresentiamo schematicamente un semplice sistema
Lavoro
Energia interna
Energia interna
Accumulo
Energia potenziale
Energia cinetica
Calore
Energia cinetica
Energia potenziale
Energia associata - Energia associata + Calore scambiato – Lavoro effettuato = Accumulo di
ai flussi entranti
ai flussi uscenti
con l’ambiente
dal sistema
energia
Ei – Eu + Q – L = DE
ALLO STATO STAZIONARIO IL DE VALE 0
4
EQUAZIONI DI BILANCIO DI ENERGIA
REGIME STAZIONARIO
Lavoro
Regime stazionario: condizione in cui ogni parametro del sistema assume valori costanti
nel tempo.
Energia interna
Energia potenziale
Energia interna
Accumulo
Energia cinetica
Calore
Energia cinetica
Energia potenziale
Ei – Eu + Q – L = 0 ALLO STATO STAZIONARIO
DH + DEP + DEC = Q – W
Esempio 2.8 pag. 76
5
EQUAZIONI DI BILANCIO DI ENERGIA REGIME STAZIONARIO
Lavoro
Se la variazione di energia potenziale e cinetica sono trascurabili, se il sistema non
produce lavoro ma scambia solo calore, l’equazione si semplifica ancora.
Energia interna
Energia potenziale
Energia interna
Accumulo
Energia cinetica
Calore
Energia cinetica
Energia potenziale
Singresso
F * Ĥin – Suscita F * Ĥus + Q = 0
Singresso F * Ĥin = Suscita F * Ĥus con Q = 0
valido
per sistemi isolati
Esempio 2.9 pag. 77
6
EQUAZIONI DI BILANCIO DI ENERGIA
Nei problemi inerenti lo scambio di calore in regime stazionario, si possono
trascurare le variazioni di energia potenziale e cinetica e il lavoro svolto dal sistema:
Accumulo
Contenuto Termico
Calore
Contenuto Termico
Contenuto termico entrante - Contenuto termico uscente + Calore scambiato con l’ambiente = 0
DHi – DHu + DQ = 0
7
EQUAZIONI DI BILANCIO DI ENERGIA
Accumulo
Contenuto Termico
Calore
Contenuto Termico
Per contenuto termico si intende il calore necessario per portare una certa massa da una
temperatura di riferimento alla temperatura attuale.
La Temperatura di riferimento più comoda è quella di 0 °C
Per cui il contenuto termico di un corpo e quel calore necessario per portare quel corpo da 0 °C
alla temperatura voluta.
Per convenzione il contenuto termico di qualsiasi corpo a 0 °C viene posto = a 0 quando esso si
trova nel suo stato standard (l’acqua allo stato liquido).
8
CALORE SPECIFICO
Una grandezza importante negli scambi di calore è il CALORE SPECIFICO.
Cp =
Calore
Massa x Aumento di temperatura
Definito come la quantità di calore necessaria per innalzare di un grado centigrado
(Kelvin) l’unità di massa di una determinata sostanza.
La sua unità di misura è:
Cp =
kcal
kg • °C
Cp =
kJ
kg • K
Il
valore di Cp dipende dal tipo di materiale, e dalla temperatura
Talvolta per comodità si assumerà un valore costante o un valore medio.
9
CALORE SPECIFICO
I CALORI SPECIFICI per le varie sostanze si trovano:
tabulati a temperature standard con la formula per ricavare l’andamento con la
temperatura (vedi dischetto lab. inform.)
in abachi come quello seguente da cui è possibile rilevare i valori di Cp per un gran
numero di sostanze e per un buon intervallo di temperature.
Il Calore specifico di una sostanza si
ricava in questo modo:
(es alcol etilico al 50% a 20 °C)
- dalla tabella di destra si prende il
numero relativo alla sostanza in
esame (alcol etilico al 50% 20 + 80
n° 50);
- nella tabella di sinistra si individua
tale numero (50)
- si trova la T desiderata sulla linea
delle temperature a sinistra;
- si traccia una semiretta che
partendo dalla T trovata (20 °C),
passando per il punto individuato
(50) arrivi a destra fino alla linea dei
Cp;
- si legge il valore corrispondente
CALORE SPECIFICO
3,77 kJ/(kg°C)
0,9 kcal/(kg°C)
ESERCIZIO CALORE SPECIFICO 1
H2O
T1
T2
Determinare il calore necessario per
riscaldare da 20 °C a 60 °C 5 kg d’acqua.
DATI:
Massa = 5 kg
TESI:
Q = ? kJ
T1 = 20 °C
T2 = 60 °C
Soluzione:
Calore specifico = Calore / ( Massa x Aumento di Temperatura)
Ipotizziamo il Cp H2O costante = 1 kcal/(kg•°C)
Cp = Q / (M • Dt) Q = M • Cp • Dt
Dt = T2 – T1 = 60 °C – 20 °C = 40 °C
Q = 5 kg • 1 kcal/(kg•°C) • 40 °C = 200 kcal
Q = 818,6 kJ
12
ESERCIZIO CALORE SPECIFICO 2
Una cella frigorifera per prodotti ortofrutticoli viene
utilizzata per conservare mele a 4 °C. Determinare
quanto calore occorre sottrarre ad un carico di mele di
80 quintali che viene introdotto nella cella a 20 °C.
[Cp mele = 1,3 kcal (kg • °C) costante nel DT]
Mele
T1
T2
DATI:
TESI:
Massa = 80 quintali = 8000 kg
T1 = 20 °C
T2 = 4 °C
Cp mele = 1,3 kcal (kg • °C)
Q = ? kJ
Soluzione:
Calore specifico = Calore / ( Massa x Aumento di Temperatura)
Cp = Q / (M • Dt) Q = M • Cp • Dt
Dt = T2 – T1 = 20 °C – 4 °C = 16 °C
Q = 800 kg • 1,3 kcal/(kg•°C) • 16 °C = 166440 kcal
Q = 695552 kJ
13
14
BILANCI DI ENERGIA NEI SISTEMI
DINAMICI CON REAZIONI CHIMICHE
Il
bilancio di energia sarà dato da:
SFi*Ĥi – SFu*Ĥu +Qg +Q – W=0
Esempio 2.10 pag 78.
Esempio 3,19 pag 133.
ESERCIZI
1.
2.
3.
4.
5.
6.
7.
Calcola il contenuto termico di una massa di 1 kg di acqua alla temperatura di 353.15K.
Esprimi il risultato in cal e Joule.
Determinare il contenuto termico di 1 kg di vapore d’acqua a 160 °C e P = 1 atm.
(Utilizzare le tabelle Cp gas e vapori e del calore latente in funzione della pressione)
Utilizzando le tabelle del libro sui calori specifici, calcola il contenuto termico di 10 kg di
benzene a 60° C in cal e J.
In una vasca da bagno sono miscelati 50 L di acqua a 60°C e 30 L di acqua a 18°C. Qual
è la temperatura dell’acqua nella vasca?
Determinare il calore necessario per riscaldare da 20°C a 60°C 20 kg di acqua.
Utilizzando le tabelle del vapore saturo secco, determina il contenuto termico di 1.5 kg di
vapor d’acqua alla pressione di 3,8 ata, 2,55 atm, 256kPa, 1,5 ate.
Un recipiente agitato con un sistema di raffreddamento a camicia esterna, che scambia
calore solo con l’interno, è utilizzato per diluire una portata di acido solforico dal 100% al
66% tramite una portata d’acqua a 20°C. Il sistema viene raffreddato con una circolazione
di 1000 kg/h di acqua di raffreddamento che entra nella camicia esterna a 20°C.
Determinare la temperatura di uscita dell’acqua di raffreddamento quando la temperatura
di uscita dell’acido è 40°C. Dati: Calore specifico acido al 100%=0,3352 kcal/kg°C; calore
specifico acido al 66%= 0,4912 kcal/kg°C; Calore di diluizione dell’acido per kg di acqua
assorbita = 1115 kcal/kg.
16
TRASFERIMENTI DI CALORE CON
PASSAGGI DI STATO
Dell’acqua di pozzo è riscaldata con vapore saturo a bassa pressione. Il
vapore cede solo il calore latente (la condensa avrà la stessa
temperatura del vapore).
Si utilizza vapore alla pressione di 2,40 ata per riscaldare acqua di
pozzo con 17°C. Determinare:
1)
Quanto vapore serve per riscaldare 5 metri cubi di acqua a 60°C?
2)
Se utilizzo 15 kg di vapore, quale temperatura raggiungono 200L di
acqua?
3)
Qual è la temperatura del vapore?
Per la risoluzione utilizzare le tabelle dell’appendice 7.
Esame di stato 2014
In un reattore continuo a tino ben agitato (CSTR) si alimenta una miscela reagente con una portata
complessiva F = 2 kg/s.
Sapendo che:
a) la reazione è esotermica (DH = - 700 kJ/kg di miscela reagente) e la conversione raggiunta è x = 80%;
b) la miscela reagente entra a TFi = 30 °C ed i prodotti escono a TFu = 90 °C, la temperatura all’interno
del reattore è uniforme e corrisponde a quella d’uscita dei prodotti;
c) il calore specifico medio di reagenti e prodotti vale Cp = 2,2 kJ/(kg°C);
d) come fluido di raffreddamento si utilizza acqua, Cp = 4,18 kJ/(kg°C), che entra a Tai = 25 °C ed esca
a Tau = 65 °C;
f) si possono trascurare le eventuali perdite termiche.
Per il sistema di raffreddamento del reattore calcolare:
1) la potenza termica scambiata;
2) la portata dell’acqua di raffreddamento;