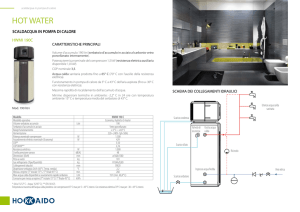
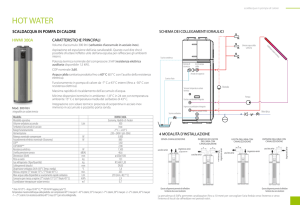
Lo scambio termico
Processi e Tecnologie
Classi Quarte Tecnico Chimico Biologico
IPSS “Galilei” - Oristano
Anno Scolastico 11/12
Professor Luciano Canu
1
Equazioni
Il perito chimico deve saper impostare e
risolvere problemi di natura chimica e
tecnica
Oltre alle normali equazioni
termodinamiche possono essere utilizzate
anche le
Equazioni di bilancio
Equazioni di trasferimento
2
Equazioni di bilancio
Si basano sui principi di
conservazione della massa
conservazione dell’energia
servono per determinare…
portate
composizioni
Temperature
…delle correnti che entrano in gioco in un
determinato
sistema
3
Sistema
Universo
Un sistema è una porzione di universo…
Sistema
Delimitata
Messa sotto osservazione, studiata, controllata
Per esempio può essere:
Reattore
Serbatoio
Condotta
Scambiatore
Evaporatore
4
Scambi del sistema
aperto
chiuso
Sistema
5
Universo
isolato
PortataEN – PortataUS = 0
Bilanci di massa
serbatoio
Fus
Un serbatoio può costituire un sistema
aperto se scambia materia ed
energia con l’esterno, ad esempio un
liquido tramite delle tubazioni
Se il volume di liquido rimane
costante allora il sistema è in regime
stazionario;
Fin = Fus
Fin
Ma quando il livello interno cambia le
due portate non si equivalgono
Fin Fus
6
Regime dinamico
In regime dinamico:
Portataen - Portataus = Accumulo
Accumulo indica una variazione
del volume di un liquido
nell’unità di tempo (V/t):
Accumulo = V/ t
V = Vf - Vi
t = tf - ti
7
Nel bilancio di massa possiamo
sostituire la quantità di materia con il
volume?
In quali casi? Perché?
Esercizi (pg 5 - n. 1 e 2)
In una vasca da bagno della capacità di 200 litri
entra una portata di acqua di 20 litri/min. La
vasca non è tappata e si avrà una portata in
uscita di 15 litri/min. Quanto tempo impiegherà
la vasca a riempirsi?
(R. 40 min)
PEN – PUS = (20 – 15)L/min = 5 L/min
Accumulo = 5 L/min = V/t
t = V/Accumulo
t = 200 L / 5 (L/min) = 40 min
8
Esercizi (pg 5 - n. 2)
Un serbatoio cilindrico verticale con diametro
di 4 m contiene del liquido fino a 2 m. Si
immette una portata di 100 litri/min.
mantenendo la valvola di uscita chiusa.
Determinare quanto tempo occorrerà per
raggiungere il livello di 4 metri
4m
R. 251,32 min
V
4m 2m
9
Bilanci di massa con più
componenti
10
Spesso si devono studiare sistemi
complessi con più di un componente
come soluzioni, miscele di liquidi e/o di
gas, e sistemi in cui avvengono reazioni
chimiche;
Es. Un miscelatore di calce è alimentato con una
portata di acqua industriale di 0,4 m3/h ed una di
calce di 100 kg/h. Determinare la portata uscente e
la concentrazione % in peso della calce
supponendo il miscelatore in regime stazionario. (R.
500 kg/h; 20%)
miscelatore
Impostare la soluzione
Calce
100 kg/h
Acqua
0,4 m3/h
Soluzione
kg/h ?
m3/h ?
Concentrazione in peso?
11
C%(m/m) = msoluto/msoluzione
Bilancio con reazioni
Bisogna tenere conto anche delle specie che
scompaiono (reagenti) e che si formano (prodotti)
PortataEN – PortataUS + Generazione – Scomparsa = Accumulo
Generazione è la quantità di una sostanza
generata nell’unità di tempo
Scomparsa è la quantità di una sostanza
consumata nell’unità di tempo
La relazione è valida se si esprimono le moli dei
componenti;
Generazione e scomparsa sono nulli se il bilancio è
espresso con le masse
Bisogna conoscere la stechiometria della reazione
12
Bilanci di energia
L’equazione generica per un bilancio
energetico:
Een/t - Eus/t = Accumulo di energia
Le forme di energia in gioco sono due:
energia associata alla massa: cinetica,
potenziale, interna ecc.
energia scambiata con l’ambiente: calore,
lavoro, radiazione elettromagnetica
13
Lo schema dei flussi
energetici
lavoro
Eentrante
Eentrante - Euscente + Cscambiato - Leffettuato
accumulo
Euscente
calore
14
Possiamo riscrivere i termini
che contribuiscono
all’Accumulo di energia
nell’unità di tempo nel
sistema:
Il lavoro (L) effettuato dal sistema è
considerato positivo
Il calore (C) assorbito dal sistema è
considerato positivo
Il calore specifico (Cp)
E’ essenziale:
nel bilancio energetico
nello scambio termico
Joule
Cp
kg K
kcal
Cp
kg C
15
DEFINIZIONE:
CP = Calore/(MassaAumento di Temperatura)
è il calore necessario ad innalzare
di un °C un kg di una determinata
sostanza
Q m CP t
Applicazioni del Cp
Esempio 1.5 pg 12
Determinare il calore necessario
per riscaldare da 20 a 60 °C 20 kg
di acqua.
Dati a disposizione: Massa = ? a T =
?
Cp = 1 (kcal/ kg °C)
NB: Il calore specifico dell'acqua
liquida si può ritenere, con buona
approssimazione, costante.
16
Alcune semplificazioni
17
Il Calore specifico può essere riferito a processi in
cui il calore viene scambiato a pressione
costante (Cp) o a volume costante (Cv);
Cp e Cv sono circa uguali per liquidi e solidi e per
questi motivi ci riferiremo sempre ai calori specifici
a pressione costante;
Il calore specifico dipende teoricamente sia dalla
temperatura che dalla pressione, ma l'influenza di
quest'ultima e trascurabile, soprattutto per liquidi
e solidi.
Anche per piccole variazioni della temperatura i
Cp possono essere considerati costanti.
Esercizio 1.6 pg 13
Una cella frigorifera di un centro commerciale
per prodotti ortofrutticoli viene utilizzata per
conservare mele a 4 °C. Determinare il calore
da sottrarre ad un carico di 3 quintali di mele
che viene introdotto nella cella alla
temperatura di 20 °C.
Il calore specifico delle mele e Cp = 1,3 kcal/kg
°C.
Dati a disposizione: Massa = 3 quintali = ?
Differenza di temperatura ΔT = ?
Cp = ?
18
Riprendiamo i bilanci
energetici
Il bilancio di energia nella sua forma più
semplice, in regime stazionario, sarà:
Eentrante - Euscente + Cscambiato - Leffettuato = Accumulo
In casi di solo scambio di calore in regime
stazionario, sarà:
Cten - Ctus + Calore scambiato = 0
19
Ct = contenuto termico
Contenuto termico (H)
Definizione:
“è la quantità di calore necessaria per
innalzare da 0°C fino alla temperatura
T una certa massa di sostanza”;
Corrisponde all’entalpia (H);
Varia con lo stato fisico della sostanza;
Si misura in kcal o in Joule
20
Esercizio 1.7 e 1.8 a pg 14
Calcolare il contenuto termico di 1 kg
di acqua alla temperatura di 80°C.
Determinare il contenuto termico di 10
kg di benzene alla temperatura di
60°C (n. 23 nella tabella).
21
Esercizio (schede fisica 2°p
pg 61)
Sapendo che il calore specifico
dell’acqua è pari ad 1 kcal/(kg°C),
qual è l’aumento di temperatura di
20 litri d’acqua che si trovano a 20
°C e ai quali vengono fornite 100
kcal di calore?
R.(5 °C)
22
Applicazioni dei
trasferimenti di calore
Bilanci
d’energia
Due liquidi di massa M1 e M2
Si trovano alle temperature T1 e T2
Vengono miscelati e raggiungono la
temperatura Te
In assenza di dispersioni all’esterno Hi = Hf
Energia (M1 + M2)i = Energia (M1 + M2)f
allora M1 Cp1 (T1 - Tf)= M2 Cp2 (Tf - T2)
23
Esercizio n 1.10 pg 16
In una vasca da bagno sono stati miscelati
50 litri di acqua a 60 °C e 30 litri di acqua a
18 °C
Qual è la temperatura finale dell’acqua
nella vasca?
R.(44,25 °C)
24
Esercizio n 1.9 pg 15
Il contenuto termico ad una certa temperatura deve
tenere conto anche di eventuali passaggi di stato
Determinare il contenuto termico di 1 kg di vapor d’acqua
alla temperatura di 160°C ed alla pressione di 1 atmosfera
Dato che da 0 a 160°C per l’acqua si ha un passaggio di
stato (evaporazione), tre saranno i contributi al calcolo del
contenuto termico
calore fornito per portare l’acqua da 0 a 100°C
calore latente di evaporazione
calore fornito per portare l’acqua da 100 a 160°C
Usare la tabella A7
R(2795 kJ)
25
Glossario
Flussi, indicati con la lettera F: in genere sono
espressi come portate (volume/tempo);
Portata: espressa come il rapporto tra volume uscente
dalla sezione di una condotta per unità di tempo;
Regime stazionario: in un serbatoio il flusso
entrante e quello uscente si equivalgono;
Regime dinamico: in un serbatoio il flusso entrante
e quello uscente sono diversi;
Entalpia (H): è il calore scambiato a pressione
costante (quasi tutte le reazioni chimiche avvengono a P
= cost.
26
Sistemi
Aperti = scambiano materia ed energia con
l’ambiente
Chiusi = solo scambi energetici con l’ambiente
Isolati = nessun tipo di scambio con l’ambiente
Adiabatici = isolati termicamente (scambi di
calore)
27
Norme UNICHIM: serbatoi
28
Uso dei
DIAGRAMMI
(calore specifico
dei liquidi)
29
Riepilogo
Equazioni di bilancio
Bilancio di massa o materia
Bilancio energetico
30