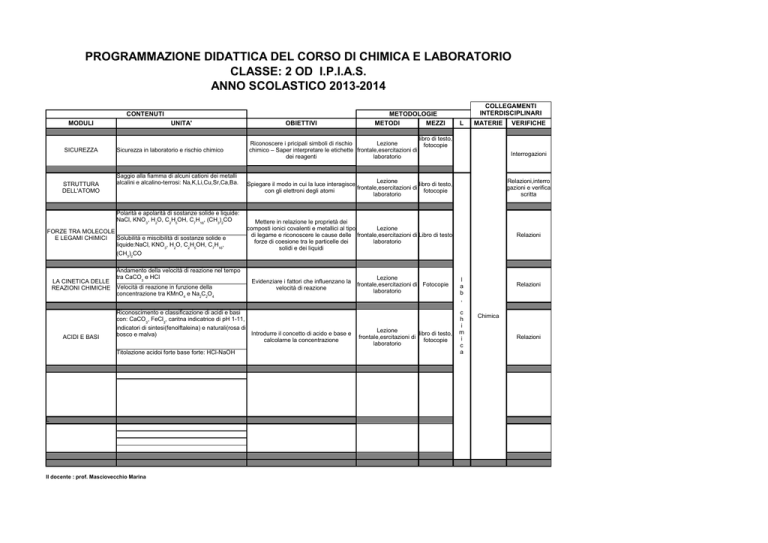
PROGRAMMAZIONE DIDATTICA DEL CORSO DI CHIMICA E LABORATORIO
CLASSE: 2 OD I.P.I.A.S.
ANNO SCOLASTICO 2013-2014
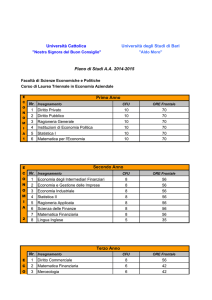
CONTENUTI
MODULI
SICUREZZA
STRUTTURA
DELL'ATOMO
UNITA'
Sicurezza in laboratorio e rischio chimico
Saggio alla fiamma di alcuni cationi dei metalli
alcalini e alcalino-terrosi: Na,K,Li,Cu,Sr,Ca,Ba.
Polarità e apolarità di sostanze solide e liquide:
NaCl, KNO3, H2O, C2H5OH, C7H16, (CH3)2CO
FORZE TRA MOLECOLE
Solubilità e miscibilità di sostanze solide e
E LEGAMI CHIMICI
liquide:NaCl, KNO3, H2O, C2H5OH, C7H16,
(CH3)2CO
LA CINETICA DELLE
REAZIONI CHIMICHE
ACIDI E BASI
Andamento della velocità di reazione nel tempo
tra CaCO3 e HCl
Velocità di reazione in funzione della
concentrazione tra KMnO4 e Na2C2O4
OBIETTIVI
Riconoscere i pricipali simboli di rischio
Lezione
chimico – Saper interpretare le etichette frontale,esercitazioni di
dei reagenti
laboratorio
L
Il docente : prof. Masciovecchio Marina
COLLEGAMENTI
INTERDISCIPLINARI
L
MATERIE
VERIFICHE
libro di testo,
fotocopie
Interrogazioni
Lezione
Spiegare il modo in cui la luce interagisce
Iibro di testo,
frontale,esercitazioni di
con gli elettroni degli atomi
fotocopie
laboratorio
Relazioni,interro
gazioni e verifica
scritta
Mettere in relazione le proprietà dei
composti ionici covalenti e metallici al tipo
Lezione
di legame e riconoscere le cause delle frontale,esercitazioni di Libro di testo
forze di coesione tra le particelle dei
laboratorio
solidi e dei liquidi
Relazioni
Evidenziare i fattori che influenzano la
velocità di reazione
Riconoscimento e classificazione di acidi e basi
con: CaCO3, FeCl3, caritna indicatrice di pH 1-11,
indicatori di sintesi(fenolftaleina) e naturali(rosa di
Introdurre il concetto di acido e base e
bosco e malva)
calcolarne la concentrazione
Titolazione acidoi forte base forte: HCl-NaOH
METODOLOGIE
METODI
MEZZI
Lezione
frontale,esercitazioni di Fotocopie
laboratorio
Lezione
libro di testo,
frontale,esrcitazioni di
fotocopie
laboratorio
l
a
b
,
c
h
i
m
i
c
a
Relazioni
Chimica
Relazioni