02 Luini imp. 18-12-2006 9:43 Pagina 11
11
BOVINI
Large Animal Review, Anno 12, n. 6, Dicembre 2006
MYCOPLASMA BOVIS IN BOVINI DA CARNE
CON PATOLOGIA RESPIRATORIA
MYCOPLASMA BOVIS IN FATTENING CATTLE WITH RESPIRATORY DISEASE
M. LUINI, V. GUALDI, L. MAIETTI, F. VEZZOLI, C. LA MALFA, E. RADAELLI2, A. SORIOLO3,
A. ALBERTON4, M. FIN4, M. RODEGHIERO4
IZSLER - Sezione di Lodi; 2UNIMI - Dipartimento Patologia Animale; 3Pfizer Italia srl; 4Libero professionista
Riassunto
M. bovis è riconosciuto come un importante patogeno nelle forme respiratorie dei bovini ed è frequentemente coinvolto in
focolai di broncopolmonite. Il principale obiettivo della nostra indagine è stato quello di evidenziare il coinvolgimento di questo
microrganismo nel corso di forme respiratorie in bovini da carne (vitelli a carne bianca e vitelloni) in allevamenti del Nord-Italia.
METODI - Al fine di disporre di un semplice strumento diagnostico è stata sviluppata una metodica PCR da utilizzare direttamente sui tamponi nasali o per la tipizzazione come M. bovis dei mycoplasmi isolati in coltura. Su 67 bovini colpiti da sintomatologia respiratoria sono stati effettuati altrettanti tamponi nasali e rilevati sintomi clinici e risposta al trattamento con tulatromicina, dal momento del prelievo al giorno 10. RISULTATI - Su 67 tamponi nasali, 41 (67,2%) sono risultati positivi per M. bovis. Di questi 40 (59,7%) o 27 (40,3%) sono risultati positivi rispettivamente in PCR o all’esame colturale. La gravità dei sintomi riscontrati negli animali campionati non è apparsa in diretta relazione con la positività da M. bovis ed il trattamento con tulatromicina da solo o associato ad altri farmaci è risultato efficace nella risoluzione della sintomatologia. CONSIDERAZIONI - Il
metodo di PCR messo a punto, si è dimostrato sufficientemente sensibile e pratico nell’applicazione in laboratori diagnostici di
base per messa in evidenza di M. bovis da campioni clinici e da colture. Le nostre indagini hanno messo in evidenza una elevata prevalenza di M. bovis in forme respiratorie in vitelli a carne bianca e in vitelloni da carne di varie razze e provenienze.
Summary
M. bovis is recognized as an important pathogen for the respiratory tract of cattle and it is frequently involved in outbreaks
of enzootic bronchopneumonia. Our investigations has been directed to demonstrate the involvement of this microorganism
in cases of respiratory disease in fattening cattle in northern Italy. METHODS - In order to improve a rapid diagnosis of the infection, a direct PCR was developed for demonstrating M. bovis from nasal swabs. 67 animals affected by respiratory symptoms were sampled by nasal swab and the clinical symptoms were recorded during 10 days after a treatment with tulathromycin. RESULTS - Out of 67 samples collected from fattening bulls with respiratory symptoms, 41 (67.2%) were positive
for M. bovis by PCR and/or culture. 40 (59.7%) and 27 (40.3%) were positive by culture and PCR respectively. The severity
of symptoms doesn’t appear directly related with the positivity for M. bovis in the nasal swabs and the treatment with tulathromycin, alone or associated with other commonly used drugs, was effective in the recovery of the affected animals. DISCUSSION - The developed PCR method proved to be feasible and sufficiently sensitive to be applied in field laboratories as a practical tool for detecting M. bovis in clinical samples and bacteriological cultures. Our investigations evidenced an high prevalence of M. bovis in cattle of different age, breading and origin affected by respiratory diseases.
INTRODUZIONE
Mycoplasma bovis è attualmente considerato un patogeno importante nella specie bovina ed è principalmente
coinvolto nel determinismo di forme respiratorie, di mastiti e di forme articolari1,2. Diverse ricerche hanno confermato che M. bovis è il batterio più comunemente isolato in
bovini da carne colpiti da forme respiratorie che non rispondono ai comuni trattamenti e in vitelli con broncopolmonite grave3,4,5. Oltre a ciò ci sono evidenze che l’infezione da M. bovis induca una immunodepressione che può
predisporre all’invasione da parte di altri patogeni5,6,7,8. Di
fatto M. bovis è ad oggi considerato uno dei principali
agenti responsabili della cosiddetta broncopolmonite enzootica in associazione ad altri tipici microrganismi quali
Pasteurella multocida, Mannheimia haemolytica, Histophylus somni, virus dell’IBR (BHV1), virus BVD, virus Respiratorio Sinciziale Bovino ed altri1,2. A livello di tratto respiratorio, l’infezione da M. bovis induce tipicamente gravi
processi broncopneumonici apicali con graduale coinvolgimento cranioventrale dei lobi polmonari. Tali lesioni
broncopneumoniche sono caratterizzate da ampie aree di
consolidamento parenchimale nel cui contesto si osservano spesso estesi focolai necrosuppurativi9,10,11 (Fig. 1). Seb-
02 Luini imp. 18-12-2006 9:43 Pagina 12
12
Mycoplasma bovis in bovini da carne con patologia respiratoria
M. bovis su tamponi nasali di bovini da carne colpiti da
forme respiratorie, effettuata attraverso l’utilizzo di una
tecnica colturale tradizionale e di un metodo di PCR opportunamente allestito.
MATERIALI E METODI
FIGURA 1 - Lesioni del polmone da Mycoplasma bovis: numerosi sequestri necrotici distribuiti nel parenchima consolidato.
bene per molti anni M. bovis sia stato considerato un microrganismo opportunista normalmente presente nel tratto respiratorio di bovini sani, recenti studi hanno suggerito che M. bovis sia sempre associato a lesioni infiammatorie del polmone e che solo raramente sia riscontrabile in
animali sani12.
L’infezione da M. bovis è largamente diffusa negli allevamenti bovini. Una ricerca effettuata nei Paesi Bassi su
148 vitelli con forma respiratoria in atto provenienti da 25
aziende ha evidenziato il 20% di prevalenza di M. bovis13,
mentre in Irlanda M. bovis è stato isolato in 134 (18%) su
736 campioni di polmone di bovini morti per
polmonite14. In questo studio, nel 66% dei casi sono stati
isolati altri patogeni respiratori. Uno studio sierologico effettuato in Svizzera ha dimostrato sieroconversione nel
50,3% dei focolai di forme respiratorie manifestatesi in
bovini da carne, con influenza significativa sull’incremento di peso e la spesa in farmaci15. Per quanto riguarda la
situazione italiana sono disponibili pochi dati. Negli anni
1994-96 è stato effettuato un monitoraggio batteriologico
che ha coinvolto 517 bovini da carne colpiti da sintomatologia respiratoria e M. bovis è risultato il batterio più
frequentemente isolato con il 12% (60/517) di campioni
positivi16. Più recentemente, nel corso di una indagine
batteriologica e anatomopatologica su animali al macello
in Sicilia, M. bovis è stato isolato nel 27,3% (9/33) dei
polmoni con lesioni di polmonite17.
Dal punto di vista diagnostico, i metodi per la dimostrazione diretta di M. bovis normalmente utilizzati nei laboratori sono di tipo colturale e prevedono l’isolamento attraverso la semina su terreni solidi e/o liquidi selettivi, addizionati di siero equino e autolisato di lievito, seguito dalla
identificazione biochimica dei ceppi18. Poiché i metodi
colturali sono generalmente lunghi e in taluni casi problematici per il difficile controllo della flora contaminante,
negli ultimi anni sono stati sviluppati diversi metodi di
PCR per la dimostrazione diretta di M. bovis da campioni
patologici, incluso tessuti, latte e tamponi19,20,21,22. Il nostro
lavoro riporta i risultati di una indagine per la ricerca di
Animali - Sono stati considerati 67 bovini da carne di
varie razze provenienti da 5 allevamenti di cui 4 di tori da
ingrasso e 1 di vitelli a carne bianca. Sono stati inclusi nel
campionamento animali clinicamente interessati da sintomi respiratori e con T° rettale superiore a 39,5°C, appartenenti complessivamente ad 11 gruppi di animali colpiti in
momenti diversi.
Rilievi clinici e terapie - Fin dal momento della prima
osservazione è stata registrata la gravità della sintomatologia respiratoria in atto come lieve, moderata o grave sulla
scorta della entità dei sintomi di dispnea, tosse, scolo nasale e depressione del sensorio ed è stata misurata la temperatura rettale. Tali rilievi sono stati ripetuti dopo 2 e 10
giorni. Al tempo zero è stata effettuata una terapia con tulatromicina (Draxin TM, Pfizer) per via sottocutanea al
dosaggio di 2,5 mg/kg pv. Durante il periodo di osservazione, a giudizio del veterinario curante e secondo la gravità del caso 31 dei 67 soggetti sono stati trattati anche
con terapie aggiuntive a base di antiinfiammatori e antibiotici di uso comune o con un secondo intervento a base
di tulatromicina.
Tamponi nasali - Su ciascun animale è stato effettuato
un tampone nasale previo contenimento dell’animale, pulizia del musello e introduzione in profondità nelle due cavità nasali di un tampone di cotone, con raccolta di secreto nasale. Il tampone è stato immediatamente scaricato per
immersione ripetuta in terreno di trasporto agarizzato Mycoplasma Transport Medium (Mycoplasma Experience
Ltd., Reigate, Surrey, U.K.) ed eliminato. Il campione ottenuto è stato subito refrigerato e congelato nell’arco di 12
ore dal prelievo a -20 C° fino al momento della consegna
al laboratorio.
Esame batteriologico - Il campione ottenuto come sopradescritto è stato scongelato ed un nuovo tampone ripetutamente immerso nel terreno è stato strisciato direttamente su piastre di PPLO agar addizionato del 20% di
siero equino e 5% di autolisato di lievito, penicillina e acetato di tallio. Le piastre sono state incubate a 37°C per 5-7
giorni per la valutazione della comparsa di tipiche colonie
a uovo fritto ed eventuali trapianti. Le colonie che dopo
coltura prolungata esibivano la caratteristica produzione
di film (colonie tipiche) venivano sottoposte alla successiva identificazione molecolare con PCR.
PCR - La PCR è stata utilizzata sia come metodo di
identificazione delle colonie isolate, sia per la dimostrazione diretta di M. bovis dai campioni di campo. Per la identificazione degli isolati, le colonie tipiche (anche una singola colonia) sono state asportate con tampone di cotone e
risospese in 300 mcl di H2O distillata sterile addizionata di
DEPC (dietilpirocarbonato 0,1%) conservata a + 4C° fino
al momento dell’estrazione del DNA. Per quanto riguarda
i campioni di campo, in seguito allo scongelamento e rottura dell’agar al momento della semina per l’esame batteriologico si è ottenuta una fase liquida che è stata separata
02 Luini imp. 18-12-2006 9:43 Pagina 13
e nuovamente congelata a -20 C° fino al momento dell’estrazione. A partire da 100 mcl dei liquidi ottenuti con le
due procedure è stata effettuata l’estrazione del DNA mediante DNeasy Tissue Kit (Qiagen®) secondo le indicazioni fornite dal produttore. Sulla base delle sequenze di M.
bovis disponibili in banca dati e mediante l’ausilio del programma PRIMER 323 è stata disegnata una coppia di primers specie specifici (MYCBV-Fw - 5’ TAT CGG TGA
CCC TTT TGC AC 3’; MYCBV-Rw - 5’ TTC CAC TTC
CTG ACT CAC CA 3’) che amplificano un frammento di
348 bp di una regione conservata del gene oppD (oligopeptide permease D) di M. bovis22. La reazione è stata
condotta in un volume finale di 20 mcl, contenente 0,2
mcM di ciascun primer, 200 mcM di dNTPs, 2 unità di
Taq polimerasi (Roche Diagnostics®) nel suo buffer di reazione 1x 1,5 mM di MgCl2 e 5 mcl di DNA estratto ed è
stato utilizzato il seguente protocollo di amplificazione:
denaturazione a 95°C per 5’, 36 cicli di 95°C per 1’, 59°C
per 30” e 72°C per 30” con una extension finale a 72°C
per 7’. Dieci microlitri dei prodotti così ottenuti sono stati
visualizzati mediante elettroforesi su gel di agarosio al
1,5%. A conferma della specificità della reazione, quattro
dei prodotti di amplificazione ottenuti sono stati purificati
e sottoposti a sequenziamento utilizzando un sistema automatico a capillare (Applied Biosystem®).
RISULTATI
Rilievi clinici e terapie - Dei 67 soggetti campionati, al
momento del prelievo, 9 manifestavano sintomatologia lieve, 49 sintomatologia di media gravità e 11 grave. Tutti i
soggetti presentavano temperatura rettale superiore a
39,5°C fino a 41,3°C ed un valore medio di 40,2°C. Al
giorno 2 post-trattamento 36 soggetti su 67 presentavano
una T° rettale inferiore o uguale a 39,5°C (53,7%). Dopo
10 giorni di osservazione in tutti i soggetti ad eccezione di
4 è stata rilevata assenza di sintomatologia respiratoria e
T° rettale inferiore a 39,5. I soggetti trattati con una singola iniezione di tulatromicina, senza ulteriori terapie hanno
manifestato risoluzione dei sintomi in 35 su 36 soggetti anche in casi caratterizzati da manifestazioni gravi e tempera-
tura rettale elevata (media delle T° rettali del gruppo =
40,2°C). Nei casi in cui è stato effettuato trattamento aggiuntivo con altri farmaci si è osservata una risoluzione clinica in 28 casi sui restanti 31 nell’arco dei 10 giorni del periodo di osservazione. Questo gruppo presentava al momento della prima terapia temperatura rettale media di
40,3°C, non significativamente superiore a quella del
gruppo trattato con sola tulatromicina. Al momento della
prima osservazione, in corrispondenza dell’esecuzione dei
tamponi nasali per ricerca di M. bovis, la temperatura rettale e l’entità della sintomatologia clinica tra i soggetti poi
risultati positivi e quelli negativi per tale ricerca non evidenziava sostanziale differenza.
Tamponi nasali - Dei 67 tamponi nasali esaminati in totale, 41 sono risultati positivi per M. bovis (61,2%). Degli
11 gruppi di bovini campionati, 9 hanno manifestato almeno 1 risultato positivo (81,8%). Complessivamente 27
campioni sono risultati positivi alla PCR (40,3%), mentre
40 sono risultati positivi all’esame colturale diretto su agar
(59,7%). Un solo campione è risultato negativo all’esame
colturale e positivo alla PCR, al contrario 15 campioni sono risultati positivi all’esame colturale e negativi alla PCR.
La sensibilità relativa della PCR vs l’esame colturale è risultata del 63% e la specificità del 96%. Relativamente ai
diversi gruppi di animali campionati, solo due hanno mostrato positività colturali e PCR negativa con 1 positivo su
5 ed 1 su 2 (Tab. 1) (Figg. 2 e 3).
PCR - La reazione ha prodotto in tutti i casi positivi una
singola banda del peso atteso senza prodotti aspecifici visibili; le bande sono risultate sempre ben marcate nel caso
di PCR da isolati e sempre nette, ma con diversi gradi di
intensità per le reazioni dirette da tampone (Fig. 4). Le sequenze generate dai prodotti di amplificazione esaminati
hanno evidenziato un’omologia del 100% con la sequenza
del gene oppD di M. bovis disponibile in banca dati (Genbank N° di accesso AF130119).
DISCUSSIONE
Le nostre indagini hanno messo in evidenza M. bovis da
tamponi nasali di bovini con forma respiratoria in atto in
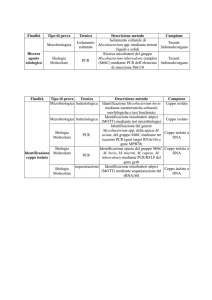
Tabella 1
Risultati dell’esame colturale e della PCR per M. bovis e caratteristiche degli animali sottoposti a tampone nasale, per ciascun allevamento
considerato e gruppo campionato (T= tori da ingrasso, V= vitelli a carne bianca).
ALLEVAMENTO
CAT. / RAZZA
PCR +
/ N. CAMP.
COLT. +
/ N. CAMP.
COLT. O PCR +
/ N. CAMP.
1
V. / Incroci polacchi
V. / Incroci polacchi
T. / Incroci polacchi
T. / Charolaise
T. / Charolaise
T. / Incroci francesi
T. / Montbeliarde
T. / Incroci
T. / Limousine
T. / Limousine
T. / Charolaise
6/14
3/7
0/2
1/3
0/3
0/5
2/3
0/5
7/12
2/6
6/7
8/14
6/7
1/2
1/3
0/3
1/5
2/3
0/5
12/12
3/6
6/7
8/14
6/7
1/2
1/3
0/3
1/5
2/3
0/5
12/12
4/6
6/7
27/67 (40.3%)
40/67 (59.7%)
41/67 (61.2%)
2
3
4
5
TOT
13
BOVINI
Large Animal Review, Anno 12, n. 6, Dicembre 2006
02 Luini imp. 18-12-2006 9:43 Pagina 14
14
Mycoplasma bovis in bovini da carne con patologia respiratoria
FIGURA 2 - Tipiche colonie di Mycoplasma bovis su PPLO agar (72 h di
incubazione).
FIGURA 3 - Coltura di Mycoplasma bovis su PPLO agar dopo 7 giorni
di incubazione: Tipica formazione del film.
FIGURA 4 - Risultati della PCR su 33 campioni di tampone nasale. 1-7,
13, 17-19, 21-23, 29, 30 = campioni positivi (26, 27, 28 = reazione debole); 9-13, 15-17, 26, 27, 30-35 = campioni negativi; M = marker molecolare 100 bp; C+ = controllo positivo; B = controlli negativi.
una elevata percentuale di campioni (61,2%). Tale prevalenza è molto elevata ed appare superiore a quella riscontrata in altre indagini in bovini da carne effettuate in Italia
ed in altre nazioni europee13,14,15,16,17. La diffusione così ampia riscontrata nei gruppi sotto osservazione potrebbe essere legata ai sistemi di allevamento praticati in nord Italia
caratterizzati, specie per i vitelli a carne bianca, da alta densità di popolazione e rimescolamento di gruppi di diverse
origini. Poiché, come riferito, molteplici osservazioni di
campo supportano l’evidenza che solo occasionalmente M.
bovis venga isolato in assenza di patologia respiratoria12 e
che pertanto la dimostrazione del microrganismo da tam-
poni nasali sarebbe altamente indicativa di un coinvolgimento del microrganismo in una patologia broncopolmonitica in atto, i nostri risultati suggeriscono una importanza
rilevante di M. bovis nel determinismo delle forme respiratorie negli allevamenti di bovini da carne considerati. Ci ha
sorpreso a tale riguardo la mancata evidenza di un maggiore riscontro clinico nei soggetti con tampone nasale positivo, almeno per quanto concerne la sintomatologia rilevata
nel breve periodo di osservazione di 10 giorni. Ma è noto
che M. bovis determina generalmente fenomeni broncopneumonici ad evoluzione subacuto-cronica, la cui espressione clinica può essere maggiormente rilevabile nel lungo
periodo o addirittura costituire un reperto di macellazione1,2,17. In tali casi l’infezione può essere asintomatica ed arrecare danni semplicemente in termini di minor resa o
maggiore suscettibilità ad altre infezioni batteriche o virali.
Nei gruppi di bovini da noi considerati le forme respiratorie in atto erano verosimilmente di tipo multifattoriale con
il coinvolgimento di M. bovis, molto probabilmente in associazione con altri patogeni virali o batterici comunemente coinvolti che le nostre ricerche, esclusivamente orientate
alla dimostrazione di M. bovis dai tamponi nasali, non hanno consentito di valutare. I rilievi clinici effettuati in relazione al trattamento eseguito con tulatromicina, pur in
considerazione del breve periodo di osservazione utilizzato,
confermano i risultati sulla efficacia di questo farmaco nel
trattamento delle forme respiratorie dei bovini24, anche con
trattamento singolo, non accompagnato dalla somministrazione di antinfiammatori ed altri antibiotici o chemioterapici. Dal punto di vista della diagnosi di laboratorio, la tecnica di prelevamento e di invio al laboratorio con conservazione del campione a -20°C si è dimostrata applicabile in
indagini diagnostiche ed epidemiologiche e suggerisce che
lo stesso campione (tampone nasale in terreno di trasporto)
può essere sottomesso sia ad esame colturale che a PCR,
con evidente vantaggio in fase di prelievo sull’animale. I
nostri risultati hanno evidenziato una maggiore sensibilità
dell’esame colturale, anche se eseguito solo su terreno solido, rispetto alla PCR diretta da noi allestita (59,7% di positivi vs 40,3%). Per scopi diagnostici le tecniche di PCR nested o real-time potrebbero migliorare la sensibilità della
prova19,22. Tali metodologie però non sono ancora alla portata di tutti i laboratori di base (real-time) e presentano
maggiori costi e rischi di contaminazione (nested). La PCR
da noi allestita si è dimostrata sicuramente efficiente nella
identificazione come M. bovis degli isolati di Mycoplasma
in coltura a partire da brodocolture o da sospensioni anche
di poche colonie sviluppate su agar. Riteniamo pertanto
che la praticità ed il basso costo della nostra PCR diretta,
uniti alla comunque buona sensibilità dimostrata anche sui
tamponi nasali, ne consentano un ampio uso nella diagnosi
dell’infezione da M. bovis. Precedenti studi hanno dimostrato infatti che questo metodo può rivelarsi efficace nello
svolgimento di monitoraggi clinico-epidemiologici oltre
che su tamponi nasali, anche su altre matrici quali latte e
tessuti patologici20,21.
Ringraziamenti
Ringraziamo le sig.re Lorenza Sala e Antonia Riboni per
la collaborazione tecnica.
02 Luini imp. 18-12-2006 9:43 Pagina 15
Parole chiave
Mycoplasma bovis, PCR, tulatromicina.
11.
12.
Key words
Mycoplasma bovis, PCR, tulathromycin.
13.
14.
Bibliografia
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
15.
Nicholas RA, Ayling RD. (2003) Mycoplasma bovis: disease, diagnosis, and control. Res Vet Sci.; 74 (2):105-12.
Gevaert D. (2006) The importance of Mycoplasma bovis in bovine respiratory disease. Tijdschr Diergeneeskd. 15; 131(4):124-6. Review.
Dutch.
Adegboye DS, Hallbur PG, Cavanaugh DL, Werdin RE, Chase CC, Miskimins DW, Rosenbusch RF. Immunohistochemical and pathological
study of Mycoplasma bovis-associated lung abscesses in calves. J
Vet Diagn Invest. 1995, 7(3):333-7.
Gagea MI, Bateman KG, Shanahan RA, van Dreumel T, McEwen BJ,
Carman S, Archambault M, Caswell JL. Naturally occurring Mycoplasma bovis-associated pneumonia and polyarthritis in feedlot beef calves. J Vet Diagn Invest. 2006; 18(1):29-40.
Haines DM, Martin KM, Clark EG, Jim GK, Janzen ED. The immunohistochemical detection of Mycoplasma bovis and bovine viral diarrhea
virus in tissues of feedlot cattle with chronic, unresponsive respiratory disease and/or arthritis. Can Vet J. 2001; 42(11):857-60.
Gourlay RN, Thomas LH, Wyld SG. (1989) Increased severity of calf
pneumonia associated with the appearance of Mycoplasma bovis in a
rearing herd. Vet Rec.; 124(16):420-2.
Vanden Bush TJ, Rosenbusch RF. (2002) Mycoplasma bovis induces
apoptosis of bovine lymphocytes. FEMS Immunol Med Microbiol.;
32(2):97-103.
Shahriar FM, Clark EG, Janzen E, West K, Wobeser G. (2002) Coinfection with bovine viral diarrhea virus and Mycoplasma bovis in feedlot
cattle with chronic pneumonia. Can Vet J.; 43(11):863-8.
Rodriguez F., Bryson D.G., Ball H.J., Forster F. (1996) Pathological
and immunohistochemical studies of natural and experimental Mycoplasma bovis pneumonia in calves. J Comp Path, 115:151-162.
Khodakaram-Tafti A, Lopez A. (2004) Immunohistopathological fin-
16.
17.
18.
19.
20.
21.
22.
23.
dings in the lungs of calves naturally infected with Mycoplasma bovis.
J Vet Med A Physiol Pathol Clin Med.; 51(1):10-4.
Radaelli E. (2005) Infezione da Mycoplasma bovis nel bovino: contesti
patologici e meccanismi patogenetici correlati. Large Animal Review,
11 (3), 3-15.
Thomas A., Ball H., Dizier I., Trolin A., Bell C., Mainil J., Linden A.
(2002) Isolation of Mycoplasma species from the lower respiratory
tract of healthy cattle and cattle with respiratory disease in Belgium.
Vet Rec, 151: 472-476.
ter Laak EA, Wentink GH, Zimmer GM. (1992) Increased prevalence of
Mycoplasma bovis in the Netherlands.Vet Q.; 14(3):100-4.
Byrne WJ, McCormack R, Brice N, Egan J, Markey B, Ball HJ. (2001)
Isolation of Mycoplasma bovis from bovine clinical samples in the Republic of Ireland. Vet Rec. Mar 17; 148(11):331-3.
Tschopp R, Bonnemain P, Nicolet J, Burnens A. (2001) Epidemiological study of risk factors for Mycoplasma bovis infections in fattening
calves. Schweiz Arch Tierheilkd.; 143(9):461-7.
Manfrin A., Friso S., Perin R., Girelli L. (1998) Isolation of Mycoplasma spp from cattle in the north-east of Italy. In: Mycoplasmas of ruminants: pathogenicity, diagnostics, epidemiology and molecular genetics volume 2, Eds Leori G., Santini F., Scanziani E., Frey J., 84-87,
European Commission, Brussels.
Loria G.R., Monteverde V., La Barbera E., Caracappa S., Scanziani
E., Grieco V., Ayling R., Nicholas R.A.J. (2004) Isolamento di Mycoplasma bovis e patologia respiratoria. Large Animals Review,
10(5):17-21.
Nicholas R, Baker S (1998) Recovery of Mycoplasmas in animals. In
Mycoplasma protocols; Humana Press; Ed. by Miles R and Nicholas
R; Methods in Molecular Biology Vol 104: 37-44.
Cai HY, Bell-Rogers P, Parker L, Prescott JF. (2005) Development of a
real-time PCR for detection of Mycoplasma bovis in bovine milk and
lung samples. J Vet Diagn Invest.;17(6):537-45.
Stipkovits L, Ripley P, Varga J, Palfi V. 2000 Clinical study of the disease of calves associated with Mycoplasma bovis infection. Acta Vet
Hung; 48(4):387-95.
Hayman B, Hirst R. (2003) Development of a semi-nested PCR for the
improved detection of Mycoplasma bovis from bovine milk and mucosal samples. Vet Microbiol.; 91(2-3):91-100.
Pinnow CC, Butler JA, Sachse K, Hotzel H, Timms LL, Rosenbusch RF.
(2001) Detection of Mycoplasma bovis in preservative-treated field
milk samples. J Dairy Sci.; 84(7):1640-5.
Rozen, S. and Skaletsky, H.J., (2000). Primer3 on the WWW for general users and for biologist programmers. In: Krawetz, S., Misener, S.
(Eds), Bioinformatics Methods and Protocols: Methods in Molecular
Biology. Humana Press, Totowa, NJ, 365-38 Source code available at
http://fokker.wi.mit.edu/primer3/.
EDIZIONI VETERINARIE
Per ordini e informazioni: Tel. 0372/403507 - Fax 0372/457091 - E-mail [email protected] - www.evsrl.it
W. KAHN
STRAW
“Veterinary Reproductive
Ultrasonography - Horse - Cattle Sheep - Goat - Pig - Dog - Cat”
“Diseases of Swine”
riedizione 2004 del 1994 Schlutersche
Listino € 89,00
Scontato € 76,00
KYRIAZAKIS
9/ed. 2006
Blackwell Publishing
Listino € 203,00
Scontato € 172,00
3/ed. 2006
Blackwell Publishing
Listino € 161,19
YOUNGQUIST
“Current Therapy in Large Animal
Theriogenology”
2/ed. 2007
Elsevier-Saunders
Listino € 175,00
Scontato €137,00
Scontato € 149,00
“Whittemore’s Science
and Practice of Pig Production”
15
BOVINI
Large Animal Review, Anno 12, n. 6, Dicembre 2006