didattica attiva
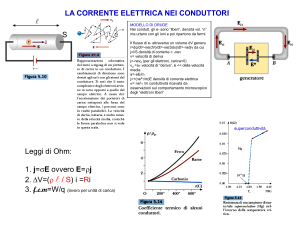
SCIENZE DELLA VITA
approfondimento > Densità dei gas ideali
e dell’aria
La densità è una grandezza derivata che esprime il rapporto tra massa e volume di un corpo: d = m / V. L’equazione di stato dei gas ideali pV = nRT, può essere opportunamente modificata per determinare la densità di un
gas ideale. Il volume V è una grandezza che già compare nell’equazione, la massa m può essere espressa in
funzione di un’altra variabile che compare nella stessa
equazione, cioè il numero delle moli n: m = n · m. m.,
dove m. m. indica la massa molare del gas.
d = m / V = n · m. m. / V
(1)
dall’equazione di stato dei gas ideali si ricava
n / V = p / R T
(2)
e pertanto si può scrivere:
d = m. m. · p / R T
(3)
La relazione (3) indica che la densità di un gas è direttamente proporzionale alla massa molare e alla pressione ed è inversamente proporzionale alla temperatura.
Forti di questa acquisizione, possiamo affrontare un
problema più articolato, cioè quello di determinare la
densità dell’aria. L’aria è una miscela di gas diversi e non
si può pertanto parlare di moli di aria. Tuttavia l’aria è
formata in misura preponderante, ben oltre il 99%, da
tre soli gas, azoto (N2), ossigeno (O2) e argo (Ar). Si tratta
di tre gas che approssimano abbastanza bene il comportamento dei gas ideali, così che possiamo utilizzare la
relazione (3). Determineremo la densità di ciascuno di
questi gas separatamente e poi calcoleremo la media dei
valori ottenuti. Dovremo però tenere conto del fatto che
i tre gas hanno abbondanza diversa e occorrerà «pesare»
di conseguenza i valori di densità calcolati.
Fabio Fantini, Simona Monesi, Stefano Piazzini - Progetto
Poiché la densità dipende da temperatura e pressione, bisogna fissare valori di queste grandezze rispetto ai
quali vogliamo calcolare la densità. Ci possiamo riferire
a condizioni cosiddette normali, per convenzione corrispondenti alla temperatura di 273 K e alla pressione di
101,3 kPa.
Calcoliamo la densità dei tre gas in condizioni normali:
dazoto = 28,02 g mol–1 · 101,3 kPa /
(8,31 kPa dm3 mol–1K–1 · 273 K) = 1,25 g dm–3
dossigeno = 32,00 g mol–1 · 101,3 kPa /
(8,31 kPa dm3 mol–1 K–1 · 273 K) = 1,43 g dm–3
dargo = 39,95 g mol–1 · 101,3 kPa /
(8,31 kPa dm3 mol–1K–1· 273 K) = 1,78 g dm–3
L’aria è costituita da azoto al 78,1%, da ossigeno al
21,0% e da argo allo 0,90% (gli altri gas sono presenti in
tracce). I valori di densità calcolati devono essere mediati moltiplicando ognuna delle densità calcolate per l’abbondanza percentuale di ciascun gas e sommando poi i
valori ottenuti:
daria = 1,25 dm–3 · 78,1 / 100 + 1,43 g dm–3 ·
21,0 / 100 + 1,78 g dm–3 · 0,90 / 100 = 1,29 g dm–3
A partire dal valore trovato, possiamo calcolare la
massa dell’aria contenuta in un locale, ad esempio
un’aula scolastica. È sufficiente calcolare il volume
dell’aula in dm3 e poi moltiplicare il volume per la densità. Un’aula di medie dimensioni è larga 7,0 m, lunga 8,0
m e alta 3,20 m, pertanto il suo volume è circa 180 m3,
cioè 180 · 103 dm3. La massa dell’aria contenuta nell’aula
è quindi 180 · 103 dm3 · 1,29 g dm–1 = 232 · 103 g = 232 kg.
scienze naturali • Italo Bovolenta editore - 2011
1