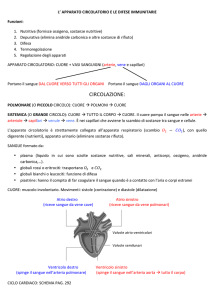
VISUALIZZARE
I CAMPIONI BIOLOGICI
Dott.ssa Valeria Berton
Università di Verona
Campione biologico
Cellule in coltura
1- Rendere il campione
manipolabile
2- Bloccare, «fissare» le condizioni
del tessuto/delle cellule
Tessuto
Passaggio critico 1: Preparazione del campione - Cellule
Bisogna:
1) Dissociare e contare le cellule
2) Piastrarle su una piastra da 24 pozzetti contenente vetrini in vetro
NB: I vetrini necessitano di un substrato, che
consenta l’adesione delle cellule
Gelatina
Poli-D-Lisina
Poli-L-Lisina
Laminina
Bisogna fissare le cellule: Paraformaldeide 4% o Etanolo 95%
Passaggio critico 1: Preparazione del campione - Tessuto
Per i tessuti, ci sono più passaggi
1)
Bisogna fissare i tessuti
2)
Bisogna tagliare in sezioni l’organo che vogliamo analizzare
Fissaggio
Lo scopo è di «congelare» le cellule e l’organizzazione del tessuto come sono in un determinato
momento, così che ogni molecola in quella cellula o in quel tessuto mantenga le sue caratteristiche
durante l’analisi
Tessuti ed organi: Paraformaldeide 4% + Saccarosio 4%
Fissa il tessuto
Crioconservante
Passaggio critico 2: Sezionamento (solo per i tessuti)
Per colorare un tessuto, occorre sezionarlo in fettine molto sottili (di solito circa 25-30 um)
- Criostato : camera fredda a -20°C
- Microtomo : a Temp ambiente o refrigerato
Passaggio critico 2: Sezionamento (solo per i tessuti)
Sezionamente del midollo spinale
2 cm
regione
dorsale
sezioni
longitudinali
regione
ventrale
25 μm
Rat n
Esp X
colorazioni
Colorazioni
Le cellule (in coltura o all’interno del tessuto) sono praticamente prive di colore e trasparenti
Necessario «colorare» le cellule e le macromolecole per poterle visualizzare e studiare
Possono essere:
Specifiche o aspecifiche
Della cellula intera o di una molecola in particolare
Di cellule in coltura o di tessuti
Colorazioni istologiche
Istologia = studio dell’anatomia microscopica di cellule e tessuti animali o vegetali
Tessuto = cellule + matrice extracellulare (+ fluidi extracellulari)
Cellula = diversi organelli e macromolecole
Componenti acidi attraggono sostanze basiche
Componenti basici attraggono sostanze acide
Il DNA attrae?
Le proteine hanno spesso gruppi NH2+
Colorazioni istologiche
Coloranti acidi
Coloranti basici
Sono basofili (attratti dalle basi)
Sono acidofili (attratti dagli acidi)
Colorano strutture acidofile
Colorano strutture basofile
Colorante acido
Colorante basico
Basico -
Acido +
Colorazioni istologiche: acido+base
Ematossilina-Eosina (EE)
Ematossilina colora di blu o nero l’eterocromatina e il citoplasma di cellule ricche di ribonucleoproteine
Eosina colora di rosa/arancione il citoplasma, i muscoli, il tessuto connettivo
http://www.ihcworld.com/royellis/problems/problem25.htm
Colorazioni istologiche specifiche per componenti
Argento
Alcune componenti hanno alta affinità per i sali d’argento, che
vengono trasformati in argento (metallo)
http://fdneurotech.com/serviceItem/0/48/0/764/Tissue_preparation__neurodegeneration_det
ection_with_Gallyas_silver_staining_technique_in_the_brain
Coloranti Sudan
Si dissolvono nei trigliceridi, colorando i lipidi di nero
http://www.gettyimages.it/detail/foto/fat-stained-in-fat-cells-adipose-connective-tissuefotografie-stock/128070040
Colorazioni istologiche specifiche per componenti
Cresyl violet
Colora la sostanza di Nissl nel citoplasma dei neuroni
Luxol Fast Blue
Contiene rame, si lega alle lipoproteine contenute nella mielina
wikipedia
Colorazioni (Luxol, Cresyl Violet, H&E)
1.
Scongelare i campioni (se tessuto)
2.
Disidratazione (Luxol) o idratazione (Cresyl Violet), a seconda del colorante utilizzato
3.
Colorazione (Luxol, Cresyl Violet, EE)
4.
Passaggi di disidratazione
5.
Passaggio finale in Xilene
6.
Montare i vetrini con Entellan
Esempio: il midollo spinale
Esempi: colorazioni su tessuto
EE
Ematossilina: colorante nucleare
Eosina: colorante citoplasmatico
Meningi
Materia
bianca
Materia
grigia
Esempi: colorazioni su tessuto
Luxol Fast Blue Colorante specifico per la mielina
Cresyl Violet Colorante specifico per i neuroni
Meningi
Materia
bianca
Materia
grigia
https://secure.health.utas.edu.au/intranet/cds/histoten/Practi
cals/CHG113%20Semester%201/9.%20Nerve.html
https://www.neurodigitech.com/services/210104.html
Esempi: colorazioni su tessuto
Luxol Fast Blue
Colorante specifico per la mielina
Cresyl Violet Colorante specifico per i neuroni
Rat n
Esp X
Immunolocalizzazione
Immunolocalizzazione: Tecnica che impiega anticorpi specifici per localizzare macromolecole
all’interno di campioni biologici (cellule, tessuti...)
Identificano una particolare macromolecola all’interno di un tessuto/di una cellula
Macromolecole: recettori, proteine, marcatori nucleari… Antigeni
Ogni antigene viene riconosciuto da anticorpi specifici (ABs)
Anticorpi e Antigeni
Antigeni A
Antigeni B
Antigeni
Provengono dall’esterno
Molecola che vengono riconosciute dal sistema immunitario
Anticorpi
Anticorpo A
Anticorpo B
Generati dall’organismo
Riconoscono delle sequenze casuali:
- alcune corrisponderanno a porzioni di batteri, virus etc.
- altre corrisponderanno a sequenze non esistenti
- altre corrispondono a porzioni di molecole presenti
nell’organismo
Anticorpi
Antigeni A
Gli anticorpi legano l’antigene specifico
Reazione immunitaria da parte dell’organismo
Anticorpo A
Attento processo di selezione distrugge gli anticorpi che riconoscono componenti dell’organismo stesso
Anticorpi
Antigeni A
Una data proteina, se presente in organismi di diverse specie, avrà una sequenza e una
struttura simile nelle diverse specie
es. nestina nell’umano sarà simile alla nestina nel ratto, simile alla nestina nel
topo etc.
Simile, ma non uguale!
http://web.expasy.org/sim/
Anticorpo A
Gli anticorpi di un topo non reagiscono alla nestina murina, ma riconoscono come estranea e legano la
nestina di ratto, perchè avrà delle porzioni leggermente diverse
Anticorpi nella ricerca: immunolocalizzazione
Nelle meningi del ratto ci sono cellule staminali neurali?
anticorpo
anti-nestina
anticorpo
anticorpo
anti-nestina anti-nestina
Cellule staminali neurali = nestina
Anticorpo (AB) che si lega alla nestina del
ratto = AB PRIMARIO
nestina
nestina
Meningi
L’anticorpo si lega alla nestina...ma non si vede
Un terzo elemento che mi consenta di vedere al microscopio l’AB che ha legato la nestina
Un altro anticorpo che ha già legato a sè:
Fluoroforo
Cromoforo
Questo secondo anticorpo si chiama AB SECONDARIO
nestina
Immunolocalizzazione
anticorpo
anti-A
anticorpo
anti-A
anticorpo
anti-A
Tessuto
Antigene
A
Antigene
A
Antigene
B
Antigene
B
L’anticorpo anti-A
è detto
PRIMARIO, si lega
direttamente
all’antigene
Antigene
A
Meccanismo alla base di diverse tecniche di immunolocalizzazione:
Immunofluorescenza
Immunoistochimica
Immunofluorescenza (IF)
Fluoroforo
AB secondario
anti-Primario
AB primario
anti-A
Tessuto
Antigene
A
L’anticorpo antiprimario è
chiamato
SECONDARIO, si
lega all’anticorpo
primario
In immunofluorescenza, l’AB secondario è
coniugato ad un fluoroforo
La presenza del fluoroforo consente di
identificare INDIRETTAMENTE l’antigene di
interesse
NB: Esistono anche anticorpi primari già
coniugati ad un fluoroforo
Immunofluorescenza (IF): fluoroforo
Fluoroforo: composto chimico che se eccitato alla corretta lunghezza d’onda, è in gradi di emettere luce
Laser: raggio di luce che trasmette energia al fluoroforo
Gli elettroni del fluoroforo vengono eccitati
Interrompo l’eccitazione del laser
Gli elettroni ritornano allo stato non eccitato
Perdono l’energia accumulata
Emettono luce
https://nanohub.org/resources/19228/watch?resid=19235
Esempi: IF su cellule
Cellule staminali neurali Nestin
Neuroni MAP2
Nuclei TOPRO-3
Precursori degli oligodendrociti NG2
Oligodendrociti immaturi O4
Nuclei TOPRO-3
Esempi: IF su tessuto
Midollo spinale di ratto dopo lesione
Cellule staminali neurali Nestin
Astrociti GFAP
Nuclei TOPRO-3
Cellule della meninge del midollo spinale di ratto dopo lesione
Cellule staminali neurali Nestin
Neuroni immaturi DCX
Nuclei TOPRO-3
Immunoistochimica (IHC)
Ossidazione del
substrato
DAB
HRP
AB secondario
anti-Primario
AB primario
anti-A
Tessuto
Antigene
A
In immunoistochimica, l’anticorpo
secondario è coniugato con l’enzima HRP
La reazione con la molecola DAB permette
l’ossidazione e la colorazione scura del
substrato
HRP: horseradish peroxidase (perossidasi del rafano). Enzima in grado di ossidare dei substrati
DAB: 3,3'-Diaminobenzidina. Quando viene ossidata dall’HRP diventa marrone
Esempi: IHC su tessuto
Neuroni motori
https://www.neuroscienceassociates.com/reference/diseases/approach-als/
Mielina (MBP)
http://www.nordicbiosite.com/products/mbp-bsh-7697-100
Immunolocalizzazione
HRP
Fluoroforo
AB secondario anti-Primario
AB primario anti-A
Antigene A
Campione
Protocollo standard immunofluorescenza
1.
2.
3.
4.
5.
6.
7.
8.
9.
Solo se conservati a – 20°C
Scongelare i campioni
Se sono stati sezionati a basse temperature
Lavare con PBS per eliminare OCT
Blocking solution con BSA, FBS…
Bloccare tutti gli antigeni
Si legherà solo all’antigene specifico, gli altri
Incubazione con AB PRIMARIO
antigeni sono legati dai componenti della
blocking solution (< AFFINITA’)
Eliminare AB primario non legato
Si legherà solo all’AB primario
Incubazione con AB SECONDARIO
Eliminare AB secondario non legato
Colorare il nucleo
Aiuta a mantenere la fluorescenza stabile nel tempo
Montare i vetrini con DABCO
Protocollo standard immunoistochimica
1.
2.
3.
4.
5.
6.
7.
8.
Scongelare i campioni
Lavare con PBS per eliminare OCT
Applicare EtOH-H2O2 per disattivare perossidasi endogena
Bloccare tutti gli antigeni con blocking solution
Incubazione con AB PRIMARIO
Eliminare AB primario non legato
Incubazione con AB SECONDARIO coniugato a HRP
Eliminare AB secondario non legato
32
Protocollo standard immunoistochimica
9. Reazione DAB con substrato HRP
10. Bloccare reazione della con H2O
11. Passaggi di disidratazione
12. Passaggio finale in Xilene
13. Montare i vetrini con Entellan
IMPORTANTE: lasciare asciugare le fettine
50% EtOH – 70% EtOH –
2x 95% EtOH – 100% EtOH
33
Microscopi
La microscopia è la scienza che studia i piccoli oggetti con specifici
strumenti: i Microscopi
Microscopi
A seconda della posizione degli obiettivi, i microscopi possono essere divisi in due
categorie:
- Diretti: la sorgente luminosa e il condensatore sono in basso, lo stage punta verso
l’alto, gli obiettivi sono sopra lo stage e puntano verso il basso
- Invertiti: la sorgente luminosa e il condensatore sono in alto, lo stage punta in
basso, gli onbiettivi sono sotto lo stage e puntano verso l’alto
Microscopi
Ci sono diversi tipi di microscopi:
- Luce trasmessa: luce visibile e con un sistema di lenti che ingrandisce l’immagine
di piccoli campioni
- Fluorescenza:utilizza la fluorescenza per visualizzare e generare immagini del
campione
- Confocale: utilizza dei laser invece della fluorescenza, acquisisce le immagini su
un singolo piano
Altri
- Stereomicroscopio: per microchirurgie e dissezione dei tessuti
- A trasmissione di elettroni: utilizza elettroni invece della luce
36
Microscopio a luce trasmessa
Diretto
Invertito
Microscopio a luce trasmessa
Lente condensatrice
Lampada alogena
Obiettivo
Campione
Oculari
Microscopio a luce trasmessa
Conta cellule
Colorazioni istologiche
Korosi et al., Behav Brain Res 2011
IHC
Microscopio a fluorescenza
Diretto
Invertito
Microscopio a fluorescenza
GFP
RFP
TOPRO-3
41
Microscopio a fluorescenza
Filtro di eccitazione
Oculari
Specchio dicroico
Emissione
Eccitazione
Lampada a
fluorescenza,
con
lunghezza
d’onda
specifica
Filtro di emissione
Campione
Obiettivo
Campione
Microscopio a fluorescenza
Conta cellule con
coloranti fluorescenti
IF
Microscopio confocale
Microscopio confocale
Filtro di eccitazione
Specchio dicroico
Laser
Pinhole di
illuminazione
Filtro di emissione
Obiettivo
Campione
Pinhole di
rilevazione
Oculari
Microscopio confocale
Microscopio confocale
IF su cellule,
antigeni intracellulari
IF su tessuti
Riley, K.C., Woodarda, J.P., Hwanga, G.M.,
Punyasenac, S.W.: Progress towards establishing
collection standards for semi-automated pollen
classification in forensic geohistorical location
applications. Rev. Palaeobot. Palynol. 221, 117–127
(2015). http://dx.doi.org/10.1016
Ricostruzioni 3D
Microscopia Time-lapse
Microscopia Time-lapse consente l’acquisizione di immagini di cellule vive
Il microscopio cattura un’immagine ad intervalli di tempo stabiliti (dall’operatore),
per un dato periodo di tempo (a scelta).
Permette di vedere i movimenti delle cellule in coltura o all’interno di un tessuto
Es. 1 immagine/min, tempo totale: 2 ore
120 immagini