Sintesi - Capitolo 15
Sistemi eterogenei a due componenti puri
(miscele binarie)
Legge di Raoult
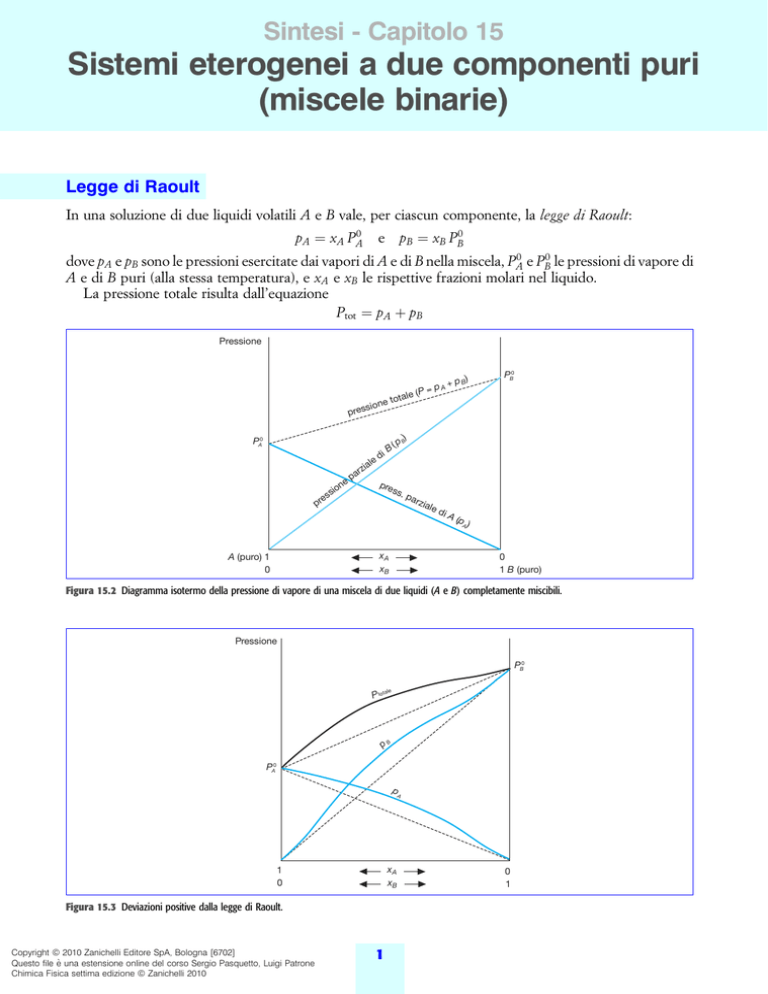
In una soluzione di due liquidi volatili A e B vale, per ciascun componente, la legge di Raoult:
pA xA PA0
e pB xB PB0
dove pA e pB sono le pressioni esercitate dai vapori di A e di B nella miscela, PA0 e PB0 le pressioni di vapore di
A e di B puri (alla stessa temperatura), e xA e xB le rispettive frazioni molari nel liquido.
La pressione totale risulta dall'equazione
Ptot pA pB
Pressione
P=
ale (
PA0
ne
sio
es
pr
e
ial
rz
B
di
PB0
)
(pB
pre
ss.
par
zia
le d
iA
xA
xB
A (puro) 1
0
p B)
e tot
sion
pres
pa
pA +
(p
A)
0
1 B (puro)
Figura 15.2 Diagramma isotermo della pressione di vapore di una miscela di due liquidi (A e B) completamente miscibili.
Pressione
PB0
le
B
p
Ptota
PA0
pA
xA
xB
1
0
Figura 15.3 Deviazioni positive dalla legge di Raoult.
Copyright ã 2010 Zanichelli Editore SpA, Bologna [6702]
Á una estensione online del corso Sergio Pasquetto, Luigi Patrone
Questo file e
Chimica Fisica settima edizione ã Zanichelli 2010
1
0
1
Sintesi ± Capitolo 15 . &bluSistemi eterogenei a due componenti puri (miscele binarie)
Soluzioni ideali e soluzioni reali
La legge di Raoult viene seguita rigorosamente solo dalle soluzioni ideali. Tutte le altre soluzioni, dette
reali, presentano deviazioni positive o negative da essa.
CioÁ eÁ imputabile al fatto che le interazioni che si formano fra le molecole di A e le molecole di B risultano
meno forti o piuÁ forti di quanto lo fossero le interazioni iniziali tra tali molecole nei rispettivi liquidi puri; e
cosõÁ la miscela passa allo stato di vapore piuÁ o meno facilmente.
Regola di Konowaloff
Se per la fase liquida vale la legge di Raoult, per la miscela di vapori vale la legge di Dalton:
pA yA Ptot
e
pB yB Ptot
dove yA e yB sono le frazioni molari di A e di B nel vapore.
Nel vapore, la frazione molare del componente piuÁ volatile eÁ maggiore di quella che dello stesso
troviamo nel liquido (regola di Konowaloff). CioÁ si puoÁ evidenziare quantitativamente confrontando le due
leggi suddette, dalle quali si ricava:
yA
xA PA0
xA PA0 xB PB0
e yB
xB PB0
xA PA0 xB PB0
Diagramma di vaporizzazione
Conoscendo la misura sperimentale delle temperature di ebollizione delle soluzioni a varie composizioni, eÁ
possibile costruire un diagramma di vaporizzazione a pressione costante, dalla tipica forma a lente, che
individua le fasi presenti per ogni composizione e per ogni temperatura.
All'interno della lente coesistono in equilibrio liquido e vapore, le cui proporzioni relative in ogni punto P
della stessa si possono ricavare tramite la regola della leva:
nL PV
nV
PL
dove nL e nV sono i numeri di moli del liquido e del vapore, e PV e PL sono le distanze (a temperatura
costante) del punto P rispettivamente dalla curva del vapore e dalla curva del liquido.
P = costante
Temperatura
Temperatura
VAPORE
ore
ap
lv
e
ad
rv
cu
P = costante
o
uid
q
l li
T1
rva
VAPORE
C
e
or
p
a
lv
P
de V
cu
e
d
rva
cu
T2
L
T1
o
uid
rva
TA0
LIQUIDO
xA
yA
xA
1
TB0
D
liq
el
d
cu
TA0
A
P1
TB0
A
B
0
yA
y1
b)
Figura 15.9 Diagramma di vaporizzazione di due liquidi ideali.
2
xA
xA
1
a)
Copyright ã 2010 Zanichelli Editore SpA, Bologna [6702]
Á una estensione online del corso Sergio Pasquetto, Luigi Patrone
Questo file e
Chimica Fisica settima edizione ã Zanichelli 2010
LIQUIDO
x1
x2 B
0
Sintesi ± Capitolo 15 . Sistemi eterogenei a due componenti puri (miscele binarie)
Miscele zeotrope e miscele azeotrope
Le soluzioni che presentano un diagramma di vaporizzazione isobaro come quello descritto sono dette
zeotrope, mentre quelle che deviano dalla legge di Raoult, dette azeotrope, presentano alcuni minimi o
alcuni massimi nelle temperature di ebollizione.
a)
b)
Temperatura
(°C)
Temperatura
(°C)
78,5 °C
76,8 °C
co m
po
s
co
mp
ap
izio del v
ne
osi
zio
ore
uido
ne del liq
65 °C
el vapore
ed
n
o
i
siz
e del liqu
po
on
ido
i
m
z
si
co
po
m
co
64,7 °C
61,2 °C
56,1 °C
0
CCl4 (puro)
0,385
xetanolo
1
C2H5OH (puro)
0
CH3COCH3 (puro)
0,65
xcloroformio
1
CHCl3 (puro)
Figura 15.13 Diagramma isobaro
P 760 mmHg temperatura di ebollizione-composizione liquido-vapore di miscele: a) etanolo-tetracloruro di carbonio;
b) acetone-cloroformio.
Distillazione in corrente di vapore
A una determinata pressione, quando la composizione corrisponde al massimo o al minimo della
temperatura di ebollizione, la miscela passa interamente da liquida a vapore, comportandosi quindi, sotto
questo aspetto, come un liquido puro.
vapore d’acqua
acqua
distillato
(acqua + sostanza
immiscibile)
miscela contenente la
sostanza da distillare
Figura 15.15 Rappresentazione schematica dell'apparecchiatura per distillazione in corrente di vapore.
Per favorire l'evaporazione di una sostanza altobollente A, magari termolabile, puoÁ rivelarsi utile
aggiungere i vapori di una sostanza ausiliaria inerte B (di solito acqua), che, assieme a quelli della sostanza
di partenza, raggiungano la pressione atmosferica, realizzando una distillazione in corrente di vapore.
Si puoÁ dimostrare che
mA PA0 P:M:A
mB PB0 P:M:B
Copyright ã 2010 Zanichelli Editore SpA, Bologna [6702]
Á una estensione online del corso Sergio Pasquetto, Luigi Patrone
Questo file e
Chimica Fisica settima edizione ã Zanichelli 2010
3
Sintesi ± Capitolo 15 . &bluSistemi eterogenei a due componenti puri (miscele binarie)
da cui si capisce l'utilitaÁ dell'impiego dell'acqua: essa, avendo PB0 e P:M:B piuttosto bassi, permette di
ottenere un alto valore di mA =mB e un distillato ricco del componente desiderato.
Legge di Henry
Quando il soluto eÁ un gas non reattivo, vale la legge di Henry:
[gas] K pgas
dove [gas] eÁ la concentrazione del gas nel liquido, pgas la sua pressione parziale sopra la soluzione, e K la
costante di Henry, che dipende dalla natura del gas e dalla natura del liquido a una certa temperatura.
Se pgas 1 atm e [gas] eÁ espressa in mL di gas nelle condizioni normali (0 8C e 760 mmHg) sciolti in
1 mL di liquido alla temperatura dell'esperienza, K prende il nome di coefficiente di assorbimento.
Copyright ã 2010 Zanichelli Editore SpA, Bologna [6702]
Á una estensione online del corso Sergio Pasquetto, Luigi Patrone
Questo file e
Chimica Fisica settima edizione ã Zanichelli 2010
4










