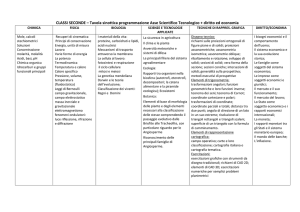
COMPOSTI INORGANICI
COMPOSTI DI UN ELEMENTO CON OSSIGENO O/E IDROGENO
gruppo
Composti con
ossigeno
I
II
III
Nomenclatura
OSSIDI (BASICI)
OSSIDI (ANFOTERI)
Solidi ionici o
covalenti
OSSIDI ACIDI o
ANIDRIDI
Ossido
(o anidride)
Molecole gasssose
M2O
M2O3
M2O5
M2O7
ACIDI
(OSSIACIDI)
ipo-..-oso (a)
...-oso (a)
-ico (a)
per-...-ico (a)
Idrossido
o acido
in acqua -> H+
n=1
-> HMO
-> HMO2
-> HMO3
-> HMO4
ipo-..-oso
...-oso
(meta) ...-ico
per-...-ico
MO
M 2O 3
(MO)
MO2
n=3
IDROSSIDI
ANFOTERI
in amb. basico -> H+
in amb. acido -> OHn=1
n=1
IDROSSIDI O
BASI
in acqua -> OHn=1
- >2 MOH
stechiometria
idruri
VII
NON-METALLI
M2O
Composti con
idrogeno (Idruri)
VI
SEMIMETALLI
stechiometria
ossidi (o anidridi)
+ n H 2O
V
METALLI
Solidi ionici
Ossidi + acqua
IV
IDRURI IONICI
(M+ H-)
Solidi ionici
MH
n=1
-> M(OH)2
-> 2 M(OH)3
(o 2 H3MO3)
M2O3
M2O5
(MO)
MO2
MO3
n=1
-> H2MO3
-> 2 HMO2
-> 2 HMO3
-> H2MO3
-> H2MO4
n = 1.5
n=2
-> 0.5 H6Si2O7
n=2
-> H4M2O7
n=3
(piro) ....-ico
-> M(OH)4
(o H4MO4)
IDRURI
COVALENTI
Molecole gassose
-> 2 H3MO4
(orto)...-ico
ACIDI
(IDRACIDI)
H+ M -
MH2
MH3
MH4
MH3
H2M
HM
Idruro ...-ico
.....-ano
....-ina
acido ....idrico
COMPOSTI CON DUE ELEMENTI (+ O e H): SALI
ACIDO + IDROSSIDO = SALE + H2O
Esempi:
Fe(OH)2 + 2 HNO3 -> Fe(NO3)2 + 2 H2O
Ca(OH)2 + 2 HClO -> Ca(ClO)2 + 2 H2O
Nomenclatura
acido
Nel sale:
Nel sale:
Nomenclatura
idrossido
Ossiacido:
ipo-..-oso
...-oso
...-ico
per-...-ico
Idracido:
ipo-......-ito
.......-ito
.......-ato
per-.......-ato
...-oso
....-ico
...-oso
....-ico
.......-idrico
........-uro
Es. Fe(NO3)2 = NITRATO FERROSO
Ca(ClO)2 = IPOCLORITO CALCICO
NOMENCLATURA INORGANICA:
LE LEGHE METALLICHE
Leghe: solidi di natura metallica contenenti piu di un elemento.
Tipi di leghe:
1. Polifasiche
Es. lega (eutettico)
Sn-Pb per i contatti elettrici
lega Na-K per i circuiti di raffreddamento delle centrali
nucleari
2. Monofasiche:
2a) Soluzioni solide:
2a1) Soluzioni solide di sostituzione
Es. Ottone (lega Cu-Zn)
Bronzo (lega Cu-Sn)
- si hanno tra metalli con proprietà simili e simili dimensioni
atomiche.
2a2) Soluzioni solide interstiziali. Es.Ferrite, austenite (negli acciai: Fe-C)
- tra elementi molto diversi (un metallo e un non metallo)
2b) Composti intermetallici:
2b1) Stechiometrici (in accordo con le leggi della valenza) Es. Siliciuro di
magnesio SiMg2
2b2) senza regole di valenza ( a volte con stechiometria variabile).
Es. Cementite Fe3C (negli acciai)
ALTRI COMPOSTI DI NATURA COVALENTE O METALLICA
(tra elementi semimetallici o metallo + semimetallo):
Boruri, Carburi, Nitruri, Siliciuri, etc... (di solito in accordo con le regole della valenza, ma non
sempre)
SPECIE GASSOSE
1. ATOMI ISOLATI (Gas nobili)
2. MOLECOLE GASSOSE
a. Legame covalente puro (atomi uguali: H2, O2, N2, F2, Cl2, O3, P4, S8, ...)
b. Legame covalente polare (HF, HCl, NO, CO2, N2O3,...)
c. Legame dativo
STATO SOLIDO
a) dal punto di vista “geometrico:
1. cristallini (ordine tridimensionale)
2. amorfi (disordine)
b) dal punto di vista del legame chimico:
1. Solidi atomici (gas nobili solidificati). Molto volatili, isolanti elettrici.
2. Solidi molecolari (H2 solido, O2 solido, ghiaccio o acqua solida, etc.,
polimeri, cere, etc.) Di solito volatili, ma dipende dal peso molecolare, di solito
isolanti elettrici ma qualche volta conduttori anisotropici (grafite e polimeri
conduttori).
3. Solidi covalenti (diamante, silice e vetri, ..). Reticolo tridimensionale
infinito di legami covanti puri o polarizzati (anche dativi). Isolanti o al più
semiconduttori, poco volatili.
4. Solidi ionici (NaCl, quasi tutti i sali). Isolanti o al più semiconduttori, poco
volatili. Possono contenere “molecole-ioni“.
5. Solidi metallici. Conduttori di calore e corrente elettrica. Lucentezza
metallica a causa della riflessione della luce. Legame metallico. Metalli puri o leghe.
I casi 1 e 2 sono tenuti insieme dalle “interazioni deboli”.
Nei casi 3, 4 e 5 la molecola non esiste. Si può parlare formalmente di molecola
ma si intende con questo solo una relazione stechiometrica.
CELLE ELEMENTARI DELLE PRINCIPALI STRUTTURE CRISTALLINE DEI METALLI
Cubica a corpo centrato
BCC
Cubica a facce centrate
FCC
esagonale compatta
HCP
CONDUCIBILITA’ ELETTRICA
Legge di Ohm:
I = V/R
dove
I = intensità di corrente elettrica in A (ampères)
V = differenza di potenziale, in V (volts)
R = resistenza elettrica, in (ohms)
La resistenza elettrica dipende dalle proprietà del materiale e dalla geometria del conduttore:
R = l /S
l = lunghezza (m)
S = sezione (m2)
= resistività (.m)
=1/
= conduttività (-1.m-1)
CONDUTTIVITA’ DI ALCUNI MATERIALI A TEMPERATURA AMBIENTE
(-1.m-1)
107 -1.m-1
107
107
107
Eg (eV)
argento
rame
oro
alluminio
6.3
5.8
4.2
3.4
0
0
0
0
grafite
magnetite Fe3O4
Si drogato
105
105
1 103
germanio
silicio
ematite -Fe2O3
2.2
4.3 10-4
10-8
0.7
1.1
2.0
porcellane, silicati
10-11 10-13
4-7
polietilene e polistirene
diamante
10-14
10-14
CONDUTTORI
SEMICONDUTTORI
ISOLANTI
6.0