IGIENIZZANTI DI SINTESI:
SONO LA SCELTA GIUSTA?
VERITÀ BIOLOGICHE DI MASSA: DALLA PUBBLICITÀ
ALL’ANALISI SCIENTIFICA
Altea Lippmann, lavoro di maturità 2013/2014, Liceo Lugano 1
Docente: prof. Luca Paltrinieri
2
INDICE
pagina
1. PREMESSA...............................................................................................................................5
2. RINGRAZIAMENTI ...................................................................................................................5
3. ABSTRACT ..............................................................................................................................6
4. INTRODUZIONE .......................................................................................................................7
4.1. I MICRORGANISMI ............................................................................................................7
4.1.1. I BATTERI ..................................................................................................................8
4.2. GLI IGIENIZZANTI ...........................................................................................................10
4.3. LE ALTERNATIVE NATURALI ..........................................................................................14
4.4. I MICRORGANISMI EFFETTIVI .........................................................................................15
5. MATERIALI E METODI ...........................................................................................................18
5.1. INTRODUZIONE GENERALE .............................................................................................18
5.2. PARTE SPERIMENTALE ...................................................................................................19
5.2.1. ANTIBIOGRAMMI ....................................................................................................19
5.2.2. ESPERIMENTO SULL’EFFICACIA REALE DEGLI IGIENIZZANTI ...................................22
6. DISCUSSIONE ........................................................................................................................26
7. CONCLUSIONI .......................................................................................................................28
BIBLIOGRAFIA ..........................................................................................................................29
GLOSSARIO E ABBREVIAZIONI ..................................................................................................31
ALLEGATI .................................................................................................................................33
3
4
1. PREMESSA
Le ragioni che mi hanno spinta a incentrare il mio lavoro di maturità (LAM) sulla lotta ai
microrganismi sono nate principalmente da una curiosità personale e da una tesi che vorrei
verificare: mi sono chiesta quali fossero gli effetti degli igienizzanti antibatterici sui batteri
stessi e a quali possibili rischi potessero esporre la salute dell’uomo. Per questa ragione ho
scelto di sfruttare l’occasione datami dal LAM per approfondire l’argomento nella speranza di
trovare una risposta alle mie domande.
Devo ammettere che la scelta del tema da trattare non è stata subito indirizzata in questa
direzione, ciononostante, dopo aver valutato pro e contro di tutte le altre possibili tematiche,
che spaziavano veramente in campi del tutto diversi da quello della microbiologia, mi sono
finalmente decisa. Posso ritenermi soddisfatta della scelta effettuata, perché ritengo
l’argomento molto intrigante e inerente alla vita di ogni giorno: dobbiamo tutti convivere con
microrganismi di ogni genere. Il punto è: come vogliamo affrontare questa coesistenza?
Attraverso il suddetto lavoro di maturità vorrei anche poter aprire gli occhi alla gente
sull’importante questione degli igienizzanti di sintesi, che spesso sono utilizzati in
abbondanza senza pensare al fatto che potrebbero esserci delle conseguenze.
Quello che vorrei verificare è, appunto, se è davvero un bene farne un così largo uso o se
sarebbe meglio lasciarli da parte, o per lo meno ricorrere a qualche alternativa.
2. RINGRAZIAMENTI
Desidero ringraziare tutti coloro che mi hanno aiutata nella realizzazione del suddetto
lavoro di maturità, attraverso preziosi suggerimenti, critiche e osservazioni.
La mia gratitudine va innanzitutto al professor Luca Paltrinieri, docente responsabile del
LAM, per avermi indirizzata nella scelta del tema e nella ricerca di informazioni, nonché per
le numerose ore dedicate alla correzione e alla revisione del mio lavoro. Proseguo
ringraziando sentitamente Livio e Alba Baruscotti per la disponibilità, l’aiuto e il sostegno
datomi durante lo svolgimento della parte sperimentale. Un ringraziamento particolare va,
inoltre, alla professoressa Paola Ciceri Matt per la sua disponibilità e per avermi aiutata a
chiarire diversi dubbi. Mi rivolgo poi a ringraziare il Dr. Maurizio Molinari, per avermi
fornito articoli indispensabili per la realizzazione del lavoro, e la Dr.ssa Nadia Maggi Solcà e
il Dr. Claudio del Don per gli importanti suggerimenti riguardanti il protocollo sperimentale.
Infine, volgo la mia riconoscenza alle persone a me più care, specialmente ai miei genitori e ai
miei amici, che mi hanno incoraggiata e sostenuta durante tutto questo anno di lavoro o che
hanno speso parte del proprio tempo per leggere e discutere con me le bozze del LAM.
5
3. ABSTRACT
Un tema d’attualità molto discusso, che ha peraltro dato origine a diverse ipotesi
sull’igiene, è senza dubbio quello inerente il sempre crescente uso di igienizzanti di sintesi in
vari ambiti, quali la pulizia dell’ambiente domestico, della persona e, talvolta, la disinfezione
dell’acqua e degli alimenti.
Lo scopo del presente lavoro di maturità è di approfondire l’argomento considerando i pro
e i contro dell’impiego di tali sostanze, al fine di stabilirne l’efficacia e l’idoneità d’utilizzo.
Alla ricerca bibliografica è stata affiancata una duplice parte sperimentale che ha
permesso, nei suoi limiti, di attestare l’efficacia assoluta e relativa degli igienizzanti attraverso
il ricorso a due tecniche d’analisi: gli antibiogrammi (in vitro) e dei prelevamenti di batteri da
piastrelle (in vivo). Prendendo in esame tre sostanze diverse – un igienizzante a base di
ipoclorito di sodio (come la candeggina o l’Amuchina), l’etanolo al 90% e il Tea tree oil (olio
essenziale di Melaleuca alternifolia) – si sono potute confrontare le loro proprietà battericide:
l’igienizzante si è rivelato efficace sia in vitro che in vivo, ma solo a breve termine, infatti già
dopo poche ore i batteri hanno ripreso a crescere; l’etanolo, invece, in vitro non ha dato prova
di un alto potere antibiotico, ma in vivo si è dimostrato abbastanza efficace; infine, il Tea tree
oil si è rivelato essere il più efficace in vitro, mentre in vivo ha mostrato un esito mediocre ma
prolungato nel tempo.
Per quanto riguarda l’analisi delle possibili conseguenze che comporta l’uso di prodotti
igienizzanti ci si è preoccupati di analizzare le fonti bibliografiche e si è potuto concludere,
pur non arrivando ad esprimere un dato quantitativo preciso, che l’eccessiva igiene, al
contrario dell’immaginario comune, non giova alla salute ma può avere anche gravi effetti
collaterali, quali lo sviluppo di malattie allergiche.
Gli igienizzanti di sintesi, inoltre, aumentano la probabilità di contrarre disfunzioni
cardiorespiratorie e immunitarie, nonché tumori.
6
4. INTRODUZIONE
Il tema principale del presente LAM riguarda gli igienizzanti di sintesi nella loro specifica
azione antibatterica; tuttavia, non è possibile parlare di igienizzanti senza prima essere al
corrente di quali siano i bersagli della loro azione. Per comprendere al meglio l’argomento è
pertanto necessaria una breve introduzione alla microbiologia e, più nello specifico, al mondo
dei batteri.
4.1. I MICRORGANISMI
La microbiologia è una disciplina scientifica che studia i microrganismi, vale a dire
minuscoli esseri viventi unicellulari, visibili unicamente al microscopio, che comprendono
batteri, funghi, protozoi, alghe e virus. I microbi esercitano un ruolo fondamentale nei cicli
naturali della biosfera e contribuiscono a mantenere l’equilibrio tra vita e morte. Non per
niente chiamati così, i microrganismi sono delle piccole unità strutturali con diversi livelli di
organizzazione, che permettono loro di svolgere processi metabolici anche molto complessi.
Lo scopritore e padre della microbiologia fu il mercante e scienziato olandese Antoni van
Leeuwenhoek (1632-1723), che perfezionò i primi microscopi, attrezzi che nel 1677 gli
permisero di fare la scoperta dei cosiddetti animalcules, piccoli animali in seguito definiti
microrganismi.
La questione che sopraggiunse in seguito alla scoperta di Leeuwenhoek riguardò l’origine
di questi minuscoli esseri.
Nel 1765 Lazzaro Spallanzani fece bollire del brodo e, dopo averlo sigillato, notò che non
vi comparvero microrganismi. Grazie a questo esperimento Spallanzani confutò la teoria della
generazione spontanea, che sosteneva che i microrganismi si potessero generare dal nulla, e
documentò sperimentalmente la teoria biogenetica, che, al contrario, affermava che solo dei
microbi possono dar origine ad altri microbi. Tuttavia, affinché la teoria dell’abiogenesi
venisse abbandonata a favore di quella della biogenesi, ci volle l’intervento di uno dei più
grandi microbiologi, il chimico francese Louis Pasteur (1822-1895), il quale dimostrò,
attraverso un esperimento simile a quello di Spallanzani, la responsabilità dei microrganismi
nel processo di decomposizione organica.
Oggi la microbiologia ha raggiunto un’importanza indescrivibile per spiegare molti
processi in cui sono implicati i microrganismi e per riuscire a utilizzarli allo scopo. I microbi
sono, infatti, largamente usati nell’industria alimentare, biomedica, elettronica, aerospaziale,
ambientale e biotecnologica. Tuttavia, per quanto alcuni possano risultare benefici per
l’uomo, non bisogna dimenticare che esistono anche microrganismi patogeni, causa di molte
gravi malattie.
I microrganismi sono distinguibili in due grandi gruppi: i microrganismi eucarioti –
funghi, alghe e protozoi – dotati di un nucleo e caratterizzati da un’organizzazione cellulare
simile a quella delle cellule animali e vegetali; e i microrganismi procarioti – batteri – privi di
un nucleo circoscritto da una membrana nucleare e delle strutture tipiche delle cellule
eucariote. I virus (Iwanowsky, 1892) sono classificati a parte poiché sono attivi
biologicamente solo se in contatto con una cellula ospite, quindi non si possono considerare
veri e propri esseri viventi.
L’importanza dei microrganismi è riscontrabile anche a livello evolutivo: inizialmente
sulla terra esistevano unicamente forme di vita unicellulari, che poi, col passar del tempo, si
sono aggregate per dare vita a esseri pluricellulari più complessi.
Un’ulteriore distinzione dei microrganismi può esser fatta in base al loro metabolismo:
quelli che vivono in presenza di diossigeno sono detti aerobi, mentre quelli che non lo esigono
7
sono detti anaerobi. Esistono poi microbi aerobi o anaerobi facoltativi, che possono cioè
vivere in entrambe le condizioni.
Per soddisfare il loro fabbisogno nutrizionale, alcuni microrganismi sono in grado di
metabolizzare l’azoto e l’anidride carbonica atmosferici, quindi non dipendono da altri
organismi e sono chiamati autotrofi; gli altri sono eterotrofi, o parassiti, poiché vivono a
carico di altri esseri viventi.
Sulla Terra circa l’87% dei microbi risulta utile all’ambiente. Tra questi, oltre agli
autotrofi, troviamo i saprofiti, che decompongono materiali organici provenienti da animali o
vegetali morti. Dei microrganismi conosciuti, i patogeni, ossia quelli che arrecano danno
all’ospite, rappresentano soltanto il 3%; mentre il restante 10% è considerato opportunista,
capace quindi di assumere carattere patogeno solo in determinate condizioni ambientali,
diverse da quelle dov’è abituato a vivere.
4.1.1. I BATTERI
Il presente lavoro di maturità sarà incentrato sulla batteriologia, la branca della
microbiologia che si concentra sullo studio dei batteri, esaminando la loro presenza
nell’ambiente, negli animali e nei vegetali e l’azione che svolgono: alcuni sono la causa di
malattie; altri decompongono rifiuti organici; altri ancora – i simbionti – partecipano a
processi fisiologici di animali e piante, come la digestione di alimenti o la trasformazione
metabolica di altre sostanze nutritive.
Oltre alla batteriologia, le altre sottodiscipline della microbiologia sono rappresentate da:
l’immunologia, che studia i meccanismi difensivi dell’ospite nei confronti di un patogeno;
l’algologia, che si occupa dello studio delle alghe, del loro funzionamento e dei loro possibili
impieghi; la micologia, che si concentra su funghi e miceti e sui loro utilizzi industriali o sui
danni che possono provocare; la protozoologia, che studia i protozoi e i loro effetti sull’uomo
(ad esempio possono causare malattie come la malaria, la dissenteria amebica e la
toxoplasmosi); e, infine, la virologia, che prende in considerazione unicamente i virus e le
malattie, spesso anche gravi, causate ad animali e vegetali (come per esempio l’AIDS).
Il primo passo da fare se ci si vuole addentrare nel complicato mondo del microcosmo è
cominciare a suddividere i microrganismi in diversi gruppi e classi. Vi sono diverse
possibilità di classificazione dei batteri, molte delle quali sono estremamente complesse,
motivo per cui, qui, saranno accennate solo alcune delle più comuni.
Come già visto, una prima suddivisione dei microrganismi si può individuare tra eucarioti
(funghi, protozoi e alghe), procarioti (batteri) e virus; dopodiché, si può procedere con la
classificazione dei batteri, a livello funzionale, secondo la loro forma e il loro stadio di
aggregazione.
I batteri sferici sono detti cocchi ma, sotto forma di colonia, sono chiamati in modi diversi:
• diplococchi (a coppia);
• tetradi (quattro cocchi raggruppati);
• sarcine (otto cocchi disposti a forma di cubo);
• streptococchi (a catena);
• stafilococchi (a grappolo).
Esistono poi batteri dalla forma cilindrica, detti bacilli (o coccobacilli se molto corti e
simili a un cocco). Anche i bacilli si possono trovare in forme di aggregazione diverse
denominate analogamente (diplobacilli e streptobacilli).
8
Se i batteri hanno una forma incurvata si tratta di vibrioni, se hanno due o più curvature
lungo l'asse maggiore sono spirilli, mentre se sono a forma di spirale (come un cavatappi)
sono spirochete.
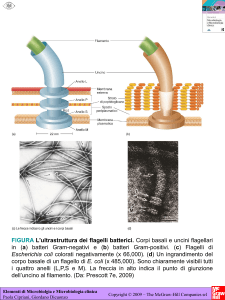
Figura 1. Le diverse forme di batteri.
Immagine tratta da: www.ppdictionary.com/bacteria/gnbac/bacteria_shapes.jpg.
Considerando che la capacità di risoluzione dell’occhio umano é di circa 0,1mm, le ridotte
dimensioni dei microrganismi (un batterio misura da 0,2µm a 30µm) ne rendono
l’osservazione e lo studio strettamente dipendente da tecniche e strumenti specifici.
Innanzitutto, l’unico modo per visualizzarli è attraverso un microscopio, che può essere ottico
o elettronico. Quelli del primo tipo sono in grado di ingrandire un oggetto fino a 1000-1500
volte, quindi permettono l’osservazione di cellule batteriche, miceti e protozoi; mentre quelli
del secondo tipo consentono di vedere anche piccoli virus.
Tuttavia, essendo trasparenti alla luce, i batteri sono difficilmente osservabili mediante la
diretta osservazione al microscopio, sia esso ottico o elettronico. La colorazione di Gram ha
permesso di ovviare a questo problema e ha reso possibile la visione dei microrganismi al
microscopio.
Nel 1884 il ricercatore danese Hans Christian Gram, nel tentativo di individuare dei
microorganismi nei tessuti infetti, ha messo a punto una tecnica di colorazione che si rivelò
molto utile in diagnostica per la messa in evidenza di strutture procariotiche fondamentali.
A dipendenza del colore che assumono, i batteri si possono distinguere in due gruppi:
Gram-positivi, che si presentano blu/viola, e Gram-negativi, che appaiono rosa/rosso.
I batteri vengono inizialmente colorati con il violetto di genziana, colorante che penetra
nel citoplasma, e in seguito vengono decolorati con l’alcol-acetone.
I batteri Gram+ presentano una parete cellulare formata da uno spesso strato di
peptidoglicano, nel quale sono inseriti acidi teicoici, monosaccaridi e aminoacidi. Questo tipo
di composizione fa della parete cellulare una struttura polare, che quindi si oppone al
passaggio di molecole idrofobiche attraverso la stessa.
Diversamente, i batteri Gram–, oltre alla membrana cellulare, hanno due involucri esterni:
una parete cellulare costituita da uno strato più sottile di peptidoglicano e una membrana
esterna formata da fosfolipidi, proteine e lipopolisaccaridi; il doppio strato è tenuto assieme
da lipoproteine.
I lipopolisaccaridi, presenti sulla membrana esterna dei batteri Gram–, hanno tre regioni: il
lipide A, che rappresenta un endotossina, sostanza capace di scatenare una risposta
immunitaria nell’organismo ospite; il nucleo polisaccaridico e la catena laterale, che
costituisce l’antigene.
La membrana esterna ha un ruolo di controllo sulla permeabilità a determinate sostanze
attraverso la parete cellulare dei batteri Gram–.
9
Il meccanismo di funzionamento della colorazione di Gram è proprio basato sulla
differenza di permeabilità delle pareti cellulari dei due gruppi batterici: nei Gram+ il
cristalvioletto e lo iodio riescono a penetrare separatamente, data la loro idrofilia, ma, una
volta formato, il complesso colorante-iodio non sarebbe più in grado di attraversare la parete
perché idrofobo, facendo così mantenere al battere la colorazione primaria. Nei Gram–,
invece, l’alto tenore lipidico della membrana esterna conferisce alla parete cellulare maggiore
permeabilità al complesso idrofobo, che quindi, con l’aggiunta del decolorante, riesce a
uscire. A questo punto, per esser resi visibili, i batteri devono poi esser colorati con la fucsina,
la quale dà loro un aspetto rosa, senza però alterare il viola dei Gram+.
Le due particolari strutture delle pareti cellulari batteriche conferiscono quindi alla cellula
maggiore o minore permeabilità a determinate molecole, che possono essere coloranti ma
anche antibiotici. Per questo motivo una sostanza antibiotica potrebbe distruggere una cellula
batterica Gram+ ma lasciarne intatta una Gram–, o viceversa. Generalmente i Gram– sono più
resistenti grazie ad enzimi presenti nel periplasma in grado di attaccare e distruggere alcuni
tipi di molecole antibiotiche (Sanders C.C. & Sanders Jr. W.E, 1992).
Figura 2. Differenze strutturali tra la parete cellulare dei batteri Gram-positivi e quella dei batteri Gram-negativi.
Immagine tratta da: www.pc.maricopa.edu/Biology/rcotter/BIO%20205/LessonBuilders/Chapter%204%20LB/c
ow95289_04_14.jpg.
4.2. GLI IGIENIZZANTI
Ogni giorno media ed esperti continuano a spingere la gente ad acquistare prodotti
igienizzanti per la disinfezione personale e dell'ambiente, creando così un enorme giro d'affari
attorno a queste sostanze. Ma sono davvero efficaci come vengono pubblicizzate? E
soprattutto sono realmente necessarie per la nostra salute?
La maggior parte degli igienizzanti presenti sul mercato sono a base di ipoclorito di sodio
(NaClO), il sale sodico dell'acido ipocloroso (HClO), che in poche parole consiste in un
prodotto estremamente aggressivo a base di cloro. In questa categoria di prodotti rientrano i
più comunemente usati, come la candeggina, la varechina e l'Amuchina.
10
Quando una soluzione di ipoclorito di sodio entra in contatto con delle cellule batteriche
può dare origine a diverse reazioni chimiche che stanno alla base della sua azione battericida.
A titolo d’esempio, qui di seguito sono espresse alcune di queste reazioni, nelle quali è
evidente l’alterazione strutturale di molecole organiche provocata dall’acido ipocloroso
presente nelle soluzioni acquose di ipoclorito di sodio.
H2O
NaClO ↔ Na+ + ClO–
ClO– + H2O ↔ HClO + OH–
Equazione 1. Equilibrio chimico di una soluzione acquosa di ipoclorito di sodio. Riga 1: dissociazione
dell’ipoclorito di sodio nei suoi due ioni costituenti; riga 2: reazione di idrolisi basica provocata dagli ioni
ipoclorito.
CH3
CH3
CH3
│
│
│
R─C─COO– + HClO → R─C─COO– → → → R─C
│
│
║
NHCl
O
NH2
aminoacido
acido
ipocloroso
cloramina
chetone
Equazione 2. Reazione di cloraminazione: un aminoacido reagisce con acido ipocloroso per produrre una
cloramina, molecola altamente instabile che poi si degrada dando origine a chetoni.
fosfolipide
acido
ipocloroso
fosfolipide alterato
Equazione 3. Reazione di ossidazione di un fosfolipide.
In acqua l’ipoclorito di sodio si dissocia nei suoi due ioni costituenti (Na+ e ClO–) uno dei
quali, lo ione ipoclorito (ClO–), dà idrolisi basica, provocando un rilascio di ioni idrossido
(OH–) e un conseguente aumento del pH (Equazione 1).
L’attività germicida dell’ipoclorito di sodio è dovuta alla capacità dell’acido ipocloroso e
degli ioni ipoclorito di attraversare la parete e la membrana cellulare. Si crede che il
meccanismo d’azione dell’ipoclorito di sodio sia basato sull’inibizione enzimatica, su
alterazioni della membrana plasmatica e del DNA e, probabilmente, su danni alle proteine di
trasporto.
Sia l'acido ipocloroso che gli ioni ipoclorito sono forti agenti ossidanti in grado di reagire
chimicamente con diverse molecole biologiche. Tra le più suscettibili ad alterazione troviamo
proteine, aminoacidi, peptidi, lipidi e basi azotate, ossia molecole che presentano
insaturazioni, legami peptidici, gruppi amminici o tioli.
Gli ioni ipoclorito – elettricamente carichi e idrofili – non sono in grado di penetrare la
membrana cellulare a causa del tenore idrofobo del doppio strato fosfolipidico, dunque la loro
azione è limitata all’esterno della cellula. L’acido ipocloroso – elettricamente neutro – è
11
invece capace di diffondere nel citoplasma batterico arrecando un doppio danno: in primo
luogo può ossidare le componenti della membrana, in più può alterare il DNA e i processi
metabolici del batterio (Fukuzaki, 2006).
Per quanto riguarda l’interazione tra l’acido ipocloroso e le membrane cellulari
(Equazione 3) si crede che l’ossidazione dei fosfolipidi causata dall’acido possa alterare la
struttura stessa della membrana, destabilizzandola, aumentandone la permeabilità e
diminuendone la fluidità (Van den Berg et al.,1993). Inoltre, quando l’acido ipocloroso entra
in contatto con una proteina di membrana o con un enzima si suppone possa dare origine a
reazioni di cloraminazione (Equazione 2), vale a dire che potrebbe provocare la clorazione del
gruppo amminico di un aminoacido portando alla degradazione ossidativa dell’enzima o della
proteina stessi (Slates et al., 1964).
Una volta nel citoplasma, l’acido ipocloroso potrebbe anche causare un abbassamento del
pH intracellulare accompagnato da un rilascio di protoni (ioni idrogeno H+). Per mantenere
constante il gradiente protonico, la cellula dovrebbe estrudere ioni idrogeno attraverso la
pompa ATPasi, la quale richiede l’idrolisi di molecole di ATP. Di conseguenza si avrebbe una
riduzione di energia chimica disponibile e quindi un rallentamento del metabolismo cellulare
(Fukuzaki et al., 1990, in Fukuzaki, 2006).
In ogni caso, la principale attività antibatterica dell’ipoclorito di sodio è attribuita alla sua
azione ossidativa su molecole organiche piuttosto che alla riduzione della disponibilità di
ATP per la cellula.
Effettivamente, data la sua molteplice azione, l'ipoclorito di sodio distrugge il 99% dei
batteri, senza però fare alcuna distinzione. Considerando che la gran parte dei batteri presenti
nel nostro corpo contribuisce alle funzioni vitali dell'organismo, risulta evidente come l'uso
eccessivo di questa sostanza possa, eliminando anche i batteri "buoni", causare problemi di
salute e malattie. Sulla pelle, per esempio, ci sono molte specie batteriche che contribuiscono
alla protezione del corpo da altri agenti patogeni; pertanto, distruggendo questi batteri si
espone maggiormente il corpo ad aggressioni esterne, abbassandone le difese dovute,
appunto, a questi piccoli esseri. Per fare un altro esempio si può anche vedere cosa succede
all'interno del corpo se vengono ingerite anche solo minime tracce di ipoclorito di sodio:
come ha affermato il Dr. Mauro Damiani, dottore in chimica ed esperto in igiene degli
alimenti, le soluzioni per la disinfezione degli alimenti possono provocare danni alle
membrane dell'apparato digerente e all'importantissima flora batterica intestinale, dai quali ne
conseguono problemi alla digestione.
Ma, oltre a rendere l'organismo più vulnerabile, gli igienizzanti sono anche molto
aggressivi: sono stati associati a malattie delle vie respiratorie, quali forme asmatiche. Uno
studio effettuato dalla Division of Respiratory Disease and Tuberculosis del Department of
Medicine presso la Mahidol University (Chierakul et al., 2013) ha osservato che
un’esposizione prolungata ad alte concentrazioni di gas di cloro, derivanti dalla
decomposizione dell’ipoclorito di sodio, ha effetti negativi a corto e a lungo termine sulla
salute delle vie respiratorie. La maggior parte dei pazienti ha avuto dei miglioramenti col
tempo, ma alcuni sintomi sono rimasti persistenti. L’inalazione di gas di cloro può essere
considerata più dannosa rispetto all’ingestione, poiché, se nel tratto digerente le molecole
possono esser parzialmente distrutte e eliminate, negli alveoli polmonari il cloro può passare
direttamente nel sangue, oltre a irritare l’epitelio bronchiale. Ricordiamo che vapori di cloro
sono stati addirittura usati come armi chimiche per la loro capacità di provocare l’immediata
irritazione delle vie respiratorie e la seguente sensazione di soffocamento.
Inoltre, uno studio realizzato da un gruppo di ricercatori del Department of Community
Health presso la Brown University (Zierler et al., 1988) ha provato che i derivati del cloro
sono associati ad alcuni tipi di cancro: due gruppi di non fumatori sono stati dissetati per 50
anni uno con acqua clorata e l'altro no. Nel primo gruppo il tasso di cancro alla vescica é
risultato quatto volte superiore rispetto al secondo.
12
Un ulteriore studio, effettuato da un team di ricerca del Medical College of Wisconsin
(Morris et al., 1992), ha confermato l’effettiva esistenza di una correlazione tra la probabilità
di sviluppare un tumore e l’uso di derivati del cloro.
Stando a ciò che afferma il Dr. Joseph Price del US Council of Environmental Quality «il
rischio di cancro tra le persone che bevono acqua clorata è del 93% in più rispetto a quelli
la cui acqua non contiene cloro». Il Dr. Price, autore del libro “Coronaries, Cholesterol,
Chlorine” (1988), ha attuato uno studio sull’effetto del cloro sui polli: un gruppo è stato
allevato con acqua clorata e l’altro no. Durante l’autopsia, il numero di polli con malattie
cardiocircolatorie del primo gruppo era nettamente maggiore rispetto a quello del secondo.
Anche in vita i polli del secondo gruppo risultavano visibilmente più sani (crescevano più
rapidamente, non perdevano piume, non avevano brividi nel periodo invernale). Da questo
studio si è potuta dedurre l’esistenza di un’interdipendenza tra l'uso di derivati del cloro e lo
sviluppo di malattie cardiocircolatorie.
Nel 1989 l’epidemiologo Dr. Strachan formulò la prima ipotesi sull’igiene, segnalando
l’esistenza di una relazione inversa tra la dimensione del nucleo famigliare e la propensione a
sviluppare malattie atopiche. La sua teoria sostiene che una minor incidenza di infezioni nella
prima infanzia, dovuta all’inferiore contatto con fratelli maggiori o altri famigliari, potrebbe
essere una delle cause dell'aumento delle malattie allergiche. Nel caso di una famiglia
numerosa, l’opportunità di trasmissione di malattie infettive all’interno della famiglia stessa è
superiore; di conseguenza, la probabilità di contrarre malattie atopiche è inferiore. Più tardi,
quest’ipotesi è stata approfondita da specialisti in allergologia e immunologia e si è
confermato che la sempre minor esposizione a microbi, dovuta non solo a famiglie meno
numerose ma anche a un ambiente casalingo sempre più pulito e disinfettato, è un’importante
causa della crescente incidenza di atopia in questi ultimi anni.
Impedire di entrare in contatto con i germi o utilizzare igienizzanti che danneggiano la
flora batterica umana non fa altro che esporci ad un alto rischio di malattie. Molti pediatri,
immunologi e microbiologi sono d'accordo su una cosa: una pulizia eccessiva, e quindi una
forte riduzione della presenza di microbi nell’ambiente casalingo, non fa bene al sistema
immunitario, specialmente se si tratta di quello dei bambini che deve ancora rafforzarsi. Il
sistema immunitario, infatti, funziona in gran parte grazie alla memoria immunitaria, che
consiste nel riconoscimento più rapido di un’infezione e di conseguenza un intervento
preventivo dei linfociti per combatterla, possibile grazie alla presenza di adeguati anticorpi
precedentemente sviluppati (durante il primo contatto con antigeni complementari). Un
bambino cresciuto in presenza di un maggior numero di batteri svilupperà un sistema
immunitario più forte e sarà meno propenso ad contrarre allergie rispetto ad uno cresciuto in
una casa sterilizzata con igienizzanti (Bloomfield et al., 2006).
Ma i danni provocati dagli igienizzanti non sono finiti. Un altro problema, già largamente
presente negli ospedali dovuto agli antibiotici somministrati, si sta espandendo anche
all'interno delle mura delle nostre case: la formazione di batteri mutanti super-resistenti in
grado di liberarsi dalle sostanze potenzialmente dannose, come Gonorrea HO41, Clostridium
difficile e Enterobacteriaceae (Frieden, 2013). Steve Solomon, direttore dell’ufficio del CDC
per la resistenza agli antibiotici ha affermato che «ogni volta che gli antibiotici vengono usati
in qualsiasi ambiente, i batteri si evolvono sviluppando resistenza. Questi farmaci sono
preziosi e limitati, e più li usiamo oggi, più diminuisce la possibilità di averne di efficaci
domani».
Il professor Glenn Kaatz del Department of Veterans Affairs Medical Center di Detroit ha
sancito che l'abuso degli igienizzanti e di detergenti antibatterici ha, appunto, come grave
conseguenza la sempre maggiore resistenza dei batteri a queste sostanze altamente aggressive.
Dopo aver sottoposto dei campioni di batteri a un trattamento di soluzioni di biocidi a diverse
concentrazioni, i ricercatori hanno notato la formazione di batteri mutanti che hanno
sviluppato l'incredibile capacità di metabolizzare sostanze chimiche potenzialmente dannose,
13
anche diverse da quelle che ne hanno provocato la mutazione. In questo modo non solo non si
eliminerebbero più i batteri resistenti ma ci sarebbe il rischio di rendere ancora più potenti e
dannosi quelli patogeni, come il pericoloso Stafilococco aureo.
Oltre ad essere una causa di problemi salutari talvolta gravi, l’ipoclorito di sodio è anche
un pericoloso inquinante ambientale: se immesso nella falda acquifera può minacciare la vita
acquatica; in più, in caso di contatto con tale sostanza, mammiferi, uccelli e altri animali
potrebbero subire irritazioni e danni cutanei (Allegato 1).
4.3. LE ALTERNATIVE NATURALI
In natura sono presenti moltissime piante dalle quali si possono estrarre sostanze
antibatteriche e germicide, soprattutto sotto forma di oli essenziali. Solitamente si ricorre alla
distillazione in corrente di vapore al fine di ottenere un olio essenziale estremamente
concentrato, a tal punto che, per ricavare pochi millilitri di prodotto, sono necessarie enormi
quantità della pianta interessata. Il processo, oltre ad avere un rendimento basso e talvolta
dipendente dal periodo dell’anno (per alcune specie il rendimento invernale è inferiore a
quello estivo, vista la minor presenza nella pianta delle sostanze d’interesse), richiede diverse
distillazioni prima di raggiungere la concentrazione desiderata ed è buona norma effettuarlo a
freddo per evitare di alterare i principi attivi.
Uno dei più comuni oli essenziali usati a scopo antisettico è l’estratto di Melaleuca
alternifolia, conosciuto come olio dell’albero del tè o, dall’inglese, Tea tree oil. I principali
componenti che conferiscono a questo olio proprietà battericide, germicide e fungicide
(Hammer et al., 2004, in Campanini, 2012) sono il terpinene-4-olo e l’1,8-cineolo. La
composizione dell’olio essenziale, secondo una legge australiana – luogo d’origine della
pianta – deve prevedere la presenza di terpinene-4-olo in quantità superiori al 30% e di 1,8cineolo in quantità inferiori al 15%: i quantitativi ottimali sarebbero del 37-43% per il primo e
del 5-10% per il secondo.
È possibile attribuire agli oli essenziali un indice aromatico, valore che consente di
stabilirne il potere antisettico. L’indice aromatico si ricava attraverso un analisi in vitro svolta
analogamente all’antibiogramma: l’aromatogramma (Belaiche, 1983, in Campanini, 2012).
Tale indice è dato dal rapporto tra il diametro dell’alone d’inibizione dell’olio esaminato,
espresso in millimetri, e il diametro dell’alone che avrebbe prodotto un olio essenziale ideale,
vale a dire con potere battericida massimo, al quale viene assegnato un indice convenzionale
pari a 1. Ne deriva che più l’indice aromatico è vicino a 1, maggiore è il potere antibiotico
dell’olio essenziale, sia nei confronti dei batteri Gram-positivi e Gram-negativi, sia verso i
miceti. Tra i più potenti oli antisettici troviamo l’origano (0.88), il timo (0,71), la cannella di
Ceylon (0,69), il garofano (0,51) e la santoreggia (0,45), ma anche quello di melaleuca ha un
indice aromatico medio-elevato, che può farlo rientrare nelle essenze germicide maggiori.
Candida albicans, Staphylococcus, Streptococcus, Propionibacterium acnes e i batteri
Gram-negativi sono efficacemente eliminati in seguito all’uso topico di Tea tree oil (Ferrini &
Mannoni, 2006, in Campanini, 2012).
Una ricerca effettuata nel 1994 da Buck, Nidorf e Addino ha rilevato che nella cura
dell’onicomicosi il Tea tree oil al 5% è efficace quanto il clotrimazolo all’1%; in più, un
successivo saggio in doppio cieco ha accertato che l’efficacia dell’olio essenziale va oltre il
semplice effetto placebo (Satchell & Saurajen, 2002, in Campanini, 2012).
Il Tea tree oil e i sui componenti principali non causano direttamente la lisi della cellula
batterica, ma danneggiano la membrana citoplasmatica, provocando di conseguenza l’autolisi
cellulare. In uno studio effettuato su ceppi di Staphylococcus aureus è stato osservato,
14
attraverso microscopia elettronica, che cellule batteriche trattate con Tea tree oil mostravano
la formazione di mesosomi e la perdita di contenuti citoplasmatici. La predisposizione alla
lisi, la perdita di 260 nm di materiale assorbente, la perdita di tolleranza al cloruro di sodio e
la morfologia alterata suggeriscono che olio essenziale di M. alternifolia e i suoi componenti
(terpinene-4-olo e 1,8-cineolo) compromettono l’integrità e il funzionamento della membrana
citoplasmatica (Carson et al., 2002, in Campanini, 2012). In aggiunta, si può affermare che il
Tea tree oil altera l’equilibrio e il controllo chemiosmotico della cellula batterica, aumenta la
permeabilità della membrana citoplasmatica e inibisce la respirazione cellulare (Cox et al.,
2000, in Campanini, 2012).
Un vantaggio dell’uso dell’olio essenziale di M. alternifolia è legato all’ottima tollerabilità
cutanea e delle mucose, tuttavia, se sulla pelle si può usare tranquillamente puro, nel caso
delle mucose è consigliabile diluirlo perché, anche se in casi rari, potrebbe causare lievi
dermatiti (Camporese, n.d., in Campanini, 2012).
Per quanto riguarda l’uso interno non ci sono ancora studi clinici che ne confermino
l’efficacia e la sicurezza d’impiego; per il resto, se utilizzato correttamente, non ci sono effetti
collaterali correlati all’uso dell’olio fresco. Per quanto riguarda quello ossidato alla luce
solare, invece, è opportuno prestare attenzione perché potrebbe causare reazioni di
sensibilizzazione dovute alla formazione di perossidi (Hausen, 1999, in Campanini, 2012).
Il Tea tree oil, oltre a non esser dannoso per la salute, possiede anche alcune importanti
proprietà complementari, confermate da svariati studi in vivo e in vitro. Tra queste troviamo
la funzione immunomodulante chemiotattica (Camporese, n.d., in Campanini, 2012), quella
antinfiammatoria e persino quella antitumorale.
Un gruppo di ricercatori presso il Department of Microbiology and Infectious Diseases
della Flinders University (Hart et al., 2000) ha dimostrato che il terpinene-4-olo, componente
idrosolubile dell’olio di M. alternifolia, è in grado di sopprimere la produzione di mediatori
pro-infiammatori – molecole che scatenano la risposta infiammatoria, come per esempio
l’istamina – da parte dei monociti umani attivati.
Inoltre, alcuni ricercatori dell’Istituto Superiore di Sanità di Roma (Calcabrini et al., 2004)
hanno dimostrato che il terpinene-4-olo, attraverso l’attivazione delle caspasi, é in grado di
indurre l’apoptosi dei melanociti umani, limitando così la crescita e la diffusione del tumore.
L’effetto è risultato addirittura superiore con le cellule tumorali della linea farmaco-resistente,
cioè quelle cellule che sovraesprimono la P-glicoproteina, proteina di membrana coinvolta
nella resistenza ai farmaci. La capacità di indurre l’apoptosi conferisce quindi al Tea tree oil
un potere antitumorale in grado persino di superare la resistenza dovuta all’eccessiva
espressione della P-glicoproteina.
4.4. I MICRORGANISMI EFFETTIVI
Nel 1982 il microbiologo giapponese Dr. Teruo Higa scoprì, grazie a una serie di
esperimenti, una combinazione di diverse specie di microrganismi che prese il nome di
Microrganismi effettivi, comunemente abbreviati con l’acronimo EM – dall’inglese Effective
Microorganism.
La tecnologia EM (EM Technology) nacque inizialmente per sostituire concimi e
antiparassitari chimici utilizzati in campo agricolo; tuttavia, visto il successo ottenuto, il Dr.
Higa sperimentò l’uso degli EM anche in altri settori, attestando l’efficacia del prodotto anche
nella depurazione delle acque, nello smaltimento dei rifiuti, nella pulizia della casa, nella
detersione personale e in molto altro ancora.
15
Al contrario dell’immaginario comune, non tutti i microrganismi sono nocivi; l’uomo,
infatti, utilizza i microrganismi da migliaia di anni per la produzione alimentare: formaggio,
yogurt, birra, pane, vino e altri alcolici sono solo alcuni dei loro campi d’impiego.
Come dimostrato dal Dr. Teruo Higa, ne esistono poi alcuni in grado di combattere quelli
patogeni.
Il composto EM contiene più di 80 tipi di microrganismi che, vivendo in simbiosi,
producono effetti rigenerativi sorprendenti. Negli EM si possono riconoscere tre tipi principali
di microrganismi: i lattobacilli, i lieviti e i batteri fotosintetici.
I lattobacilli, o batteri dell’acido lattico (Pasteur, 1857), sono i microrganismi responsabili
della trasformazione dello zucchero in acido lattico attraverso il processo della fermentazione.
La produzione di acido lattico ha come prima conseguenza l’abbassamento del pH e quindi la
formazione di un ambiente sfavorevole alla crescita di diversi microrganismi patogeni.
I lattobacilli sono naturalmente presenti all’interno del sistema digerente degli animali e
costituiscono parte della flora batterica intestinale, la quale contribuisce al corretto andamento
di diverse funzioni vitali. Si tratta di una condizione di simbiosi tra batteri e organismo
animale (nel caso specifico é detta eubiosi).
Questi batteri sono usati nella produzione di formaggi e yogurt e avrebbero effetti benefici
sulla salute di qualsiasi forma di vita animale, poiché, oltre a regolarizzare l’attività
intestinale, aiutando l’organismo nei processi digestivi, avrebbero azione immunostimolante e
proprietà antitumorali. Sarebbero infatti in grado di aumentare il numero di cellule produttrici
di immunoglobuline, favorendo la fagocitosi e incrementando il numero di linfociti T e NK.
Inoltre, potrebbero contribuire alla protezione da patogeni presenti nel sistema digerente
grazie all’esclusione competitiva (Reid et al., 2003).
Studi in laboratorio hanno dimostrato che alcuni ceppi di Lactobacillus bulgaricus hanno
un effetto anti-mutageno, possibilmente ricollegabile alla loro capacità di legarsi alle ammine
eterocicliche prodotte durante la combustione della carne (Wollowski et al., 2001). Inoltre,
diversi studi sull’uomo hanno rilevato proprietà antitumorali esplicabili attraverso
un’inibizione dell’attività di un enzima che può generare carcinogeni nel sistema digerente
(Brady et al., 2000).
Il lievito Saccharomyces cerevisiae (Van Leeuwenhoek, 1680) è un essere eucariota
conosciuto per il suo impiego nella fermentazione della birra e del pane. Questo
microrganismo appartiene al regno dei funghi e vive in ambienti ricchi di zuccheri,
producendo molti agenti bioattivi, come aminoacidi, polisaccaridi, acidi organici, alcoli,
vitamine e antiossidanti.
I lieviti si nutrono principalmente di organismi vivi o morti, secernendo nell’ambiente
circostante gli enzimi digestivi che scindono le sostanze in molecole assorbibili attraverso la
parete cellulare. Gli enzimi rilasciati sono molto utili nella lotta ai batteri patogeni; un classico
esempio è la penicillina (Fleming, 1925) che ha rappresentato un’importantissima scoperta
nell’ambito del trattamento d’infezioni. La scoperta di questa sostanza favorì la ricerca di altri
inibitori microbici, come la streptomicina, che furono denominati antibiotici (Waksman,
1945).
La fotosintesi consiste nello sfruttamento dell’energia solare al fine di sintetizzare
sostanze organiche a partire da sostanze inorganiche. Al contrario dell’immaginario comune,
non sono solo le piante a svolgere la fotosintesi: nel suolo e nell’acqua sono presenti
microrganismi che si comportano allo stesso modo. I batteri fotosintetici, o batteri della
fotosintesi, sfruttano l’energia solare per sintetizzare antiossidanti, aminoacidi, zuccheri e
altre sostanze che non solo fungono da nutrimento per le piante stimolandone la crescita, ma
favoriscono anche la riproduzione di altri microrganismi effettivi. Questi microrganismi sono
16
spesso utilizzati nel trattamento delle acque inquinate, ma si è scoperto che possono rivelarsi
utili anche nell’agricoltura e nell’allevamento. La specie Rhodopseudomonas capsulata, per
esempio, contribuisce notevolmente ad aumentare la fertilità del suolo e quindi favorisce lo
sviluppo e la crescita delle piante. Attraverso processi metabolici produce molecole utili alla
pianta, come enzimi, aminoacidi, zuccheri e basi azotate, e accelera il processo di
biodegradazione delle sostanze organiche con la conseguente trasformazione in humus.
Inoltre, Rhodopseudomonas capsulata favorirebbe la presenza di altri ceppi batterici capaci di
difendere la pianta da funghi e altri microrganismi patogeni (Johor Corporation, 1968).
Alcuni ceppi di batteri fotosintetici sono coinvolti nel ciclo dell’azoto, quindi
contribuiscono alla fissazione del diazoto atmosferico e alla sua trasformazione in nitriti e
nitrati assimilabili dalla pianta.
Ma come agiscono gli EM? Benché al momento non ci sia ancora nessuna prova
scientifica a dimostrarne l’attendibilità, la teoria sull’azione degli EM si baserebbe sul
principio di dominanza. Secondo il Prof. Higa esisterebbero tre categorie di microrganismi:
quelli patogeni, quelli “buoni” e quelli opportunisti, i quali adatterebbero il loro carattere
metabolico a seconda del gruppo dominante. Stando alla teoria del microbiologo giapponese,
quindi, se si riuscisse a spostare l’equilibrio verso i microrganismi rigenerativi, quelli
opportunisti aumenterebbero la percentuale positiva a scapito dei microrganismi degenerativi.
Questo fenomeno è detto esclusione competitiva (Gause, 1934) e consisterebbe appunto nella
dominazione di una specie su un’altra che vive nello stesso ambiente: due specie utilizzanti la
stessa risorsa limitante non potrebbero coesistere, perché, prima o poi, una soccomberebbe
all’altra. In questo caso lo scopo sarebbe di far prevalere le specie di microrganismi buoni per
sopraffare quelli degenerativi.
Tuttavia, il principio di dominanza ha sollevato molte discussioni e perplessità, dato che,
per ora, non sono ancora stati registrati dati scientifici che ne provino la concreta efficacia.
Ciò non significa che non possano davvero funzionare ma, a mio parere, almeno per ora
bisognerebbe muoversi con cautela fin che non si sappia qualcosa di certo a riguardo. Fino ad
oggi non si sono riscontrati effetti collaterali dovuti all’uso di questi microrganismi, ma chi
può dire che a lungo termine non possano causare problemi, magari peggiori di quelli iniziali
che ne hanno promosso l’utilizzo?
17
5. MATERIALI E METODI
5.1. INTRODUZIONE GENERALE
I batteri sono i microrganismi più diffusi e con maggior importanza medica; è quindi
opportuno riuscire a coltivarli in laboratorio per averne una quantità sufficiente da analizzare.
Per la coltivazione dei batteri si deve far ricorso a mezzi di coltura specifici, caratterizzati da
brodi nutritivi contenenti le sostanze chimiche indispensabili alla loro sopravvivenza e
riproduzione. Generalmente questi terreni di coltura contengono vitamine, sali minerali e
sostanze organiche di cui i batteri si possono cibare e dunque anche moltiplicare. Tali
sostanze riproducono l’ambiente più idoneo alle esigenze metaboliche di determinati batteri e,
per questo motivo, esistono terreni diversi per specifici batteri, detti terreni di arricchimento
selettivi. L’aggiunta di un’opportuna sostanza può favorire lo sviluppo di un’unica specie
batterica, attraverso l’azione batteriostatica su tutte le altre. In questo modo sarà quindi
possibile isolare la specie d’interesse e coltivarla separatamente.
Esistono due tipi di terreni di coltura: solidi e liquidi. Quelli solidi si distinguono da quelli
liquidi per la presenza di agar (introdotto da Hesse), un polisaccaride acido estratto dalle alghe
rosse, inerte all’attività batterica. L’unica funzione dell’agar è di solidificare il terreno liquido,
rendendolo un gel facilmente manipolabile, spesso posto in apposite capsule di Petri. Un
terreno solido é utile soprattutto per il piastramento diretto dei batteri, ossia il campionamento
svolto attraverso l’appoggio del gel su una superficie, che permette così di coltivare i batteri
in colonie isolate nella stessa posizione del campionamento. Così facendo si possono meglio
identificare i tipi di colonie presenti, la loro posizione e il loro numero. Tuttavia il formato gel
è molto usato anche per i prelevamenti tramite q-tips, nei quali l’inoculazione dei batteri
avviene per strisciamento a zig-zag sulla superficie dell’agar.
La prerogativa necessaria a tutti i terreni di coltura è che essi siano perfettamente sterili; il
che implica un lavoro accurato in un ambiente privo di possibili contaminanti – altri
microrganismi – che potrebbero alterare il risultato di una ricerca.
Il metodo di sterilizzazione più usato è l’autoclavatura: in un apposito recipiente metallico
ermeticamente pressurizzato, detto autoclave, si forma una corrente di vapore a 121°C che
attraversa i materiali da sterilizzare. Le temperature raggiunte sono sufficienti a far coagulare
il protoplasma batterico, sterilizzando così l’ambiente in tempi relativamente brevi (un ciclo
di autoclave dura in media 20 minuti).
Dopo aver sterilizzato e seminato il terreno, occorre fornire un ambiente ideale allo
sviluppo batterico: il terreno verrà quindi posto in una stufa termostatata impostata a una
temperatura specifica per il tipo di batterio che si vuole coltivare, per favorirne la crescita e la
riproduzione. L’incubazione delle colture dura circa 48 ore, ma può prolungarsi fino a diverse
settimane nel caso di alcune specie. Trascorso questo tempo é necessario trapiantare i batteri
in una coltura di mantenimento: il substrato nutritivo é già stato consumato e l'ambiente non é
più favorevole, quindi se i batteri restassero lì sarebbero destinati a morire. La tecnica di
trapianto é relativamente semplice: con un ansa sterile si preleva una colonia dal vecchio
terreno e la si inocula in uno nuovo strisciandola su tutta la superficie attraverso movimenti a
zig-zag in diverse direzioni. Questo metodo é utile per l'isolamento in coltura pura di una
singola specie batterica.
18
Un terreno di base, cioè non arricchito, è composto da:
• Acqua
• 0,5% di peptoni
• 0,3% di estratto di carne
• Cloruro di sodio per portarlo all’isotonicità
• Fosfati per portarlo a pH neutro o leggermente alcalino
• 1,5% di agar (solo nel terreno solido)
In seguito all'inoculazione di batteri in un terreno liquido, quest'ultimo acquisisce un
aspetto torbido che può variare a dipendenza della specie batterica presente.
Nel caso di un terreno solido, invece, a confermare la presenza di batteri é la formazione
di una patina o di colonie isolate (di almeno 106 batteri) sulla superficie dell'agar. In questo
caso é possibile distinguere le specie osservando come si presentano le colonie: con margini
netti o frastagliati; lisce (colonie S), rugose (colonie R) o mucose; con diversi colori; ecc.
I microrganismi effettivi “a riposo” sono conservati in una soluzione concentrata di sale a
aceto (per mantenere il pH a 3,5), chiamata EM-1. EMA consiste in EM-1 attivato, vale a dire
che la soluzione concentrata viene diluita con acqua e le si aggiunge della melassa di zucchero
per nutrire e “attivare” i microrganismi. Un litro di EMA contiene: 30 ml di EM-1, 30 ml di
melassa e 940 ml d’acqua.
5.2. PARTE SPERIMENTALE
Per stabilire il grado di efficacia delle diverse sostanze igienizzanti selezionate si é scelto
di svolgere due esperimenti distinti: uno in vitro, con la tecnica degli antibiogrammi, per
verificare il grado di resistenza dei batteri di un ceppo di Escherichia coli alle sostanze
potenzialmente antibiotiche, e l’altro in vivo, effettuando prelievi prolungati nel tempo atti a
verificare l’efficacia degli igienizzanti a breve e a lungo termine in una situazione più
verosimile.
Qui di seguito sono illustrati i protocolli degli esperimenti svolti, con le dovute
osservazioni riportate, i risultati ottenuti e le conclusioni che è stato possibile trarre.
5.2.1. ANTIBIOGRAMMI
La tecnica degli antibiogrammi è usata per verificare il grado di resistenza di determinati
batteri ad una sostanza con eventuale potere battericida o batteriostatico. La determinazione
avviene attraverso l’osservazione e la misurazione del diametro degli aloni formati attorno ad
un tampone imbevuto della sostanza da esaminare e posto in una capsula di Petri inoculata
con specifici ceppi batterici – in questo caso E. coli.
19
Materiale:
•
•
•
•
•
•
•
•
18 capsule di Petri con terreno selettivo TBX, dunque arricchito in modo da permettere
solo la crescita di E. coli;
brodo di coltura contenente E. coli;
sostanze antibatteriche : igienizzante a base di ipoclorito di sodio, etanolo al 90%, olio
essenziale di Melaleuca alternifolia (Tea tree oil), Microrganismi Effettivi (EMA);
tamponi di carta assorbente;
ansa di vetro sterile;
becco bunsen;
parafilm;
incubatrice.
Procedimento
Il materiale andrebbe maneggiato in ambiente sterile e, per una maggior accuratezza dei
risultati, sarebbe opportuno svolgere tutti i passaggi sotto cappa. Non avendo a disposizione
una cappa sono state prese misure alternative: tutte le superfici e gli strumenti di lavoro sono
stati sterilizzati con 2-propanolo e si è ricorsi all’uso di un becco bunsen per creare un
ambiente di lavoro più sterile possibile.
Dopo esser state preparate con del terreno di coltura selettivo TBX, le capsule di Petri
sono state inoculate con il brodo contenente E. coli. Per farlo, si é depositata una goccia di
terreno liquido al centro della Petri e la si é distribuita uniformemente sulla superficie con
l’aiuto di un’apposita ansa in vetro sterile.
Successivamente si è passati al posizionamento dei tamponi all’interno delle Petri: con
l’ausilio di una pinzetta si sono posti quattro tamponi impregnati delle sostanze igienizzanti in
ogni capsula. Le Petri sono quindi state sigillate con del parafilm e messe a incubare a 36°C
per 24-48 ore.
Per ottenere più dati e quindi risultati più precisi è necessaria la preparazione di almeno 3
Petri per sostanza quindi si sono ottenute:
• 3 Petri di controllo, senza tamponi (solo con E. coli);
• 3 Petri con igienizzante a base di ipoclorito di sodio;
• 3 Petri con etanolo al 90%;
• 3 Petri con olio essenziale di M. alternifolia (Tea tree oil);
• 3 Petri con Microrganismi Effettivi (EMA) inseriti prima dell’incubazione, per verificarne
il potere batteriostatico;
• 3 Petri con Microrganismi Effettivi (EMA) inseriti dopo l’incubazione, per verificarne il
potere battericida.
Risultati
L’incubazione permette lo sviluppo e la riproduzione delle colonie quindi, per determinare
se una sostanza possiede un reale potere battericida o batteriostatico, bisogna osservare in che
modo tale sostanza ha limitato la crescita batterica. Quest’osservazione si può fare attraverso
la misurazione degli aloni formatisi attorno ai tamponi e col confronto dei dati ottenuti con la
seguente tabella data che certifica i tre livelli di resistenza dei batteri:
20
Diametro dell'alone
1 – 9 mm
10 – 18 mm
≥ 19 mm
Grado di resistenza (GR)
R: specie resistente
I: specie con resistenza intermedia
S: specie sensibile
Efficacia dell'antibiotico
inefficace, inutile
poco efficace
efficace, utile
Tabella 1. Dati generali di riferimento per stabilire il grado di resistenza da parte dei batteri nei confronti di una
sostanza in base al diametro dell’alone misurato con la tecnica degli antibiogrammi.
Sostanza antibiotica
Diametro dell’alone (mm) /osservazioni
Controllo
(solo E. coli)
Igienizzante (NaClO)
Etanolo al 90%
Assenza di alone: c’è una patina su tutta la
superficie.
Tea tree oil
EMA (prima)
EMA (dopo)
28 14 20 18 16 20 16 20 18 16 20 24
2 4 2 4 6 4 8 4 6 4 4 6
Sono presenti solo pochissime colonie ai
bordi della capsula.
Sono presenti aloni di pochi millimetri (1-2
mm), ma non sono cresciute colonie di
batteri diversi da E. coli.
Assenza di aloni; sotto i tamponi sono
cresciute alcune colonie di altri batteri, ma
quelle di E. coli non sono né morte né
sparite.
Media
GR
/
/
19 (±4) mm
5 (±2) mm
S
R
> 19 mm
S
2 mm
R
0 mm
R
Tabella 2. Risultati osservati da antibiogrammi effettuati su colonie di E. coli sottoposte a trattamenti con
diverse sostanze potenzialmente antibiotiche e successiva determinazione del grado di resistenza (GR).
Figura 3. Risultati degli antibiogrammi svolti su colonie di E. coli utilizzando le seguenti sostanze: 1) controllo
(solo E. coli); 2) igienizzante a base di ipoclorito di sodio); 3) etanolo al 90%; 4) olio essenziale di M.
alternifolia (Tea tree oil); 5) EMA prima dell’incubazione; 6) EMA dopo l’incubazione.
21
5.2.2. ESPERIMENTO SULL’EFFICACIA REALE DEGLI IGIENIZZANTI
Come già accennato in precedenza, questo esperimento è mirato a dimostrare l’efficacia
degli igienizzanti nella realtà (in vivo), quindi in situazioni soggette a condizioni esterne
variabili, quali temperatura, umidità, aria portatrice di nuovi batteri, ecc.
L’esperimento, inoltre, non si limita ad attestare un grado d’efficacia assoluto alle sostanze
igienizzanti (come nel caso degli antibiogrammi), ma permette anche di determinare
l’andamento a lungo termine della crescita batterica sulle superfici trattate.
Materiale:
•
•
•
•
•
•
•
10 piastrelle in ceramica (~25cm x 25cm);
126 Petri da contatto;
brodo di coltura contenente E. coli;
2-propanolo;
sostanze antibatteriche: ipoclorito di sodio (Axxel javel), etanolo denaturato al 90%, olio
essenziale di M. alternifolia (Tea tree oil);
ansa di vetro sterile;
becco bunsen.
Procedimento
Come prima cosa le piastrelle sono state sterilizzate in autoclave per partire da una
situazione comune a tutte, dopodiché sono state posizionate in un luogo che ne abbia garantito
l’immobilità per tutto l’arco dell’esperimento. A questo punto si sono inoculate 5 piastrelle
con il brodo contenente E. coli, mentre le altre 5 si sono lasciate così come sono. Prima di
procedere al trattamento con le sostanze antibatteriche si sono dovuti aspettare 3-4 giorni per
permettere ad altri batteri di depositarsi in modo più o meno uniforme su tutte le piastrelle. In
questo modo è stato possibile ottenere due situazioni distinte: una più reale e una falsata come
paragone, nella quale si è certi della presenza di batteri (E. coli) sulla superficie.
Attesi 3-4 giorni si é trattata ogni piastrella con una diversa sostanza igienizzante in modo
da ottenere:
• 1 piastrella con E. coli;
• 1 piastrella con E. coli, trattata con l’igienizzante a base di ipoclorito di sodio;
• 1 piastrella con E. coli, trattata con etanolo al 90%;
• 1 piastrella con E. coli, trattata con olio essenziale di M. alternifolia (Tea tree oil);
• 1 piastrella normale;
• 1 piastrella trattata con l’igienizzante a base di ipoclorito di sodio;
• 1 piastrella trattata con etanolo al 90%;
• 1 piastrella trattata con olio essenziale di M. alternifolia (Tea tree oil);
• 2 piastrelle per il controllo negativo:
o 1 piastrella con E. coli, trattata con 2-propanolo;
o 1 piastrella trattata con 2-propanolo.
I prelievi sono stati eseguiti ai tempi prestabiliti semplicemente premendo le capsule di
Petri sulle superfici trattate. Si ha prelevato sempre in punti diversi per un risultato più
affidabile (per questo motivo occorrono piastrelle di determinate dimensioni) e anche in
questo caso sono state necessarie almeno 3 Petri per ogni campionamento.
Come per gli antibiogrammi, le capsule sono state poi incubate per 3 giorni a 36°C.
I tempi di prelievo sono stati a 0 ore, 6 ore, 24 ore, 72 ore (3 giorni) e 168 ore (7 giorni)
dopo il trattamento con le diverse sostanze.
22
Risultati
Niente
Igienizzante (NaClO)
Etanolo al 90%
Tea tree oil
E. coli
E. coli + igienizzante (NaClO)
E. coli + etanolo al 90%
E. coli + Tea tree oil
t=0h
95%
0%
95%
30%
100%
100%
100%
95%
t=6h
55%
0%
5%
20%
90%
5%
30%
55%
t=24h
50%
10%
10%
15%
85%
15%
20%
30%
t=72h
70%
10%
15%
15%
85%
40%
20%
15%
t=168h
30%
10%
15%
15%
80%
30%
15%
20%
Tabella 3. Percentuale della superficie delle capsule di Petri ricoperta da colonie batteriche ai diversi tempi
di prelievo e per i diversi trattamenti. Approssimazione ogni 5%.
23
0 ore
24 ore
72 ore
6 ore
168 ore
Figura 4. La prima immagine mostra lo schema di disposizione dei campioni prelevati sulle diverse superfici
trattate. Le immagini che seguono rappresentano i diversi campioni prelevati, in ordine, a tempi differenti:
0 ore, 6 ore, 24 ore, 72 ore (3 giorni) e 168 ore (7 giorni).
24
Grafico 1. Andamento della crescita batterica sulle piastre trattate con le sostanze antibiotiche relativo alla
percentuale di superficie ricoperta da colonie batteriche nella piastra di controllo (in blu e contrassegnata da ■).
Grafico 2. Andamento della crescita batterica sulle piastre trattate con le sostanze antibiotiche relativo alla
percentuale di superficie ricoperta da colonie batteriche nella piastra di controllo inoculata solo con E. coli (in
blu e contrassegnata da ■).
25
6. DISCUSSIONE
Il Grafico 3 mostra che a tempo t=0h l’effetto battericida di tutte e tre le sostanze
igienizzanti utilizzate è praticamente nullo; solo una volta trascorse alcune ore è osservabile
una reale efficacia. Molto probabilmente questo dato è dovuto alla necessità da parte della
sostanza di un tempo minimo d’azione. Nel caso del Tea tree oil, per esempio, uno studio
pubblicato da May et al. nel 2000 ha evidenziato che l’olio essenziale non ha un effetto
battericida immediato, ma, prima di poter osservare un’azione significativa, è necessario il
passaggio di un minimo lasso di tempo, che varia a dipendenza della specie batterica da
eliminare. I grafici sottostanti mostrano due esempi esplicativi.
Grafico 3. Uccisione da parte del Tea tree oil di batteri Staphylococcus aureus meticillina-resistenti – nel primo
grafico – e di batteri Pseudomonas aeruginosa ceftazidima-resistenti – nel secondo grafico (May et al., 2000).
Nota: tenere conto solo della curva contrassegnata da .
Passando in rassegna le tre sostanze notiamo che l’igienizzante a base di ipoclorito di
sodio è il più efficace a breve termine, ma già dopo poche ore dal trattamento la crescita
batterica riprende ad aumentare. Questo aumento potrebbe esser dovuto al deposito di nuovi
batteri provenienti dall’aria sulla superficie precedentemente trattata, che, quindi,
confermerebbe uno scarso potere batteriostatico dell’ipoclorito di sodio, dovuto
presumibilmente alle componenti volatili, come i gas di cloro, che già dopo poco tempo non
sono più presenti sulla superficie in quantità sufficienti da garantire un effetto antibatterico.
L’ipoclorito di sodio è infatti particolarmente instabile, motivo per cui sono sufficienti la luce
solare o temperature superiori a 45°C per decomporlo (Sirtes et al., 2005). Una seconda
ipotesi potrebbe essere che l’igienizzante abbia ucciso gran parte dei batteri presenti ma non
tutte le spore, che quindi, appena entrate in contatto con l’ambiente favorevole fornito dal
terreno di coltura nelle capsule di Petri, abbiano cominciato a proliferare. In genere, infatti, le
spore risultano esser molto più resistenti dei batteri all’ipoclorito di sodio (Russell, 1990, in
Fukuzaki, 2006).
Prendendo in considerazione la curva di crescita batterica sulla superficie trattata con
etanolo al 90%, è osservabile un’efficacia mediocre pressoché costante anche a lungo termine.
L’etanolo ha un’azione battericida piuttosto forte, ma non vale lo stesso per quanto riguarda
l’azione batteriostatica; inoltre, se si può considerare efficace contro i batteri vegetativi,
contro le spore risulta totalmente inutile. La sua proprietà battericida é esplicabile attraverso
la denaturazione di enzimi e proteine d’importanza vitale per la cellula batterica, mentre
quella batteriostatica, seppur non elevata, si crede sia dovuta all’inibizione della produzione di
molecole necessarie alla crescita e alla riproduzione cellulare. L’efficacia maggiore la si
ottiene con concentrazioni di etanolo tra il 60% e il 90%, poiché la presenza d’acqua facilita
26
la penetrazione dell’alcol nella cellula e la più rapida distruzione proteica (Rutala et al.,
2008).
Il Tea tree oil, infine, ha un’azione abbastanza efficace a lungo termine, probabilmente
perché le sue componenti sono poco volatili e perdurano sulla superficie, limitando la crescita
batterica e creando un ambiente sfavorevole alla formazione di nuove colonie. Tuttavia,
sebbene l’etanolo sia molto più volatile del Tea tree oil e nell’esperimento in vitro sia risultato
nettamente meno efficace dell’olio essenziale, gli andamenti a lungo termine delle curve di
queste due sostanze sono inspiegabilmente simili.
Gli andamenti del Grafico 1 e del Grafico 2 sono diversi, soprattutto a breve termine. I dati
potrebbero essere così differenti a causa di una distribuzione non omogenea di batteri sulle
superfici nel caso della situazione reale (piastrelle non contaminate con E. coli): essendo
dettato dal caso, non è possibile stabilire se il posizionamento dei batteri provenienti dall’aria
sia stato pressoché lo stesso su tutte le piastrelle o se su alcune, fin dal’inizio, fossero presenti
meno batteri rispetto ad altre. Tuttavia, gli andamenti delle curve a partire da t=6h sono simili.
La scelta di eseguire l’esperimento sulle due superfici – una con l’aggiunta di E. coli e
l’altra no – è stata effettuata per avere una situazione verosimile e una che permettesse un
controllo parallelo alle circostanze reali. La distribuzione omogenea di batteri su tutta la
superficie, data dall’inoculazione controllata di E. coli, permette infatti di avere una
condizione standardizzata su tutte le piastrelle, che consente, di conseguenza, di avere risultati
più attendibili.
Per verificare l’efficacia delle sostanze antibiotiche è stato inoltre realizzato un controllo
incrociato con i rispettivi antibiogrammi.
Dai risultati ottenuti si può notare una discordanza con la situazione reale: stando ai dati
degli antibiogrammi il Tea tree oil dovrebbe essere la sostanza più efficace (a tal punto che
nelle capsule di Petri non sono cresciute colonie se non un paio sui bordi) ma nella realtà è
solo mediocremente efficace; così come l’etanolo, che, come già detto, secondo gli
antibiogrammi non dovrebbe avere effetti significativi sui batteri, mentre nella realtà si rivela
abbastanza efficace. L’igienizzante a base di ipoclorito di sodio, invece, è risultato molto
efficace, almeno a breve termine, in entrambi i casi studio.
Le differenze riscontrabili potrebbero dipendere dal fatto che negli antibiogrammi non c’è
l’immissione di nuovi batteri, quindi una volta morti quelli presenti non ne possono crescere
altri; oppure dal fatto che si tratta di un ambiente chiuso ermeticamente e che quindi non
permette ai componenti più volatili di evaporare.
Con la tecnica degli antibiogrammi si sono voluti verificare anche gli effetti battericida e
batteriostatico dei Microorganismi effettivi: in entrambi i casi non è stata però evidenziata
alcuna efficacia contro le colonie di E. coli.
Con l’aggiunta del tampone imbevuto di EMA allo stesso tempo dell’inoculazione di E.
coli, per testare il potere batteriostatico, si sono notati degli aloni di pochi millimetri,
probabilmente dati dalla soluzione di sale e aceto in cui erano immersi gli EM, che, difatti,
presenta una leggera proprietà antibiotica. Aggiungendo il tampone dopo la crescita di colonie
di E. coli, per verificare il potere battericida, l’unica reazione osservata è stata la minima
crescita di colonie batteriche diverse da E. coli, che, tuttavia, non hanno sostituito queste
ultime. Bisogna comunque considerare che il terreno di coltura TBX è selettivo per batteri
appartenenti a ceppi di E. coli, quindi potrebbe aver causato la morte di quasi tutti i
Microrganismi effettivi o per lo meno potrebbe averne alterato gli effetti.
Per accertare i risultati sarebbe interessante svolgere ulteriori esperimenti sui
microrganismi effettivi utilizzando diversi terreni di coltura e, magari, facendo anche un
paragone col semplice effetto antibatterico di una soluzione di sale e aceto. Si potrebbero
effettuare degli antibiogrammi prolungati nel tempo, per verificare se l’efficacia è realmente
insignificante o se a lungo termine ha qualche effetto di maggior rilevanza.
27
7. CONCLUSIONI
Lo scopo di questo lavoro di maturità era di dare prova o meno dell’efficacia degli
igienizzanti chimici, sia a breve che a lungo termine, considerando i pro e i contro del loro
utilizzo nell’igiene della persona e dell’ambiente. L’ipotesi iniziale era che gli igienizzanti di
sintesi potrebbero non rappresentare la soluzione migliore per quanto concerne l’igiene e che,
magari, potrebbe esistere qualche alternativa più appropriata. In aggiunta, si voleva verificare
se la lotta stessa ai microrganismi fosse realmente opportuna o se potesse arrecare danni di
qualsivoglia natura. In poche parole, l’obiettivo del presente LAM era di fare un bilancio tra
efficacia e conseguenze delle diverse sostanze selezionate al fine di stabilirne l’idoneità
d’utilizzo.
Dai risultati degli esperimenti e dalle adeguate considerazioni si può concludere che la
sostanza più efficace tra quelle esaminate è l’igienizzante a base di ipoclorito di sodio, tuttavia
il suo effetto non ha una durata considerevole, quindi per poter mantenere sempre sterile un
ambiente occorrerebbe ripetere il trattamento a distanza di poche ore. Dunque, viste anche le
molteplici conseguenze negative che può avere sulla salute e sull’ambiente (Allegato 1),
l’utilizzo di questo genere di prodotto è pertanto sconsigliabile.
Nemmeno l’etanolo è la miglior scelta, poiché, oltre ad avere un’efficacia inferiore,
anch’esso non è raccomandabile per la salute e per l’ambiente (Allegato 2).
L’alternativa più efficace e più salutare è quindi l’olio essenziale di Melaleuca
alternifolia, che può esser usato anche per la cura della persona, senza riscontrare effetti
secondari negativi. Generalmente parlando, però, la lotta ai microrganismi sarebbe da mettere
in atto in maniera limitata: come visto, un ambiente sterile non giova alla salute, specialmente
se si parla di quella dei bambini; inoltre, vige sempre il rischio di danneggiare i batteri utili,
come quelli della flora intestinale, causando così danni indiretti al nostro organismo. Per non
parlare della sempre maggiore resistenza dei batteri agli antibiotici dovuta, almeno in parte,
all’abuso di queste sostanze, che quando servono davvero non possono più esser usate perché
ormai inefficaci. Anche sotto questa prospettiva è il Tea tree oil a costituire la miglior scelta:
l’olio essenziale, infatti, non permette ai batteri di sviluppare alcuna resistenza. Su questo
punto sarebbe interessante svolgere degli esperimenti al fine di analizzare se e come i batteri
sviluppino una resistenza e quanto tempo gli occorre per farlo a dipendenza delle sostanze a
cui sono sottoposti.
La pulizia è essenziale per limitare la diffusione di malattie infettive anche gravi, ma è
altrettanto vero che un uso sconsiderato di prodotti igienizzanti non fa altro che provocare
l’effetto opposto a quello desiderato, vale a dire che, invece di prevenire la propagazione
batterica, contribuisce, in primo luogo, all’indebolimento delle difese immunitarie e,
secondariamente, all’ancor peggiore diffusione di batteri sempre più resistenti.
A partire dalle informazioni prese in considerazione non é però possibile stabilire quale sia
il livello ottimale d’igiene: si può solo attestare che sia l’igiene eccessiva che quella troppo
scarsa sono malsane, senza però poter fornire un dato quantitativo preciso.
Si può quindi concludere che, quando necessario, é preferibile utilizzare prodotti naturali
piuttosto che igienizzanti di sintesi a base di ipoclorito di sodio, ma che tuttavia non bisogna
esagerare nemmeno nell’uso di tali alternative, poiché non conta tanto come vengono
eliminati i batteri quanto il fatto stesso di distruggerli.
28
BIBLIOGRAFIA
BLOOMFIELD S.F., STANWELL-SMITH R., CREVEL R.W.R. & PICKUP J. (2006). Too clean, or
not too clean: the hygiene hypothesis and home hygiene. Clinical & Experimental Allergy,
36 (aprile), pp. 402-425.
BUCK D.S., NIDORF D.M. & ADDINO J.G. (1994). Comparison of two preparations for the
treatement of onychomycosis: Melaleuca alternifolia (Tea tree) oil and clotrimazole.
The Journal of Family Practice, 38 (giugno), pp.601-605.
CALCABRINI A., STRINGARO A., TOCCACIELI L., MESCHINI S., MARRA M., COLONE M.,
SALVATORE G., MONDELLO F., ARANCIA G. & MOLINARI A. (2004). Terpinen-4-ol, the
main component of Melaleuca alternifolia (Tea tree) oil inhibits the in vitro growth of
human melanoma cells. The Journal of Investigative Dermatology, 122 (febbraio), pp. 349360.
CAMPANINI E. 2012. Dizionario di fitoterapia e piante medicinali. Tecniche nuove. Milano
CARSON C.F., MEE B.J. & RILEY T.V. (2002). Mechanism of action of Melaleuca alternifolia
(Tea tree) oil on Staphylococcus aureus determined by time-kill, lysis, leakage, and salt
tolerance assays and electron microscopy. Journal of American Society for Microbiology,
46 (giugno), pp. 1914-1920.
CHIERAKUL N., RITTAYAMAI N., PASSARANON P., CHAMCHOD C. & SUNTIWUTH B. (2013).
Respiratory health effect of persons accidentally expose to high concentration of chlorine
gas. Journal of the Medical Association of Thailand, 96 (febbraio), pp. 17-21.
COX S.D., MANN C.M., MARKHAM J.L., BELL H.C., GUSTAFSON J.E., WARMINGTON J.R. &
WYLLIE S.G. (2000). The mode of antimicrobial action of the essential oil of Melaleuca
alternifolia (Tea tree oil). Journal of Applied Microbiology, 88 (gennaio), pp. 170-175.
DEBBIA E. (2005). Appunti di microbiologia.
www.microbiologia.unige.it/dpb/Appunti/M-GENERALE01%20(1).htm (29.10.2013).
FERRINI A.M. & MANNONI V. (2006). Melaleuca alternifolia essential oil possesses potent
antistaphylococcal activity extended to strains resistant to antibiotics. International Journal
of Immunopathology and Pharmacology, 19 (marzo), pp. 539-544.
FRIEDEN T. (2013). Antibiotic resistance threats in the United States.
www.cdc.gov/drugresistance/threat-report-2013/pdf/ar-threats-2013-508.pdf (01.11.2013).
FUKUZAKI S. (2006). Mechanisms of actions of sodium hypochlorite in cleaning and
disinfection processes. Biocontrol Science, 11 (agosto), pp. 147-157.
GRUPPO D’INTERESSE “EFFEKTIVE MIKROORGANISMEN SCHWEIZ” (2012). EM: informazioni e
uso.
HAMMER K.A., CARSON C.F. & RILEY T.V. (2004). Antifungal effects of Melaleuca
alternifolia (Tea tree) oil and its components on Candida albicans, Candida glabrata and
Saccharomyces cerevisiae. Journal of Antimicrobial Chemotherapy, 53 (giugno), pp. 10811085.
HART P.H., BRAND C., CARSON C.F., RILEY T.V., PRAGER R.H. & FINLAY-JONES J.J. (2000).
Terpinen-4-ol, the main component of the essential oil of Melaleuca alternifolia (Tea tree
oil), suppresses inflammatory mediator production by activated human monocytes.
Inflammation Research: Official Journal of the European Histamine Research Society, 49
(novembre), pp. 619-626.
29
HIGA T. 2006. Microrganismi effettivi. Tecniche nuove. Milano.
LANCIOTTI E. 2000. Introduzione alla microbiologia. Zanichelli. Bologna.
MAY J., CHAN C.H., KING A., WILLIAMS L. & FRENCH G.L. (2000). Time-kill studies of Tea
tree oils on clinical isolates. Journal of Antimicrobial Chemotherapy, 45, pp. 639-643.
MORRIS R.D., AUDET A.M., ANGELILLO I.F., CHALMERS T.C. & MOSTELLER F. (1992).
Chlorination, chlorination by-products, and cancer: a meta-analysis. American Journal of
Public Health, 82 (luglio), pp. 955-963.
MYRIEL A. (2010). Malati d’igiene. Terra Nuova, 250 (maggio).
RUTALA W.A., WEBER D.J. & HICPAC (2008). Guideline for disinfection and sterilization in
healthcare facilities. www.cdc.gov/hicpac/pdf/guidelines/Disinfection_Nov_2008.pdf
(11.12.2013).
SANDERS C.C. & SANDERS JR. W.E. (1992). β-Lactam resistance in Gram-negative bacteria:
global trends and clinical impact. Clinical Infectious Diseases, 15 (maggio), pp. 824-839.
SATCHELL A.C. & SAURAJEN A. (2002). Treatment of interdigital tinea pedis with 25% and
50% Tea tree oil solution: a randomized, placebo-controlled, blinded study.
Australasian Journal of Dermatology, 43 (marzo), pp. 175-178.
SLATES H.L., TAUB D., KUO C.H. & WENDLER N.L. (1964). Strecker Degradation Of Amino
Acids To Ketones. Journal of Organic Chemistry, 29, pp. 1424.
SIRTES G., WALTIMO T., SCHAETZLE M. & ZEHNDER M. (2005). The Effects of Temperature
on Sodium Hypochlorite Short-Term Stability, Pulp Dissolution Capacity, and
Antimicrobial Efficacy. Journal of Endodontics, 31 (settembre), pp. 669-671.
VAN DEN BERG J.J.M., WINTERBOURN C.C. & KUYPERS F.A. (1993). Hypochlorous acidmediated modification of cholesterol and phospholipid: analysis of reaction products by
gas chromatography-mass spectrometry. Journal of Lipid Research, 34, pp. 2005-2012.
WEISS S.T. (2002). Eat dirt – the hygiene hypothesis and allergic diseases. New England
Journal of Medicine, 347 (dicembre), pp. 930-931.
WOLLOWSKI I., RECHKEMMER G. & POOL-ZOBEL B.L. (2001). Protective role of probiotics
and prebiotics in colon cancer. American Journal of Clinical Nutrition, 73 (febbraio), pp.
451-455.
ZIERLER S., FEINGOLD L., DANLEY R.A. & CRAUN G. (1988). Bladder cancer in
Massachusetts related to chlorinated and chloraminated drinking water: a case-control
study. Archives of Environmental Health: An International Journal, 43 (aprile), pp. 195200.
30
GLOSSARIO E ABBREVIAZIONI
Acidi teicoici
polisaccaridi acidi altamente antigenici. Essendo carichi
negativamente sono i principali responsabili della carica
negativa globale della parete cellulare dei batteri Gram+ e
quindi contribuiscono al passaggio di ioni attraverso la parete
stessa.
Ammine eterocicliche
molecole cancerogene se derivanti dalla cottura della carne.
Apoptosi
morte cellulare programmata.
ATP
molecola portatrice di energia chimica utile alla cellula.
Caspasi
enzimi fondamentali nel processo dell’apoptosi.
ClO–
ione ipoclorito.
Cloruro di sodio
NaCl: “sale da cucina”.
Clotrimazolo
farmaco antimicotico.
Controllo chemiosmotico
controllo della pompa ATPasi responsabile della sintesi di
ATP.
Diossigeno
O2: ossigeno atmosferico.
EM
Microrganismi effettivi.
Gradiente protonico
differenza di concentrazione di protoni tra l’interno e l’esterno
della cellula.
Gruppo amminico
gruppo funzionale NH2.
HClO
acido ipocloroso.
H2O
acqua.
Idrofilia
proprietà fisica di una specie chimica di disciogliersi in acqua;
spesso implica il fatto che la molecola sia elettricamente
polarizzata.
Idrofobia
proprietà fisica di una specie chimica di esser respinta
dall’acqua.
Idrolisi basica
reazione chimica che comporta la scissione delle molecole
d’acqua e il rilascio di ioni idrossido, i quali provocano un
aumento del pH della soluzione.
Igienizzanti di sintesi
igienizzanti artificiali, creati in laboratorio, quindi non di
origine direttamente naturale.
Insaturazioni
legami chimici doppi che tengono uniti due nuclei di carbonio
(C=C).
Isotonicità
concentrazione fisiologica di cloruro di sodio.
31
Istamina
mediatore pro-infiammatorio che dilata i vasi sanguigni e ne
aumenta la permeabilità.
LAM
lavoro di maturità.
Legami peptidici
legami chimici, tra un nucleo di carbonio e uno di azoto
(C–N), che tengono uniti diversi aminoacidi per formare catene
peptidiche e proteine.
Mediatori pro-infiammatori
cellule o molecole in grado di modulare la risposta
infiammatoria.
Melanociti
cellule del melanoma, un tipo di tumore maligno della cute.
Mesosomi
introflessione della membrana cellulare.
Monocita
globulo bianco voluminoso in grado di maturare in macrofago
(cellula fagocitaria).
Na+
ione sodio.
NaClO
ipoclorito di sodio.
OH–
ioni idrossido.
Peptoni
prodotti intermedi della decomposizione delle proteine.
Periplasma
spazio compreso tra la parete cellulare e la membrana
plasmatica dove avvengono molte reazioni enzimatiche.
Perossidi
molecole instabili che si decompongono liberando diossigeno.
Spesso sono irritanti.
Proprietà immunomodulante
chemiotattica
proprietà di stimolare le cellule del sistema immunitario a
muoversi per combattere l’agente patogeno.
Protoplasma
sostanza presente all’interno di una cellula nella quale sono
immersi gli organelli. Contiene l’insieme delle molecole che
costituiscono la cellula stessa.
Sostanza battericida
sostanza capace di uccidere i batteri.
Sostanza batteriostatica
sostanza in grado di inibire o di bloccare la riproduzione e la
crescita batterica, senza però uccidere il microrganismo.
Tioli
molecole idrocarburiche, composte quindi unicamente da nuclei
di carbonio e di idrogeno, che presentano un gruppo sulfidrile
(–SH).
32
ALLEGATI
MATERIAL SAFETY DATA SHEET: SODIUM HYPOCHLORITE
[…]
Incompatibility (Conditions to Avoid): Stability decreases with heat and light
exposure.
[…]
Hazardous Decomposition or Byproducts: Chlorine gas. Decomposes with heat and
reacts with acids. Hazardous gases/vapors produced are hypochlorous acid, chlorine
and hydrochloric acid. Composition depends upon temperature and decrease in pH.
Additional decomposition products, which depend on pH, temperature and time, are
sodium chloride and chlorate, and oxygen.
Note: Sodium Hypochlorite reacts violently with amines and ammonium salts. Solutions
are reactive with common cleaning products such as toilet bowl cleaners, rust
removers, vinegar, acids, organics and ammonia products to produce hazardous gases
such as chlorine and other chlorinated species.
[…]
Route(s) of entry and potential health effects:
Inhalation: Strong irritating to mucous membranes in the nose, throat and
respiratory tract. Prolonged contact can cause chronic irritation, pulmonary edema
and central nervous system depression. Repeated inhalation exposure may cause
impairment of lung function and permanent lung damage.
Skin contact: Prolonged and repeated exposure to dilute solutions often causes
irritation, redness, pain and drying and cracking of the skin. Human evidence has
indicated that an ingredient in this product can cause skin sensitization. Depending
upon the concentration and how soon after exposure the skin is washed with water,
skin contact may cause burns and tissue destruction.
Eye contact: Strongly irritating to eyes. Exposure to vapor can cause tearing,
conjunctivitis and burning of the eyes. Eye contact may cause a corneal injury. The
severity of the effects depend on the concentration and how soon after exposure
the eyes are washed with water. In severe exposure cases, glaucoma, cataracts
and permanent blindness may occur.
Ingestion: Corrosive. Can cause severe corrosion of and damage to the
gastrointestinal tract (including mouth, throat, and esophagus). Exposure is
characterized by nausea, vomiting, abdominal pain, diarrhea, bleeding, and/or
tissue ulceration.
[…]
Mutagenicity: Sodium Hypochlorite has been shown to produce damage to genetic
material when tested in vitro. Studies in vivo have shown no evidence of mutagenic
potential for this material. It is judged that the risk of genetic damage is insignificant for
sodium hypochlorite because of its biological activity, lack of mutagenicity in vivo, and
failure to produce carcinogenic response.
[…]
Ecotoxicological information: Toxic to aquatic life.
Environmental effects: Do not contaminate domestic or irrigation water supplies,
lakes, streams, ponds, or rivers. May be an aesthetic nuisance due to color. Mammals
and birds, exposed wildlife would be subject to skin irritation and burns due to the
corrosive nature of this material.
[…]
Allegato 1. Scheda di sicurezza dell’ipoclorito di sodio.
33
MATERIAL SAFETY DATA SHEET: ETHYL ALCOHOL
[…]
May cause central nervous system depression. Causes severe eye irritation. Causes
respiratory tract irritation. Causes moderate skin irritation. This substance has caused
adverse reproductive and fetal effects in humans. May cause liver, kidney and heart
damage.
[…]
Potential Health Effects:
Eye: Causes severe eye irritation. May cause painful sensitization to light. May
cause chemical conjunctivitis and corneal damage.
Skin: Causes moderate skin irritation. May cause cyanosis of the extremities.
Ingestion: May cause gastrointestinal irritation with nausea, vomiting and diarrhea.
May cause systemic toxicity with acidosis. May cause central nervous system
depression, characterized by excitement, followed by headache, dizziness,
drowsiness, and nausea. Advanced stages may cause collapse, unconsciousness,
coma and possible death due to respiratory failure.
Inhalation: Inhalation of high concentrations may cause central nervous system
effects characterized by nausea, headache, dizziness, unconsciousness and coma.
Causes respiratory tract irritation. May cause narcotic effects in high concentration.
Vapors may cause dizziness or suffocation.
Chronic: May cause reproductive and fetal effects. Laboratory experiments have
resulted in mutagenic effects. Animal studies have reported the development of
tumors. Prolonged exposure may cause liver, kidney, and heart damage.
[…]
Epidemiology: Ethanol has been shown to produce fetotoxicity in the embryo or fetus
of laboratory animals. Prenatal exposure to ethanol is associated with a distinct pattern
of congenital malformations that have collectively been termed the "fetal alcohol
syndrome".
[…]
Ecological information: Regarded as having low toxicity to aquatic organisms.
[…]
Allegato 2. Scheda di sicurezza dell’etanolo.
34
Tutti gli esperimenti sono stati eseguiti in un ambiente diverso dal laboratorio, quindi non
sterile e non controllato. Sebbene lo scopo fosse di dimostrare l’efficacia degli igienizzanti in
una situazione più verosimile possibile, la possibilità di aver contaminato dei campioni e di
aver compiuto errori di protocollo non è da escludere. Inoltre, per ottenere una maggiore
attendibilità dei risultati sarebbe auspicabile svolgere più ripetizioni degli esperimenti, al fine
di ottenere più dati.
Mi assumo quindi la responsabilità dell’esito degli esperimenti e, inoltre, dichiaro di aver
svolto il presente lavoro di maturità autonomamente e senza mezzi illeciti e che tutte le fonti
bibliografiche sono state dichiarate e impiegate onestamente.
Altea Lippmann
35