Aria : Miscuglio di gas costituito da azoto (75,45% in peso), e ossigeno (23,14% in peso), con una piccola percentuale di gas nobili, anidride carbonica e vapor acqueo.
La composizione dell'aria non è costante alle varie altezze; col crescere dell'altezza
diminuiscono i gas pesanti, mentre aumentano quelli più leggeri, come idrogeno, elio,
ecc.
Le proprietà fisiche dell'aria sono:
peso molecolare medio: 28,96 (*)
peso specifico a 0 °C e 760 mm : 1,297 kg/m³ (*)
calore specifico medio a pressione costante: 0,2389 kcal/kg °C (*)
calore specifico medio a volume costante: 0,1702 kcal/kg °C (*)
Temeperatura critica: -140,6 °C
pressione critica: 37,2 atm
(*) questi parametri variano con la temperatura
1
1
un filo di rame è lungo 150 m a 20 ° C.
Calcolare la sua lunghezza a 100 ° C. λ=16,8·10-6 ° C-1
2) Qual' e la massa di 10 litri di azoto alla pressione di 4 atmosfere ed alla temperatura di
30°C? (P.M.=28 g/mole). (R = 8.314 J/moleK; )
Risp : 45g
3) II corpo umano dissipa ogni giorno circa 2500 Calorie (l Caloria = 4186 J). Se tutto questa
calore venisse asportato mediante l’evaporazione di acqua dalla pelle, quanta acqua dovrebbe
evaporare in un giorno.
Calore molare di evaporazione dell'acqua è 10670 cal/mole
Calore latente di evaporazione dell’acqua è 593 cal/gr
Risp: 4.22 Kg
4) Una certa quantità di gas alla temperatura di 27 °C , alla pressione di 1 atm, e volume 0.4 litri, è riscaldato fino a che la sua temperatura diventa 177 °C e il suo volume è 0.5 litri. Quale è
la sua nuova pressione ?
Risp: 1.20 atm
5) Una certa quantità di gas occupa un volume di 5 litri a -73 °C. Se la pressione non cambia,
quale sarà il suo nuovo volume a 27 °C ?
Risp: 7.5 litri
6) Un blocco di ottone di massa m1 = 800 g è riscaldato a 373 K ed è poi rapidamente trasferito in un recipiente, esso pure di ottone, di massa m2 = 200 g ( 293 K) che contiene m3 = 320 g
di acqua a 20 °C ( 293 K). Arriva ad una temperatura di equilibrio di 34.5 °C ( 307,5 K). Determinare il calore specifico, a pressione costante, dell'ottone.
Risp: 392.4 J Kg-1 gradi-1
7) In un recipiente a pareti rigide, isolato termicamente dall'ambiente, sono contenuti due volumi (V1 = 1 litro e V2 = 2 litri) dello stesso gas perfetto, a pressione diversa (P1 = 1 atm e P2 =
4 atm), separati da una parete diatermica. Il sistema è in equilibrio termico a t = 27°C. Se si pratica un foro sulla parete separatrice, calcolare la temperatura e la pressione finale del gas ad
equilibrio raggiunto. Tf = ? Pf = ?
Risp: Tf = 27 °C, Pfinale= 3 atm
8) Prima di iniziare un viaggio, la pressione dei pneumatici, alla temperatura di 15°C, è di 1.8
bar ( eccesso di pressione rispetto alla Pa = 1.012 bar). Calcolare la pressione alla fine del viaggio, quando la temperatura e' salita a 40°C. Volume dei pneumatici non cambia
Risp: 2.2 bar.
2
9) Isoterma
3 moli di gas perfetto alla pressione di 3 atm vengono fatte espandere in modo Reversibile alla
temperatura costante di 300 K fino a raggiungere 1 atm. Calcolare:
*) variazione di volume
*) Variazione energia interna
Pa = 3 atm
*) Lavoro scambiato
*) Calore scambiato
Pb =1 atm
*) Variazione Entropia
10) Adiabatica
Una mole di gas perfetto monoatomico subisce una trasformazione adiabatica Reversibile da
una condizione di equilibrio pin = 1 atm Vin = 800 cm3 a una condizione di equilibrio Vfin= 60
5
3
cm3. γ = = 1, 66 cv = R ×
3
2
*) Pressione e temperatura iniziale e finale
*) Lavoro scambiato
*) variazione Entropia
11) Isocora
Due moli di gas perfetto biatomico alla Pin = 1 atm e Vin = 50 dm3 che rimane costante duran5
te la isocora fino a Pfin = 3 atm cv = R
2
*) lavoro scambiato
*) calore scambiato
*) Variazione Energia interna
*) Variazione Entropia
12) Isobara
Quattro moli di gas perfetto monoatomico, inizialmente a 60 dm3, subiscono una trasformazione alla pressione costante di 1 atm fino a raggiungere un volume di 50 dm3.
cv=(3/2)R cp=(5/2)R
*) Lavoro scambiato
*) Calore scambiato
*) Variazione Energia Interna
*) Variazione di Entropia
13) n moli di gas ideale passano dallo stato A ( pA, VA,TA) allo stato B (pB,VB,TB) .
Per il calcolo della variazione di Entropia dobbiamo utilizzare una trasformazione AB reversibile. Questo ci permette di utilizzare in ogni punto e non solo in A e B
pV = nRT
3
14) Una macchina funziona tra 500 °C e 270 °C. Calcolare il massimo rendimento possibile, (
reversibile, fluido ideale, Carnot) Dobbiamo trasformare la temperatura in kelvin aggiungendo
273.
15) Un fabbricante di motori dichiara che il calore immesso nel motore è 9 kJ/sec a 435 K. Il
calore in uscita è 4 kJ/sec a 285 K . L’affermazione è vera o falsa ?
16) Auto, con η=20%, produce mediamente un lavoro di 23000 J/sec. ( 23 KW)
Il combustibile dovrà fornire ogni secondo una quantità di calore :
17) 56 g di ghiaccio a 0 °C sono posti in un bicchiere. Dopo un tempo t, metà della massa del
kJ
ghiaccio è diventata acqua a 0°C. calore latente di fusione a 273 K = 333
kg
Variazione Entropia del sistema ghiaccio-acqua e dell’ambiente
18) Due sorgenti, una a T2 = 380 K e l'altra a T1 = 280 K, sono messe in contatto termico
tramite una lastra di alluminio di area S = 100 cm2 e spessore d = 2.5 cm.
Calcolare, a regime, quanto calore passa in 1 sec. da una sorgente all'altra e la variazione di
entropia delle sorgenti in 1 minuto. Le sorgenti rimangono a T costante. k = 201 J / m s K
il segno indica che il calore si muove in direzione
contraria alla x.
280
380
x
19) 50 kg acqua a T1=20 °C mescolati con 50 kg acqua a T2=24 °C contenuti in un sistema
isolato.
Calcolare la Variazione di entropia del sistema in questa trasformazione spontanea
Temperatura finale miscela ?
Le quantità di calore trasferito saranno…
20) Sottraggo in modo reversibile calore da 2 ·10-2 kg di acqua a 0°C finché è la massa è completamente trasformata in ghiaccio alla stessa temperatura. Variazione di entropia dell'acqua ?
Variazione totale di entropia dell'acqua e dell'ambiente. ?
21) Determinare la variazione di Energia interna di 1 litro di acqua (sistema) a 100°C che ha
subito la trasformazione per ebollizione da liquido a gas producendo 1671 litri di vapore a
100°C e a pressione atmosferica.
22) Un corpo di massa m1, calore specifico c1 e temperatura T1 è messo a contatto termico
con una sorgente a temperatura costante T2 e in una seconda prova con una massa m2 a T2 e
con calore specifico c2.
Calcolare la variazione dell’Entropia nel primo processo che porta la massa m1 da T1 a T2.
4
23)
Masse acqua
m1 = 240 Kg T1 = 283 K
m2 = 100 Kg T2= 363 K
cv = 4186,8 J/Kg K
cv = 4186,8 J/Kg K
messe a contatto termico ed isolate dall’ambiente esterno raggiungono una temperatura di equilibrio…..
La variazione di Entropia del sistema isolato relativa al processo irreversibile ….
25) Un frigorifero raffredda una massa di m = 10 g di acqua, inizialmente a T0 = 20 °C, congelandola completamente a T = 0 °C. cp= 4186 cal/Kg K
Calcolare la potenza erogata dal frigorifero, se la trasformazione avviene in t = 4 ore.
Si assuma λ_solid = −335.000 J/Kg
26) Se si hanno V1=50 cm3 di N2 a p1=400 mmHg e T1=25 °C . Qual è il volume occupato
27) Per riscaldare l'acqua di uno scaldabagno da 18 °C a 38 °C occorrono 45 minuti,
utilizzando una sorgente che fornisce 3000 J/s. Sapendo che il 20% dell'energia fornita si disperde nel riscaldamento del contenitore e dei tubi, calcolate quanta acqua contiene lo scaldabagno.
28) Un calorimetro contenente m1=300 g di acqua a T1=20 °C , dopo l'immersione di un cilindretto di alluminio (908 J/Kg·°C ) avente m2= 130 g e T2= 98 ° C, la temperatura dell'acqua sale a 26 ° C. Determinate l'equivalente in acqua del calorimetro E.
29) Trascurando ogni forma di attrito, la definizione analitica di entropia è:
30)
S=3 m2
A
14 °C
B
15 °C
C
D
d= 3.2 10-3 m
k= 0.84 J/s m °C
15 oC e l4 oC sono le temperature in B e C sensibilmente diverse da quelle in D e in A.
Se c'è vento l'aria in B viene sostituita da aria fredda mantenendo costante il gradiente di temperatura attraverso il vetro.
5
31) Sperimentalmente si trova che il sole irraggia la superficie terrestre nella misura di
1350 J/m2 s (costante solare) dei quali circa 1000 J/m2 s. giungono al suolo (giornata limpida).
Un soggetto di area S esposto ai raggi sole inclinati di un angolo θ assorbe una potenza termica
1000 cos θ
PAssorbita = 1000 cos θ a S
Θ
a = coefficiente di assorbimento (assorbanza)
S
Uomo al sole con a=0,7
θ=30° S = 2 m x 0,4 m assorbe
PAssorbita = 1000 ×0, 7 ×2 ×0, 4 ×cos 30 = 500 W
vestito bianco a < 0, 7
32) 5 g di Etanolo evaporando fanno scendere di 0,42 ° la temperatura dei 2,5 Kg di acqua circostante contenuta nel calorimetro adiabatico.
33) 2 grammi di cloroetano (p.m. 64,5; 0,031 moli; 6, 3
kcal
) evaporando asportano
moli
kcal
⋅ 0, 031 moli = 195 cal
moli
Che sono in grado di portare da 37° a 0° una quantità di tessuto di circa 5-6 grammi
Q = cs m∆T
6, 3
m=
Q
−195
=
= 5 grammi
cs ⋅ ∆T 1 ⋅ (−37)
In questo modo si anestetizzano piccole aree di pelle per interventi locali e rapidi.
Il calore deve essere sottratto alla pelle più velocemente di quanto il calore vi penetri dal tessuto circostante per conduzione.
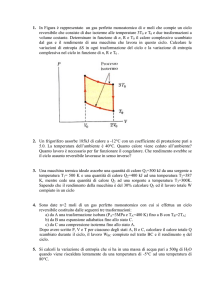
34) Adiabatica-Isoterma
AB = espansione Isoterma AC = espansione Adiabatica
Stessa pressione e temperature iniziale P(A) Ta.
Stesso volume finale V(B) e V(C) .
Diverse pressioni e temperature finali P(B) e P(C).
P
A
PV=cost
B
35) Adiabatica-Isoterma
PV γ = cos t
C
Confrontare calore, lavoro e U scambiati nella adiabatica A C e isoterma AB
6