Materiali per l’ottica lineare: vetri inorganici
Vetro: un materiale ottenuto per solidificazione da fuso senza
cristallizzazione (può esser sia di natura inorganica che organica).
In pratica è un fluido ad altissima viscosità
Caratteristiche principali:
• assenza ordine a lungo raggio (amorfo)
• assenza di un punto di fusione ben definito
• la sua viscosità diminuisce con continuità all’aumentare della temperatura
• isotropia
Si cataloga un vetro come ottico se:
•
•
•
ha proprietà ottiche ben definite e riproducibili
è otticamente omogeneo
non presenta bolle, striature, strain e inclusioni.
Materiali per l’ottica
Materiali per l’ottica lineare: vetri inorganici
Differenze tra solido vetroso rispetto ad uno cristallino:
•Il passaggio dallo stato liquido a solido avviene in modo progressivo
Continuo aumento della viscosità col raffreddamento sino a raggiungere una completa
rigidità (viscosità maggiore di 1015 poise)
Assenza del calore latente di solidificazione
•I materiali vetrosi hanno una velocità di raffreddamento al di sotto
del punto di fusione maggiore della velocità di cristallizzazione: gli
atomi si “congelano” in posizioni fuori dall‟equilibrio
•I materiali che esistono nello stato vetroso sono dotati di viscosità
elevata in prossimità del punto di solidificazione.
•Lo stato vetroso non è uno stato termodinamicamente stabile
il vetro tende ad evolvere verso la cristallizzazione (minore energia libera)
Energia
devetrificazione
vetro
cristallo
configurazione
Materiali per l’ottica
Materiali per l’ottica lineare: vetri inorganici
Materiali per l’ottica
Richiamo: la viscosità
Viscosità:
Quando si verifica una condizione di scorrimento relativo tra due elementi di un fluido
compare lungo l‟area di contatto una forza tangenziale di attrito detta forza di attrito
interno con verso sempre contrario a quello della velocità relativa.
v1
Velocità v1>v2
Si trova sperimentalmente che il modulo
della forza di attrito interno dF dipende da:
v2
dF dS
dv
dn
dS
= area di contatto
dv/dn = variazione del modulo della
velocità in direzione normale a
dS
= viscosità del fluido (dipende dal
fluido e dalla temperatura T
La viscosità nei liquidi diminuisce con l‟aumentare della temperatura (nei gas aumenta con T)
Unità di misura: kg/(ms) oppure Poise=0.1 kg/(ms)
Esempi: H2O (T=0°C)0.018 poise, H2O (T=20°C)0.010 poise
Materiali per l’ottica
Il vetro: la solidificazione
Il volume specifico (inverso della
densità) diminuisce con continuità e
non
bruscamente
come
in
una
transizione di fase di cristallizzazione.
La diminuzione del volume è più
lenta sotto la Tm (nello stato
cristallino) rispetto a quello liquido
perché la contrazione è puramente
termica (diminuzione dell’ampiezza
delle vibrazioni) mentre nello stato
liquido coinvolge anche
l’impacchettamento della struttura
Transizione vetrosa
(intersezione)
Materiali per l’ottica
Temperatura di fusione/solidificazione
cristallina
Il vetro: la solidificazione
La velocità di raffreddamento
cristallizzazione. La viscosità già
è
superiore
a
quella
di
elevata va aumentando con
l‟abbassamento della T: la cristallizzazione è ulteriormente inibita: gli atomi
hanno sempre meno mobilità per trovare il loro “giusto” posto
La variazione di volume specifico è continua
Il liquido è sottoraffreddato in equilibrio termodinamico metastabile
Esiste una temperatura alla quale la variazione di volume specifico
presenta un flesso: Tg=TEMPERATURA DI CONGELAMENTO O Di
TRANSIZIONE VETROSA dallo stato sotto raffreddato allo stato
vetroso
Materiali per l’ottica
Il vetro: la solidificazione
Il volume finale del solido dipende dalla velocità di raffreddamento utilizzata
In generale, le proprietà fisiche del vetro dipendono dalla sua storia termica
Materiali per l’ottica
Il vetro: oltre la solidificazione
Al punto di trasformazione la viscosità è dell‟ordine di 1013 poise
Al di sotto di Tg la contrazione del vetro è di natura termica ovvero
la configurazione molecolare è congelata
La viscosità aumenta e a Tamb è circa 1020 poise
Il materiale si comporta come solido elastico
In qualità di liquido congelato il vetro è un materiale isotropo
Materiali per l’ottica
Il vetro: struttura (silice)
Si è circondato in media da 4 atomi di O
L‟ordine a corto raggio presente nella silice è
analogo a quello a lungo
raggio trovato nella silice cristallina: tetraedri SiO4
collegati per i vertici
L‟allargamento dei picchi indica che le distanze
interatomiche dei tetraedri
variano tra loro (mancanza di ordine a lungo
raggio)
Materiali per l’ottica
Distanza Si-O= 1.6Å
Il vetro: struttura (silice)
Materiali per l’ottica
Il vetro: struttura (silice)
Probabilità di trovare gli atomi in funzione della distanza da
un determinato atomo prescelto
Funzione di distribuzione radiale (FDR) della silice vetrosa
Materiali per l’ottica
Il vetro: struttura (silice)
TEORIA DI ZACHARIASEN (1932)
Si arguisce che che la differenza in energia tra vetro e cristallo della stessa
composizione è molto piccola (altrimenti rapida devetrificazione): metastabilità
prossima a stabilità
Tipo di legami e motivo strutturale (ad es. tetraedro silicico) devono esser identici
perché l‟energia interna è funzione essenzialmente della energia di coesione
Dato però che non si osserva ordine a lungo raggio, mentre nel cristallo le unità
strutturali si ripetono periodicamente nello spazio,nel vetro le unità strutturali di
dispongono in modo casuale distorcendo i legami ma mantenendo le “rete” del
vetro continua
Accordo con i dati XRD ma non spiega l‟esistenza di vetri non costituiti da ossidi
e non giustifica la presenza di gruppi OH- riscontrati nel vetro
Materiali per l’ottica
Il vetro: struttura (silice)
Un ossido dà luogo ad un vetro se:
1. Ogni atomo di ossigeno non è legato a più di 2 cationi
2. Il numero di ossigeni coordinati da ogni catione deve esser piccolo (3 o 4)
3. I poliedri formati dagli atomi di ossigeno devono condividere l‟uno con
l‟altro i vertici ma non spigoli o facce
4. Per dar luogo ad un reticolo tridimensionale devono esser condivisi almeno
tre vertici per poliedro
Materiali per l’ottica
Il vetro: struttura (silice)
TEORIA DI PORAI-KOSHITS (1959)
La struttura del vetro è costituita da domini nanocristallini (D=10-100Å)
Ciascun dominio può anche avere una composizione diversa
Zone con regolare disposizione delle unità strutturali collegate da zone
esterne altamente disordinate
In accordo con i dati XRD, con la presenza di gruppi OH
E‟ compatibile con la presenza di stati vetrosi in materiali non ossidi
e con la trasparenza del vetro
Materiali per l’ottica
Il vetro: struttura (silice)
Confronto tra le due teorie (tra le molte esistenti…)
Zachariasen
Porai-Koshits
Risultati al microscopio ottico hanno evidenziato zone eterogenee ben definite che non sono il
risultato di una separazione di fase e come tali sono stabili ad eventuali trattamenti termici
Materiali per l’ottica
Il vetro: struttura (silice)
I costituenti del vetro si suddividono in :
1.
Formatori: formano il vetro senza l‟introduzione di altri ossidi (network
formers): SiO2, B2O3, P2O5, As2O3. Esistono formatori parziali ovvero
ossidi che formano il vetro con l‟introduzione di almeno un altro ossido:
TeO2, SeO2, MoO3, WO3
2.
Modificatori che modificano la struttura del vetro „rompendo‟ il network
(network modifiers): Na2O, K2O, Li2O, CaO, PbO…La presenza di network
modifiers comporta:
- aumento della mobilità e diminuzione della viscosità (diminuzione
della temperatura di formazione del vetro)
- modifica delle proprietà del vetro a seconda della composizione
1.
Stabilizzanti: riducono i danni dovuti al contatto con agenti esterni, p. es.
acqua: Ca2O, MgO….
Materiali per l’ottica
Il vetro: struttura (silice)
Tra i costituenti del vetro:
Ossidi stabilizzatori
CaO, MgO, PbO, Al2O3, BaO, ZnO…
Additivi
Decoloranti
Coloranti
Opacizzanti
anidride arseniosa, ossido di alluminio
biossido di manganese
ad esempio, Fe, Cr, Ag, Cu, Co
floruri
Esempi di vetri
Silice
“cristallo”
Vetro Crown
Vetro Flint
54.0%
62.0%
42.0%
B2O3
Na2O
5.0%
CaO
5.2%
MgO
K2O
14.0%
PbO
32.0%
K2CO3
Materiali per l’ottica
1.7%
42.0%
21.9%
14.7%
Il vetro: struttura (silice)
Esempio di vetro: sodalime
Usato per finestre e contenitori.
1.
2.
3.
L‟introduzione di un altro ossido (ad esempio Na2O) distrugge la continuità
del reticolo SiO2
L‟apporto dell‟ossido modifica il rapporto Si/O e non è possibile che ciascun
ione O sia legato a 2 atomi di Si.
Esistono degli ioni O che appartengono ad un solo tetraedro (ossigeni non
pontanti: bridging)
Na
O
Si
Materiali per l’ottica
Soda-lime glass
for containers
Properties
Soda-lime glass
for windows
Chemical
composition,
wt%
74 SiO2, 13 Na2O,
10.5 CaO, 1.3 Al2O3,
0.3 K2O, 0.2 SO3,
0.2 MgO, 0.04 Fe2O3,
0.01 TiO2
73 SiO2, 14 Na2O,
9 CaO, 4 MgO,
0.15 Al2O3, 0.03 K2O,
0.02 TiO2, 0.1 Fe2O3
Viscosity
log(η, dPa·s or Poise) = A +
B / (T in °C − To)
550–1450°C:
A = −2.309
B = 3922
To = 291
550–1450°C:
A = −2.585
B = 4215
To = 263
Glass transition
temperature, Tg, °C
573
564
Coefficient of
thermal expansion,
ppm/K, ~100-300°C
9
9.5
Density
at 20°C, g/cm3
2.52
2.53
Refractive index
nD at 20°C
1.518
1.520
Dispersion at 20°C,
104×(nF−nC)
86.7
87.7
Young's modulus
at 20°C, GPa
72
74
Shear modulus
at 20°C, GPa
29.8
29.8
Liquidus
temperature, °C
1040
1000
Heat
capacity at 20°C,
J/(mol·K)
49
48
Surface tension,
at ~1300°C, mJ/m2
315
Chemical durability,
Hydrolytic class,
after ISO 719[5]
3
3...4
Critical stress
intensity factor,[6]
(KIC), MPa.m0.5
?
0.75
Il vetro: effetti composizionali sulle proprietà strutturali
Materiali per l’ottica
Il vetro: effetti composizionali sulle proprietà strutturali
Pressatura (in stampi di ghisa)
Soffiatura
Trafilatura
Formatura di fibre
Materiali per l’ottica
Ricottura: riscaldamento e successivo raffreddamento, per eliminare le tensioni.
Tempra: portare il vetro a Tg<T<Trammollimento
raffreddare con getto d’acqua o bagno d’olio-> si creano tensioni di tipo
radiale tra interno e superficie, a causa della diversa velocita’ di raffreddamento
esterno
interno
Perche’ si abbia rottura di un vetro temprato,
lo sforzo a trazione deve superare
lo sforzo a compressione residua della
superficie.
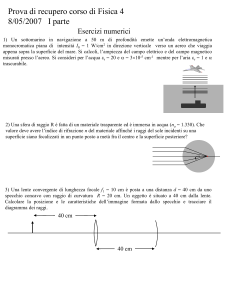
Cap. 13