ASSISTENZA
VENTRICOLARE
A
BREVE
E
MEDIO TERMINE CON POMPA LEVITRONIX
TESI
DI LAUREA DI
UNIVERSITA
VALERIA DONATO
DEGLI STUDI DI NAPOLI
1
INTRODUZIONE
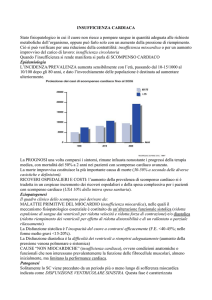
L’insufficienza cardiaca rappresenta uno dei principali
problemi sanitari e una delle più frequenti cause di ricovero
ospedaliero: la sua incidenza è in rapido aumento (1% della
popolazione del mondo occidentale), soprattutto in seguito
all’invecchiamento della popolazione in tutto il mondo,
comprese le nazioni in via di sviluppo. Nonostante i notevoli
progressi della terapia, la prognosi dell’insufficienza cardiaca è ancora sfavorevole.
Tradizionalmente l’insufficienza cardiaca è stata definita come una condizione fisiopatologica nella quale un’alterazione della funzione cardiaca si rende responsabile dell’incapacità del cuore a pompare un volume di sangue adeguato a soddisfare le necessità metaboliche dei diversi tessuti.
2
L’insufficienza cardiaca ha diverse cause eziologiche,
la cui frequenza si è notevolmente modificata nel corso degli anni. Attualmente le cause principali sono rappresentate
dalla malattia coronarica, dalla cardiopatie valvolari, e da
malattie miocardiche primitive tra le quali prevale la cardiomiopatia dilatativa.
Per quel che riguarda le attuali strategie terapeutiche
oggi ci si affida alla terapia farmacologica dal II stadio
NYHA in poi, oppure in caso di insufficienza cardiaca terminale, in IV stadio NYHA, con frazione di eiezione < 20% al
trapianto cardiaco.
Sono sempre più numerosi i dati a favore dell’impiego
dei dispositivi di assistenza ventricolare meccanica nell’insufficienza cardiaca acuta e nello shock. La decisione di
supportare il ventricolo sinistro, il ventricolo destro oppure
entrambi, deve essere basata su dati clinici. Nella maggior
parte dei pazienti vengono impiantati sistemi di supporto
del ventricolo sinistro isolati. La presenza di ipertensione
polmonare pre-esistente e di disfunzione ventricolare destra, aumenta la probabilità che si renda necessario un
3
supporto ventricolare destro, dopo l’inizio di quello sinistro.
Il supporto ventricolare destro isolato è più frequente dopo
trapianto cardiaco ortotopico, allo scopo di sostenere temporaneamente la funzione del ventricolo destro a fronte di
un aumento delle pressioni polmonari prima del trapianto
stesso.
Nei pazienti con indicazione al trapianto cardiaco, in
cui si verifica un deterioramento emodinamico non più controllabile della terapia medica, l’impiego di un cuore artificiale può consentire la sopravvivenza fino alla disponibilità
di un cuore da donatore.
Il cuore artificiale, deve essere specificamente progettato per l’impiego sull’uomo e deve essere in grado di sostituire completamente la portata cardiaca del paziente. L’apparecchio deve inoltre essere di taglia, peso e configurazione compatibili da un punto di vista anatomico e fisiologico,
e non deve ostruire il ritorno venoso o compromettere le
funzioni di altri organi e deve essere, inoltre, in grado di
funzionare in modo sincrono o asincrono con il cuore nativo.
4
Attualmente l’impiego dei VAD (Ventricular Assist Device) è comunque inficiato da un elevato tasso di mortalità e
morbilità. Scopo di questo nostro studio è quello di valutare
la reale efficacia dell’assistenza ventricolare a breve e medio
termine del Levitronix VAD, dispositivo .dotato della tecnologia del “motore senza cuscinetti”, grazie alla quale è stato
possibile realizzare una pompa centrifuga con girante a lievitazione magnetica, che non produce alcun tipo di vibrazione e consente la possibilità di operare a velocità variabile, permettendo un controllo molto accurato della portata e
della pressione in un’ampia gamma operativa.
5
FISIOPATOLOGIA
DELL’INSUFFICIENZA
CARDIACA
Nel mondo l’insufficienza cardiaca è una malattia molto comune e rappresenta una frequente causa di ricovero
ospedaliero. Negli Stati Uniti, ad esempio, sono più di 4 milioni i pazienti affetti da insufficienza cardiaca, con una
prevalenza totale stimata nei soggetti di età superiore ai 65
anni compresa tra 30 e 130 ogni 1000. L’incidenza dell’insufficienza cardiaca aumenta con l’età e, data la rapida crescita della popolazione anziana, l’incremento è destinato a
continuare. Nonostante i continui progressi della terapia, la
mortalità resta elevata. Nella popolazione generale la mortalità a 5 anni per insufficienza cardiaca supera il 50%. Inoltre questa patologia rappresenta una causa di ricovero
ospedaliero molto frequente e riduce la qualità della vita.
6
La prevalenza relativamente elevata dell’insufficienza
cardiaca, ha anche implicazioni economiche, dal momento
che la valutazione diagnostica e la terapia di questa malattia consuma una quota notevole delle risorse per la sanità.
È stato stimato che negli Stati Uniti l’insufficienza cardiaca
sia responsabile di circa 1.000.000 di ricoveri all’anno e che
il costo annuale della terapia superi i venti miliardi di dollari.
L’insufficienza cardiaca può essere definita come una
disfunzione che rende l’organismo incapace di raggiungere
Principali cause di insufficienza cardiaca
Coronaropatia
Ipertensione arteriosa
Malattia valvolare
Miocardite infettiva
Tossine
Cardiomiopatia secondaria a tachicardia
Malattia endocrina
Cardiomiopatia ipertrofica
Collagenopatie vascolari
Distrofie muscolari
Cardiomiopatia peripartum
Deficit nutrizionali
Tabella n.1
una portata cardiaca
adeguata a soddisfare,
in condizioni di riposo
oppure sotto sforzo, le
richieste
metaboliche
sistemiche mantenendo normali le pressioni
di riempimento ventri-
colare. La malattia coronarica e l’ipertensione arteriosa rappresentano le cause principali di insufficienza cardiaca; al-
7
tre eziologie importanti comprendono la cardiomiopatia
idiopatica, le valvulopatie e il diabete mellito.
Sebbene nella maggior parte dei casi l’insufficienza
cardiaca si manifesti come disfunzione ventricolare sinistra,
anche la disfunzione diastolica isolata ne rappresenta una
causa importante. Secondo alcune stime la percentuale dei
pazienti con frazione di eiezione (FE) conservata arriva a
raggiungere il 40% dei casi totali di insufficienza cardiaca,
con percentuali anche superiori negli anziani. L’ipertensione arteriosa, l’ipertrofia ventricolare sinistra e l’ischemia
miocardica sono cause frequenti di alterata funzione diastolica; inoltre, la disfunzione diastolica può verificarsi in seguito a cardiomiopatie restrittive e le malattie pericardiche
di tipo costrittivo possono causare insufficienza cardiaca in
presenza di una normale funzione sistolica. L’insufficienza
cardiaca ad alta gittata è rara, anche se può essere osservata in caso di grave anemia, tireotossicosi, malattia di Paget
o beri-beri.
8
La diagnosi è semplice nei pazienti con i tipici segni e
sintomi quali dispnea o edemi periferici, ma in alcuni casi,
soprattutto tra gli anziani, è possibile che il quadro clinico
sia atipico e caratteriz- Sintomi di insufficienza cardiaca
Stasi polmonare
zato da astenia, disturbi Dispnea da sforzo
Ortopnea
Dispnea parossistica notturna
addominali o
Stasi venosa sistemica
Edemi periferici
alterazioni mentali.
Ascite
Dolore addominale, nausea
La valutazione ini- Ridotta portata cardiaca
Ridotta tolleranza allo sforzo/astenia
Alterazione dello stato mentale/confuziale dei pazienti con so- sione
Tabella n.2
Segni di insufficienza cardiaca all'esame obiettivo
Insufficienza cardiaca sinistra e stasi
polmonare
Rantoli polmonari
Riduzione dei rumori polmonari
Ottusità alla percussione
Terzo tono cardiaco
Dislocazione dell'impulso apicale
Insufficienza cardiaca destra e stasi
venosa sistemica
Edemi periferici
Aumento della pressione venosa giugulare, onda V e depressione Y accentuata
Reflusso epatogiugulare
Epatomegalia
Ascite
Terzo tono cardiaco a destra
Impulso parasternale sinistro
Ridotta portata cardiaca
Tachicardia
Polso alternante
Ridotta pressione differenziale
Ipotensione
Tabella n.3
spetta
insufficienza
cardiaca
deve
com-
prendere la determinazione
della
funzione
ventricolare sinistra e
la valutazione dell’eziologia di base e delle
cause
potenzialmente
reversibili.
9
E’ necessario sospettare sempre la presenza di ischemia reversibile, richiedendo esami non invasivi volti a valutare la vitalità miocardica e l’ischemia inducibile. Infine, nei
pazienti con insufficienza cardiaca fortemente sintomatica,
la valutazione delle variabili prognostiche può fornire informazioni utili, soprattutto nei pazienti per i quali venga presa in considerazione l’opzione del trapianto cardiaco.
Le attuali strategie terapeutiche comprendono la terapia
farmacologia dal II stadio NYHA oppure in caso di insufficienza cardiaca terminale, in IV stadio NYHA, con frazione
di eiezione < 20% il trapianto cardiaco.
Nei pazienti con indicazione al trapianto cardiaco, in
cui si verifica un deterioramento emodinamico non più controllabile della terapia medica, l’impiego di un cuore artificiale può consentire la sopravvivenza fino alla disponibilità
di un cuore da donatore.
1
DISPOSITIVI
DI
SUPPORTO
CIRCOLATORIO
MECCANICI
La storia delle assistenze meccaniche alla circolazione,
fu ipotizzata da Cesar Legallois, medico francese, che nel
1812 scriveva così: “se si potesse sostituire il cuore con una
sorta di iniezione e nello stesso tempo si fosse potuta fornire
all’iniezione in modo continuo una provvista di sangue arterioso sia naturale sia artificiale si sarebbe arrivati a mantenere la vita indefinitivamente”. In queste parole si riassume
il concetto di assistenza meccanica alla circolazione, cioè
una macchina in grado di spingere il sangue nel corpo mimando la funzione di pompa propulsiva del cuore. Tuttavia
solamente nel 1953 grazie al lavoro di Gibbon furono messe
a punto delle macchine per la circolazione extracorporea.
De Bakey nel 1963, fu il primo ad applicare un dispositivo
1
di assistenza meccanica al circolo in un paziente affetto da
scompenso terminale, ma solo nel 1982, dopo anni di ricerca, si è giunti all’impianto da parte di De Vries del Jarvik-7
, il primo cuore
artificiale
totale
del mondo. Negli
ultimi
decenni,
nonostante i notevoli
progressi
sia in ambito medico che chirurgico, la mortalità legata allo scompenso cardiaco non ha accennato a ridursi. Le grandi aspettative alimentate da risultati estremamente confortanti del trapianto
cardiaco sono state ridimensionate dal problema della scarsità di donatori: ancora oggi il numero dei donatori di cuore
disponibili riesce a soddisfare non più del 35-40% delle richieste/anno. Per fare fronte alla necessità di fornire una
opportunità terapeutica al numero crescente di pazienti affetti da scompenso cardiaco, negli ultimi dieci anni si è as-
1
sistito alla rinascita di un fervido interesse intorno ai dispositivi di assistenza meccanica al circolo (VAD).
Sono disponibili diversi sistemi di supporto circolatorio, tra cui:
Contropulsatore aortico, il dispositivo più vecchio e
semplice da inserire;
Sistemi extracorporei simili ai dispositivi di bypass
cardiopolmonare o circolazione extracorporea;
Diversi dispositivi intracorporei, alcuni dei quali sono
stati utilizzati per lunghi periodi di tempo;
Cuori artificiali completi.
I dispositivi di assistenza circolatoria utili in pazienti con
shock cardiogeno o insufficienza cardiaca avanzata oppure
terminale, presentano numerose differenze sia dal punto di
vista concettuale, sia per quello che riguarda le prestazioni
che offrono. I contropulsatori aortici inseriti per via percutanea, sono stati proposti per la prima volta agli inizi degli
anni ’60, come mezzo per sostenere l’insufficienza circolatoria. Anche se questo approccio non è diretto in senso stretto all’aumento meccanico del flusso, esso rimane la forma
1
più utilizzata di assistenza meccanica all’insufficienza ventricolare sinistra.
CONTROPULSATORE AORTICO
Il suo vantaggio
consiste nel fatto
Si gonfia durante la
Diastole
che è semplice da
inserire e compor-
Si sgonfia
durante la sistole
ta un rischio basso;
sfortunata-
mente questo dispositivo può essere lasciato in sede per pochi giorni o massimo qualche settimana, richiede inoltre
l’immobilizzazione del paziente, dato che l’accesso solitamente avviene dall’arteria femorale.
L’assistenza cardiaca meccanica temporale, si può ottenere per brevi periodi anche con pompe extracorporee
non pulsanti a flusso centrifugo, che sono componenti integrati nei bypass cardiopolmonari. Inserendo un dispositivo
di ossigenazione (membrana) si parla di ossigenazione extracorporea a membrana (ECMO). Anche se l’ECMO permette di ottenere un flusso ed un’ossigenazione soddisfacenti, raramente può essere utilizzato al di là di qualche
1
giorno. I fattori che limitano l’utilizzo dell’ECMO, sono i
traumi ai componenti del sangue, la tromboembolia e le infezioni.
Come nel
caso del contropulsatore aortico, l’ECMO è riservato a
quei
pazienti
con
shock cardiogeno e
nei quali si suppone
che la disfunzione
ventricolare sinistra
sia reversibile; in alcuni
pazienti
può
essere inserito in attesa di altri interventi come il trapianto
cardiaco, un dispositivo di assistenza ventricolare permanente.
Alcuni sistemi di assistenza ventricolare, sono stati
ideati per periodi di tempo prolungati, da giorni fino a mesi
o anni. La stessa pompa deve disporre di condotti di afflusso ed efflusso appropriati, con valvole direzionali e sistemi
1
rotanti per generare la corretta direzione del flusso. La camera della pompa costituisce la porzione volumetrica essenziale della macchina, che naturalmente dispone di
un’interfaccia sangue-dispositivo la quale, idealmente, non
traumatizza le componenti ematiche e non ha attività trombogena o immunologica. Il generatore della pompa attiva il
sistema che crea il flusso: di solito si tratta di un componente con un motore elettrico o pneumatico. La fonte di
energia può essere sia la corrente alternata di rete, sia l’alimentazione a batteria; sono stati sviluppati anche interessanti sistemi compatti di batterie sottocutanee.
1
Lo scopo di creare sistemi di supporto circolatorio
Parametri importanti del sistema ideale di supporto circolatorio meccanico a lungo termine
Supporto pressione-flusso efficace
Facilità di rimozione
Riparazione sostituzione rapida in caso di malfunzionamento della pompa
Possibilità di espianto o spegnimento in caso di ripresa della funzione ventricolare
Piccole dimensioni
Fonte di energia efficiente
Possibilità di impianto completo
Assenza di collegamenti percutanei
Silenziosità
Movimenti propri ridotti
Affidabilità
Solidità
Basso rischio di infezioni
Trauma minimo delle componenti del sangue
Assenza di immunogenicità
Tabella n.4
meccanico a lungo termine, devono essere presi in considerazione diversi importanti parametri.
È ovvio che la pompa debba sviluppare una pressione
efficace e sostenere il flusso, ma non è chiaro se per il supporto circolatorio a lungo termine, siano importanti delle
configurazioni pulsatili. Il dispositivo deve essere facilmente
asportabile, in modo che sia possibile una veloce riparazione o sostituzione in caso di malfunzionamento della pompa.
Idealmente esso deve essere semplice da spiantare o disattivare e lasciato in sede senza rischi nel caso in cui si osservi un miglioramento della funzione ventricolare; di piccole dimensioni e completamente impiantabile. Deve utilizzare
1
una fonte energetica efficiente e non avere collegamenti percutanei; infine, è importante che esso sia silenzioso e non
produca movimenti propri. Naturalmente si deve trattare di
un dispositivo affidabile,durevole nel tempo, che non deve
essere immunogenico.
I fattori da considerare valutando i pazienti da sottoporre ad inserimento di un dispositivo di assistenza ventricolare sono:
Gravità dell’alterazione circolatoria;
Probabilità di ripresa della funzione cardiaca;
Presenza di malattie associate o di disfunzioni epatorenali irreversibili;
Idoneità del paziente al trapianto cardiaco;
Il trattamento è controindicato in modo assoluto nei
seguenti casi: scompenso multiorgano; neoplasie maligne;
danno neurologico severo.
Le principali problematiche dell’assistenza ventricolare
sono quelle relative alla trombogenicità dei materiali. I risultati iniziali delle esperienze con supporti meccanici, mostravano l’alta incidenza di complicanze emorragiche e
1
tromboemboliche. Per ovviare queste problematiche, è stata
resa necessaria una monitorizzazione continua di vari parametri, soprattutto emodinamici, come ad esempio:
Pressione venosa centrale;
Pressione arteriosa polmonare;
Pressione arteriosa radiale;
Saturazione venosa mista di
O2;
Emogasanalisi;
Ossimetria pulsata;
Lattati ematici;
Ecocardiogramma transesofageo o transtoracico eseguiti periodicamente.
Attualmente sono disponibili diversi dispositivi; tra
questi il sistema di assistenza
ventricolare extracorporeo Abiomed, è un dispositivo pneumatico con componenti in plastica;
questa pompa viene utilizzata
per tempi relativamente brevi,
1
si applica al letto del paziente e dispone di componenti di
supporto ventricolare destro e sinistro.
Anche il dispositivo di assistenza ventricolare extracorporeo Thoratec è
pneumatico, ma
rispetto al sistema Abiomed è
portatile e può sostenere il circolo per periodo di tempo più
lunghi; possono essere utilizzate diverse combinazioni di
supporto ventricolare sinistro e sinistro e destro.
2
Il sistema di assistenza ventricolare DeBakey-Micromed/NASA è molto piccolo ed è stato ideato per essere inserito al di sotto del diaframma; viene azionato da una piccola
centralina di controllo che
può essere alimentata a
batteria. La pompa è un sistema a flusso continuo
con ventole a rotazione rapida azionate da un motore
magnetico.
2
LEVITRONIX
Il Levitronix è un dispositivo di assistenza ventricolare,
da utilizzarsi tra il breve ed il medio termine (14 giorni).
2
Ideato per pompare sangue in applicazioni circolatorie extracorporee (bypass cardiopolmonare), è costituito da
una piccola unità motrice (87x70 mm) e da un corpo pompa in policarbonato del tipo a perdere, con una portata
massima di 18 l/min ed una pressione massima di 1,1 Bar.
Grazie al suo innovativo design, la velocità di emolisi della
pompa è di circa due volte inferiore a quella delle pompe al
top tecnologico attualmente esistenti. Grazie agli ampi giochi e all’assenza di zona di stagnazione, la pompa senza cu-
2
scinetti consente di evitare trombi e può essere utilizzata
per lungo tempo senza ostruzioni.
Per brevità possiamo
dire che in questa pompa si
trovano riassunti i vantaggi
della pompa canned di tipo
tradizionale o della pompa a
trascinamento
magnetico,
senza i problemi legati alla
lubrificazione dei cuscinetti: non sono presenti giochi e passaggi ridotti, e cosa molto più importante, non avviene alcun rilascio di particelle inquinanti. Dal momento che non
vi è alcuna parte della girante e del corpo della pompa accoppiate meccanicamente fra di loro, la pompa non produce
virtualmente alcun tipo di vibrazione anche in presenza di
una girante non perfettamente bilanciato (ad esempio per
parti solide presenti nel fluido e che si dovessero congiungere alla girante durante il funzionamento). Le pompe senza
cuscinetti risultano essere così molto silenziose ed il solo
2
rumore udibile alle alte
portate è quello idrodinamico del fluido in movimento.
I vantaggi insiti nella
pompa
Levitronix
possono essere catalogati in tre differenti
categorie
e
qui di seguito riassunti:
Vantaggi legati al
design della pompa del tipo canned
nessuna tenuta d’albero conseguente sistema ermetico e senza alcun contatto del liquido pompato con l’esterno.
Vantaggi legati alla levitazione magnetica della girante
Nessuna usura e conseguente riduzione dei tempi di
fermo macchina e bassi costi di manutenzione.
2
Nessuna lubrificazione e conseguente possibilità di
funzionare a secco anche continuativamente.
Nessun gioco né stretto passaggio conseguente facilità
di pulizia possibilità di sterilizzazione e nessuna formazione di pericolosi trombi.
Nessuna generazione di particelle inquinanti.
Ampia gamma di temperature.
Vibrazioni virtualmente assenti.
Dimensioni molto ridotte.
Vantaggi legati al controllo elettronico della velocità
Controllo della portata senza orifizi tarati – conseguente alta efficienza del sistema.
Controllo preciso della portata e della pressione.
Portata continua o pulsante ottenibile attraverso il
controllo elettronico.
Pompa a singolo stadio ad elevata pressione.
Dimensioni ridotte rispetto alle pompe a membrana o
a soffietto con prestazioni equivalenti.
2
PAZIENTI
E METODI
Il presente studio è stato condotto dall’ agosto 2003 al
maggio 2006 raccogliendo i dati provenienti da 19 strutture
ospedaliere in Italia dove sono stati impiantati 54 device di
tipo Levitronix, di questi 17 impiantati in pazienti donne e
37 in pazienti di sesso maschile con un’età compresa tra i
15 e gli 80 anni. Dei 54 pazienti il 37% ha ricevuto un’assistenza ventricolare sinistra (LVAD), il 15% un’assistenza
ventricolare destra (RVAD), il 13% un’assistenza biventricolare (BVAD), il 29% un ossigenatore extracorporeo (ECMO),
mentre il restante 6% ha ricevuto un’assistenza di tipo misto; la durata media dell’impianto è stata di circa 10 giorni
con un minimo di un giorno ed un massimo di 28 giorni; in
un controllo effettuato a trenta giorni dall’impianto il 61%
dei 54 pazienti è deceduto. Nel mio studio, in particolare,
ho seguito in prima persona, gli impianti effettuati presso
2
l’Azienda Ospedaliera “San Camillo-Forlanini” di Roma. In
questa struttura sono stati osservati 16 pazienti, 11 maschi
e 5 donne con un’età media di 70 anni.
Tutti i pazienti erano ascrivibili allo stadio IV della
classificazione NYHA, gravemente scompensati da un punto
di vista emodinamico, con una frazione di eiezione del ventricolo sinistro (FEVS) inferiore al 20%, inoltre nessuno dei
pazienti aveva tratto beneficio dall’opportuna terapia farmacologica. Per quanto riguarda l’etiologia, si rimanda alla tabella n 5.
2
5
4
3
2
1
rd
io
ge
no
a
o
Sh
oc
k
di
la
ta
pa
ti a
C
ar
di
om
io
ca
tiv
et
t
di
s
tu
ra
Ro
t
io
ca
rd
i te
M
rd
io
to
-c
a
Po
st
Po
st
-t
r
ap
ia
n
m
ia
to
0
Tabella n.5
Escluse le concomitanti patologie che potessero controindicare l’uso del device si è proceduti all’impianto della
pompa Levitronix.
2
Dei 16 pazienti presi in esame il 57% (9 pz.) ha ricevuto un’assistenza ventricolare sinistra (LVAD), il 12% (2 pz.)
un’assistenza ventricolare destra (RVAD), il 19% (3 pz.)
un’assistenza biventricolare (BVAD), mentre il restante 12%
(2 pz.) ha ricevuto un’assistenza ventricolare con un ossigenatore
ex-
tracorporeo
(ECMO).
Per
quanto
ri-
guarda
l’assistenza
ventricolare
sinistra si è
proceduti con una sternotomia mediana, quindi è stata inserita una cannula in atrio sinistro a livello della giunzione
tra vena destra polmonare superiore ed atrio sinistro; l’altra
cannula, invece, è stata introdotta in aorta ascendente.
3
Per quanto riguarda l’assistenza ventricolare destra le
cannule sono state posizionate in atrio destro e in arteria
polmonare. Per quanto riguarda, infine, l’assistenza biventricolare è stato allestito un doppio circuito. Tutte le cannule, infine, sono state
suturate con prolene 1-0 e tutte connesse al circuito.
Non sono stati
somministrati anticoagulanti
prime
per
6-12
le
ore,
quando, poi, il flusso del drenaggio è
sceso al di sotto dei 50ml/h si è proceduti all’infusione di
un bolo di eparina al fine mantenere un aPTT tra 1.5 e 2.5
volte il valore normale per tutta la durata del supporto.
In tutti quei pazienti che hanno richiesto una assistenza ventricolare destra il numero di giri per minuto variava tra i 2.500 e i 3.500 giri, mentre in quelli che hanno
3
necessitato di una assistenza sinistra, il numero di giri era
compreso tra i 3.000 ed i 4.500 al fine di garantire sempre
e comunque un flusso compreso di 5-7 l/min.
Di tutti i pazienti, sono stati continuamente valutati e
monitorati i parametri vitali ed eseguiti esami strumentali e
di laboratorio, quali:
Pressione venosa centrale;
Pressione arteriosa polmonare;
Pressione arteriosa radiale;
Saturazione venosa mista di O2;
Emogasanalisi;
Ossimetria pulsata;
Lattati ematici;
Ecocardiogramma transesofageo o transtoracico eseguiti periodicamente;
Esame emocromocitometrico.
3
RISULTATI
Dopo l’impianto del Levitronix abbiamo ritenuto che la
mortalità a 30 giorni fosse un buon parametro per valutare
la funzionalità della pompa a breve e medio termine.
La durata media dell’assistenza ventricolare è stata di
11 giorni con un minimo di 1 ed un massimo di 28. Dei 16
pazienti, gia comunque gravemente compromessi da un
punto di vista emodinamico, il 43% (7 pz.) è deceduto, di
cui uno per complicanze non cardiovascolari, invece il restante 57% (9 pz.) è sopravvissuto. Durante il periodo di assistenza ventricolare il device non ha dato problemi di sorta, non si sono verificati casi di emolisi o trombosi.
3
DISCUSSIONE
E
CONCLUSIONI
In Letteratura sono descritte numerose apparecchiature per l’assistenza ventricolare, tuttavia abbiamo voluto
soffermare la nostra attenzione sul sistema Levitronix attualmente all’avanguardia per il suo meccanismo di funzionamento, essendo l’unica pompa centrifuga a lievitazione
magnetica certificata per un utilizzo di 14gg. La nostra
esperienza dimostra che il Levitronix è risultato essere un
sistema valido ed efficace, può essere usato per il supporto
sia per il ventricolo sinistro sia per il ventricolo destro oppure entrambi. Può provvedere, in tutta sicurezza, ad un
flusso superiore ai 10 l/min che può essere opportunamente adeguato secondo le differenti condizioni cliniche. Il device è in grado di garantire un flusso ottimale già ad un basso numero di giri provvedendo ad una adeguata decompressione dei ventricoli.
3
Abbiamo ritenuto che la mortalità a 30 giorni fosse un
buon parametro per valutare la funzionalità della pompa a
breve termine. Il nostro tasso di mortalità del 43% concorda
pienamente con altre statistiche riportate in Letteratura.
Anche se possono essere usati altri dispositivi, il Levitronix
è risultato essere il più efficace e dotato di un buon rapporto costo-beneficio. Sono state usate anche altre pompe centrifughe in particolare nella post-cardiotomia e in shock
cardiogeno, ma la mortalità associata ad essa è risultata
elevata.
L’intervento di posizionamento non richiede l’uso della
circolazione extracorporea. In molti pazienti infatti l’impianto è stato effettuato off-pump. La procedura di impianto
non è tecnicamente laboriosa e richiama la tecnica usata di
routine per effettuare un by-pass cardiopolmonare. Il sistema è facile da usare e può essere gestito dal tecnico perfusionista il quale provvederà a monitorare i parametri vitali
del paziente e valuterà il corretto funzionamento del device.
3
La caratteristica delle pompe magnetiche, è l’assenza di
cuscinetti. Il teorico vantaggio
del Levitronix è quello di ridurre
il danno delle emazie perché garantisce un attrito minimo ed
una irrilevante produzione di calore; inoltre ci sono meno aree di
ristagno di sangue e meno parti meccaniche che possono
essere responsabili di un malfunzionamento.
3
La durata totale del supporto è di circa 14 giorni,
mentre nel biventricolare è di circa 20-24 giorni. In particolare, in Letteratura, è stato descritto il caso di un paziente
assistito per 64 giorni dopo i quali è deceduto per un’insufficienza multiorgano. Durante il periodo di utilizzo del device non è accorsa alcuna rottura o inconveniente tecnico.
Il razionale dell’utilizzo del Levitronix nell’assistenza a
breve termine risiede nel fatto che tali pazienti necessitano
di un sistema versatile e riabilitativo che possa essere velocemente implementato in situazioni di rapido deterioramento.
L’assenza di inconvenienti tecnici e di un basso tasso
di complicanze fanno sì che il Levitronix sia il dispositivo
ideale per quei pazienti che necessitano di tempi più lunghi
per valutazioni o approfondimenti clinici.
In conclusione, la nostra esperienza dimostra che il
Levitronix è un sistema particolarmente efficace e versatile
nel trattamento delle insufficienze cardiache refrattarie alla
terapia farmacologica e che necessitano di un trapianto
cardiaco.
3
BIBLIOGRAFIA
De Robert is F, Birks EJ, Rogers-P, Dreyfus G, Pepper JR, Khaghani A
Clinical performance with the Levitronix Centrimag
short-term ventricular assist device.J Heart Lung Transplant. 2006 Feb;25(2):181-6. Epub 2006 Jan 6.
Rodrigus IE, Amsel BJ, Conraads V, De Hert S,
Moulijn AC. Emergency ventricular assist device: better
survival rates in non-post cardiotomy-related cardiogenic
shock. Acta Chir Belg. 2001 Sep-Oct;101(5):226-31.
Lee WA, Gillinov AM, Cameron DE, Thompson S,
Birenbaum I, Baumgartner WA, Stuart RS, Watkins L,
Gardner TJ, Gott VL, et al Centrifugal ventricular assist
3
device for support of the failing heart after cardiac surgery.
Crit Care Med. 1993 Aug;21(8):1186-91.
Santise G, Petrou M, Pepper JR, Dreyfus G, Khaghani A, Birks EJ. Levitronix as a short-term salvage treatment for primary graft failure after heart transplantation. J
Heart Lung Transplant. 2006 May;25(5):495-8. Epub 2006
Mar 24.
Minami K, el-Banayosy A, Posival H, Seggewiss H,
Murray E, Korner MM, Korfer R Improvement of survival
rate in patients with cardiogenic shock by using nonpulsatile and pulsatile ventricular assist device. Int J Artif Organs. 1992 Dec;15(12):715-21.
DeRose JJ Jr, Umana JP, Argenziano M, Catanese
KA, Levin HR, Sun BC, Rose EA, Oz MC Improved results
for postcardiotomy cardiogenic shock with the use of implantable left ventricular assist devices. Ann Thorac Surg.
1997 Dec;64(6):1757-62; discussion 1762-3.
3
Hoefer D, Ruttmann E, Poelzl G, Kilo J, Hoermann
C, Margreiter R, Laufer G, Antretter H. Outcome evaluation of the bridge-to-bridge concept in patients with cardiogenic shock. Ann Thorac Surg. 2006 Jul;82(1):28-33.
Williams M, Casher J, Joshi N, Hankinson T, Warren M, Oz M, Naka Y, Mancini D Insertion of a left
ventricular assist device in patients without thorough
transplant evaluations: a worthwhile risk? J Thorac Cardiovasc Surg. 2003 Aug;126(2):436-41.
Schiessler A, Friedel N, Weng Y, Heinz U, Hummel
M, Hetzer R. Mechanical circulatory support and heart
transplantation. Pre-operative status and outcome. ASAIO
J. 1994 Jul-Sep;40(3):M476-81.
DeRose JJ, Argenziano M, Sun BC, Reemtsma K,
Oz MC, Rose EA. Implantable left ventricular assist
4
devices: an evolving long-term cardiac replacement therapy.
Ann Surg. 1997 Oct;226(4):461-8; discussion 468-70.
Tisol WB, Mueller DK, Hoy FB, Gomez RC, Clemson
BS, Hussain SM. Ventricular assist device use with mechanical heart valves: an outcome series and literature review. Ann Thorac Surg. 2001 Dec;72(6):2051-4; discussion
2055. Review.
Hetzer R, Weng Y, Potapov EV, Pasic M, Drews T,
Jurmann M, Hennig E, Muller J. First experiences with a
novel magnetically suspended axial flow left ventricular assist device. Eur J Cardiothorac Surg. 2004 Jun;25(6):96470.
Jaski BE, Branch KR, Adamson R, Peterson KL,
Gordon JB, Hoagland PM, Smith SC Jr, Daily PO, Dembitsky WP. Exercise hemodynamics during long-term implantation of a left ventricular assist device in patients
4
awaiting heart transplantation. J Am Coll Cardiol. 1993
Nov 15;22(6):1574-80.
Pagani FD, Lynch W, Swaniker F, Dyke DB, Bartlett
R, Koelling T, Moscucci M, Deeb GM, Bolling S, Monaghan H, Aaronson KD. Extracorporeal life support to left
ventricular assist device bridge to heart transplant: A
strategy to optimize survival and resource utilization. Circulation. 1999 Nov 9;100(19 Suppl):II206-10.
Houel R, Vermes E, Le Besnerais P, Hillion ML, Alimoussa B, Loisance DY External ventricular support in
primary cardiogenic shock Arch Mal Coeur Vaiss. 2000
Feb;93(2):131-8.
Dang NC, Topkara VK, Mercando M, Kay J, Kruger
KH, Aboodi MS, Oz MC, Naka Y. Right heart failure after
left ventricular assist device implantation in patients with
chronic congestive heart failure. J Heart Lung Transplant.
2006 Jan;25(1):1-6. Epub 2005 Dec 9.
4
Helman DN, Morales DL, Edwards NM, Mancini DM,
Chen JM, Rose EA, Oz MC. Left ventricular assist device
bridge-to-transplant network improves survival after failed
cardiotomy. Ann Thorac Surg. 1999 Oct;68(4):1187-94.
Golding LA, Crouch RD, Stewart RW, Novoa R,
Lytle BW, McCarthy PM, Taylor PC, Loop FD, Cosgrove
DM 3rd Postcardiotomy centrifugal mechanical ventricular
support. Ann Thorac Surg. 1992 Dec;54(6):1059-63; discussion 1063-4.
Park SJ, Nguyen DQ, Bank AJ, Ormaza S, Bolman
RM 3rd. Left ventricular assist device bridge therapy for
acute myocardial infarction. Ann Thorac Surg. 2000
Apr;69(4):1146-51.
MacGowan GA, Kormos RL, McNamara DM, Alvarez
RJ, Rosenblum WD, Pham S, Feldman AM, Murali S Predicting short-term outcome in severely ill heart failure pa-
4
tients: implications regarding listing for urgent cardiac
transplantation
and
patient
selection
for
temporary
ventricular assist device support. J Card Fail. 1998
Sep;4(3):169-75.
Bowen FW, Carboni AF, O'Hara ML, Pochettino A,
Rosengard BR, Morris RJ, Gorman RC, Gorman JH 3rd,
Acker MA Application of "double bridge mechanical" resuscitation for profound cardiogenic shock leading to cardiac
transplantation. Ann Thorac Surg. 2001 Jul;72(1):86-90.
Drews
TN,
Loebe
M,
Jurmann
MJ,
Weng
Y,
Wendelmuth C, Hetzer R. Outpatients on mechanical circulatory support. Ann Thorac Surg. 2003 Mar;75(3):780-5;
discussion 785.
Loebe M, Hennig E, Muller J, Spiegelsberger S,
Weng Y, Hetzer R. Long-term mechanical circulatory support as a bridge to transplantation, for recovery from cardi-
4
omyopathy, and for permanent replacement. Eur J Cardiothorac Surg. 1997 Apr;11 Suppl:S18-24.
Massad MG, McCarthy PM, Smedira NG, Cook DJ,
Ratliff NB, Goormastic M, Vargo RL, Navia J, Young JB,
Stewart RW. Does successful bridging with the implantable
left ventricular assist device affect cardiac transplantation
outcome?
J
Thorac
Cardiovasc
Surg.
1996
Nov;112(5):1275-81; discussion 1282-3.
Oz MC, Argenziano M, Catanese KA, Gardocki MT,
Goldstein DJ, Ashton RC, Gelijns AC, Rose EA, Levin
HR. Bridge experience with long-term implantable left
ventricular assist devices. Are they an alternative to transplantation?Circulation. 1997 Apr1;95(7):1844-52.
Argenziano M, Catanese KA, Moazami N, Gardocki
MT, Weinberg AD, Clavenna MW, Rose EA, Scully BE,
Levin HR, Oz MC. The influence of infection on survival
and
successful
transplantation
in
patients
with
left
4
ventricular assist devices. J Heart Lung Transplant. 1997
Aug;16(8):822-31.
4