CHIMICA ORGANICA
COMPITO PARZIALE 5 maggio 2010
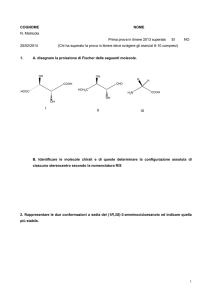
1. Nominate i seguenti composti e, nel caso siano presenti stereocentri, scrivete i possibili
stereoisomeri e attribuite a ciascuno la notazione R/S.
Br
H
Cl
Cl
Br
I
A
Cl
H
B
I
H
D
C
E
2. Dite quanti isomeri sono possibili per l'1-bromo-2-metilcicloesano, disegnarli ed evidenziare le
relative relazioni stereochimiche. Il cis-1-bromo-2-metilcicloesano, per eliminazione E2, forma due
diversi cicloalcheni, mentre l'isomero trans ne forma solo uno. Spiegate il perché servendovi delle
opportune formule di struttura e, nel caso del derivato cis, prevedete quale dei due alcheni sarà il
prodotto maggioritario.
3. A seconda del meccanismo che pensate sia operante in ciascun caso, prevedete il/i prodotto/i
delle reazioni tra:
i) tosilato del (R)-2-butanolo e metantiolato (solvente etere etilico);
ii) tosilato del (R)-3,4-dimetil-3-pentanolo e ione idrossido (solvente etanolo).
4. Nominate i seguenti composti aromatici usando anche eventuali possibili alternative.
OH
OH
O
Br
I
Br
O2N
NO2
Cl
H2N
5. Scrivete il/i prodotto/i della reazione tra 2-clorobenzene o 2-nitrobenzene con isobutil cloruro e
AlCl3 con eventuali commenti sulla loro fattibilità (che tipo di reazione è?).
1
CHIMICA ORGANICA
COMPITO PARZIALE 7 giugno 2010
1. Dovete preparare l'iso-propil metil etere (o metil 2-propil etere) mediante reazione di Williamson
tra un alcolato e uno ioduro alchilico: proponete le possibili coppie di reagenti di partenza e
discutete gli eventuali problemi derivanti dall'uso di tali coppie. Cosa cambierebbe se invece
dell'etere voleste sintetizzare l'analogo tioetere (metil 2-propil solfuro)?
2. Proponete un metodo di sintesi dell'(S)-2-pentanolo (enantiomericamente puro!) a partire da un
opportuno alogenuro alchilico. Discutete la possibilità di usare diversi reagenti e solventi e valutate
gli eventuali problemi.
3. Prevedete quanti e quali prodotti si formano nella seguente reazione (e in quale conformazione
favorita) e discutere il meccanismo:
ter-BuO-K+
Br
OH
H
ter-BuOH
H
H
ter-BuO-K+
Me
Br
H
OH
ter-BuOH
H
4. Scrivete il meccanismo dettagliato per trasformare la benzaldeide in benzaldeide dimetilacetale.
5. Scrivete il prodotto della seguente reazione:
O
H
O
MeMgBr
O
(eccesso)
Cosa pensate succederebbe se usassimo un solo equivalente di reattivo di Grignard? Come
potremmo, da questa reazione, ottenere selettivamente un alcol terziario?
6. Sintetizzate l'acido 2-metilbutirrico (o 2-metilbutanoico) a partire da dietil malonato e altri
opportuni reagenti.
7. Individuate i prodotti (A-C) delle seguenti reazioni:
HO
H
p-toluenesolfonil cloruro
(tosil cloruro)
A
piridina
KCN
acetone
B
LiAlH4
THF
C
Provate a individuare un metodo analogo di sintesi dell'enantiomero opposto del prodotto finale C.
2
CHIMICA ORGANICA
COMPITO PARZIALE 18 aprile 2011
1. Nominate i seguenti composti indicando gli eventuali carboni asimmetrici.
Br
B
A
D
C
2. Identificate i centri di asimmetria delle seguenti molecole, attribuite la configurazione R ed S,
scrivete il nome completo di ciascuna e dite che tipo di stereoisomeri sono.
H
F
CH3
Br
CH3
H
Br
F
H
CH3
H
CH3
3. Scrivete la struttura di tutti i possibili stereoisomeri del 2,4-dicloropentano in proiezioni di
Fischer e indicate le relazioni stereochimiche tra i vari isomeri (enantiomeri, diastereoisomeri,
eventuali forme meso/d,l, ecc.). Fate poi la stessa cosa per il 2-bromo-4-cloropentano.
4. Proponete un metodo di sintesi del 3-metil-1-pentanolo e del 3-metil-2-pentanolo a partire dal 3metil-1-pentene. Discutete e paragonate i meccanismi delle reazioni coinvolte e i possibili problemi
che potrebbero verificarsi nelle due sintesi.
5. Scrivete i prodotti delle reazioni di 1-butene e 1-butino con
a. acido bromidrico
b. Br2/CCl4 (solvente)
c. Br2/H2O
d. NaH
discutendo le eventuali implicazioni stereochimiche sulla formazione dei prodotti.
6. Scrivete, e discutete, i prodotti delle reazioni dei seguenti aromatici con Cl2/AlCl3.
Cl
OH
OH
NO2
O
Cl
O
-
Qualcuno di questi composti reagirebbe col nucleofilo OH? E per dare cosa?
3
CHIMICA ORGANICA
COMPITO PARZIALE 3 giugno 2011
1. Tra le seguenti coppie di reazioni, stabilite qual è la più veloce, indicando il/i prodotto/i che si
forma/no e discutendo il tipo di meccanismo coinvolto.
Br (1 M) + MeO- (1 M)
a
Br (1 M) + MeO- (2 M)
Cl (1 M) + EtO- (1 M)
b
Cl (1 M) + EtO- (2 M)
2. Scrivete i prodotti che si formano nelle seguenti reazioni:
H
Cl
+
-
DMF
CN
(DMF = N,N-dimetilformammide [solvente])
Br +
-
OEt
3. Scrivete il/i prodotto/i che si forma/no dalla reazione del seguente epossido
O
con acido cloridrico.
Cosa si otterrebbe trattando il/i prodotto/i con:
a) sodio ammide (NaNH2);
b) tosil cloruro seguito da sodio ioduro.
4. Proponete un metodo di sintesi della seguente ammina
N
H
Ph
a partire da anilina (benzenammina) e un opportuno composto carbonilico, descrivendo nei dettagli
i meccanismi delle reazioni coinvolte.
4
5. Proponete un meccanismo per la reazione che permette di sintetizzare il seguente composto
O
O
a partire da 2-metilcicloesan-1,3-dione e metil vinil chetone in presenza di soda caustica,
giustificando i vari passaggi.
6. Scrivete i prodotti derivanti dalle reazioni del propanoato di etile con
soluzione acquosa acida;
soluzione acquosa basica;
litio alluminio idruro;
fenil magnesio bromuro (eccesso);
etilato di sodio (NaOEt) in etanolo.
5
LABORATORIO DI CHIMICA ORGANICA
COMPITO PARZIALE 5 maggio 2010
1. Abbiamo una miscela dei due composti:
O
O
O2N
A
B
Il composto A ha un punto di ebollizione di 140 °C, mentre B di 80 °C. Decidiamo di separarli
mediante distillazione frazionata. Distilliamo una certa quantità di B alla temperatura di 79-82 °C,
poi la temperatura in testa alla colonna di distillazione si innalza velocemente ma si stabilizza a
155-157 °C e rimane fissa praticamente fino alla fine della distillazione. Secondo voi, cosa sta
succedendo? Giustificate il fenomeno fisico che ritenete responsabile dell'osservazione. Come
pensate di verificare le vostre ipotesi? Fate delle previsioni sugli spettri IR e 1H NMR dei due
composti e giudicate se gli spettri di miscele di A e B possono evidenziare opportunamente la
presenza di entrambi i composti.
2. Abbiamo una miscela dei seguenti composti:
NH2
OH
OH
SH
N
O2N
NO2
NO2
pKa = 10
pKa = 10.5
pKa = 17
pKa (NH+) = 11
pKa (NH+) = -9.3
Proponete un metodo di separazione considerando che avete a disposizione dell'etere etilico, una
soluzione acquosa al 10% di acido solforico (pKa = -3) e una soluzione acquosa di NaOH. Stabilire
fino a che punto si può spingere la separazione con questi 'solventi' ed, eventualmente, cosa si può
fare se alcuni composti rimangono miscelati.
6
LABORATORIO DI CHIMICA ORGANICA
COMPITO PARZIALE 7 giugno 2010
1. Dovete realizzare in laboratorio la seguente sintesi:
O
Bu
N
Bu NH2
LiAlH4
Bu
N
H
- H2O
Descrivete come operereste sperimentalmente per effettuare i due passaggi, indicando i rapporti
stechiometrici, i solventi, il tipo di workup e sottolineando eventuali problemi ai quali porre
attenzione durante le varie fasi.
Se, dopo il workup, il prodotto finale fosse ancora contaminato da discrete quantità di nbutilammina, pensate che una cromatografia su colonna potrebbe portarvi a una purificazione?
Dato che i reagenti di partenza hanno un peso molecolare abbastanza basso, potrebbe valere la
pena, prima di porli a reagire, reperire i rispettivi punti di ebollizione per evitare problemi (quali?)
nel caso decidiate di scaldarli in un solvente a riflusso: come agite per trovare tali dati? Quali fonti
pensate di consultare (partendo dalle più banali per arrivare fino a quelle più complesse)? Mettete in
evidenza pregi e difetti delle varie fonti e/o banche dati.
7
LABORATORIO DI CHIMICA ORGANICA
COMPITO PARZIALE 18 aprile 2011
1. Vi viene data una miscela dei seguenti composti liquidi A e B.
O
H3C
O
H3C
H3C
A
O
H
CH3
B
I punti di ebollizione sono 115-117 °C e 72-74 °C per A e B rispettivamente.
Quando cercate di separare una miscela 70:30 di A e B per distillazione frazionata osservate che il
primo distillato condensa quando il termometro segna la temperatura di 55-57 °C. Tale temperatura
resta costante fino al raccoglimento di un certo volume di distillato, quindi si alza bruscamente fino
a raggiungere i 114-117 °C e resta costante in quell'intervallo fino alla fine della distillazione.
Secondo voi cos'è successo? Spiegate i principi teorici alla base del fenomeno, dettagliando il più
possibile ed esemplificando con un diagramma di fase che possa adattarsi ragionevolmente al caso
in esame.
2. Quali tecniche spettroscopiche potreste usare per evidenziare la composizione del distillato
ottenuto nell'esercizio precedente alla temperatura di 55-57 °C? Anche qui, dettagliare il più
possibile la risposta.
3. Vi viene data una miscela di vinilbenzene (A), etilbenzene (B), butirrato di sodio (C) e acido
butirrico (D):
O
O
O-Na+
A
B
C
OH
D
Quale procedura potreste usare per separare questa miscela con la tecnica dell'estrazione? Nel caso
otteniate miscele inseparabili di alcuni di questi prodotti, potreste ancora una volta usare delle
tecniche spettroscopiche per determinarne quali- e quantitativamente il contenuto?
8
LABORATORIO DI CHIMICA ORGANICA
COMPITO PARZIALE 3 giugno 2011
1. Dire quali dei seguenti solventi sono adatti per condurre una riduzione di un chetone con litio
alluminio idruro (LiAlH4) o sodio boro idruro (NaBH4):
soluzione acquosa acida
soluzione acquosa basica
metanolo
dietil etere
acetone
motivando le risposte.
Mostrare il meccanismo della reazione di riduzione di un generico chetone con NaBH4, proporre un
metodo sperimentale per condurre la reazione (in particolare i rapporti stechiometrici) e un workup
di fine reazione, mostrando tutti i prodotti finali.
2. Spiegare la differenza tra letteratura primaria e secondaria. Se si sta cercando il punto di fusione
di una sostanza, si hanno maggiori speranze di trovarlo immediatamente consultando:
un articolo
una comunicazione
una "supporting information"
il Chemical Abstracts
il Beilstein
un "handbook"
motivando le risposte.
3. Proporre un metodo cromatografico per separare una miscela costituita da un idrocarburo
aromatico, un chetone e un'ammina, spiegando quali eluenti usereste tra:
etere di petrolio
dietil etere
acetone
miscele dei precedenti
prevedendo l'ordine di eluizione e motivando opportunamente le scelte.
9
Chimica Organica 1 – Bologna – Esame scritto 19/06/2012
N. B. Per ogni esercizio occorre spiegare il più dettagliatamente possibile i singoli passaggi,
evidenziando i meccanismi e, quando necessario, la stereochimica delle molecole coinvolte
(sia come reagenti che come prodotti), la struttura di eventuali intermedi reattivi e, se
necessario per la discussione, quella delle relative possibili forme di risonanza.
1. Esercizio n. 1.
• Prevedere il/i prodotto/i della reazione tra 1-butene e acqua in ambiente acido.
• Fare poi la stessa cosa per il 3-fenilpropene e per il 3-fluorobut-1-ene, valutando bene se
in uno di questi casi può operare un meccanismo aggiuntivo.
• Se in uno/alcuni/tutti i casi precedenti si formano enantiomeri e/o diastereoisomeri,
specificarne il tipo e disegnarne la struttura sia in proiezione di Fischer che usando i
legami a cuneo, attribuendo a ciascun centro asimmetrico la configurazione R o S.
2. Esercizio n. 2.
• Prevedere il/i prodotto/i di reazione tra il trans-1-cloro-4-metilcicloesano e sodio bromuro
in acetone, spiegando il tipo di meccanismo coinvolto e il ruolo del solvente.
• Fare poi la stessa cosa per la reazione dello stesso trans-1-cloro-4-metilcicloesano con
ter-butilato di sodio in ter-butanolo, spiegando ancora un volta il tipo di meccanismo
coinvolto.
• Se in uno/tutti i casi precedenti si formano stereoisomeri, specificarne il tipo e disegnarne
la struttura usando i legami a cuneo.
3. Esercizio n. 3.
• Dare i possibili nomi (sia comuni che IUPAC) al seguente composto
NH2
Br
•
e sintetizzarlo a partire da benzene coi reattivi che ritenete più opportuni, spiegando i
meccanismi coinvolti in ciascun passaggio.
Fare la stessa cosa col composto
NH2
O
partendo da 4-cloronitrobenzene.
10
CH3
4. Esercizio n. 4.
• Prevedere il/i prodotto/i di reazione tra il 3-fenilpropanale e:
Anilina;
Dietilammina;
Acqua alcalina (HO-);
Acido cromico [(Cr(VI)] seguito da ammoniaca;
Acido cromico [(Cr(VI)] seguito da butanolo in ambiente acido catalitico.
5. Esercizio n. 5.
Data la seguente miscela di composti
NH2
O
NH2
OH
proporre un metodo per separarli spiegando operativamente come procedereste.
6. Esercizio n. 6.
Proporre almeno due metodi, di cui uno spettroscopico, per evidenziare la bontà della
separazione ottenuta nell'esercizio precedente, spiegando opportunamente i motivi della
scelta e quello che vi aspettate di osservare sperimentalmente.
11
Chimica Organica 1 – Bologna – Esame scritto 17/07/2012
N. B. Per ogni esercizio occorre spiegare il più dettagliatamente possibile i singoli passaggi,
evidenziando i meccanismi e, quando necessario, la stereochimica delle molecole coinvolte
(sia come reagenti che come prodotti), la struttura di eventuali intermedi reattivi e, se
necessario per la discussione, quella delle relative possibili forme di risonanza.
1. Esercizio n. 1 (5 punti).
• Proporre almeno due metodi di sintesi dell'1-pentanolo partendo da molecole di vostra
scelta. Per ciascun metodo discutere i meccanismi coinvolti.
2. Esercizio n. 2 (5 punti).
• La reazione tra (Z)-3-metil-2-esene e acido bromidrico è stata condotta in due condizioni
diverse in modo da avere prodotti Markovnikov e anti-Markovnikov: nella prima si è
formato un prodotto come miscela racemica di due enantiomeri, mentre nella seconda si è
formata una miscela di diastereoisomeri. Dedurre da questo dato le condizioni in cui sono
avvenute le due reazioni, discutere i meccanismi e scrivere le configurazioni di tutti gli
stereoisomeri formati.
3. Esercizio n. 3 (7 punti).
• Discutere la reazione tra benzene e 1-cloropropano in presenza di tricloruro di alluminio,
mettendo bene in evidenza il meccanismo e tutti i sottoprodotti che si possono formare.
Quale potrebbe essere un metodo 'pulito' (cioè senza sottoprodotti) per ottenere il
n-propilbenzene (1-fenilpropano)?
• Suggerire dei reattivi per effettuare le seguenti trasformazioni:
NO2
NO2
NO2
?
?
?
?
?
OCH3
OCH3
OCH3
OH
Cl
Cl
NH2
Br
4. Esercizio n. 4 (7 punti).
• Prevedere il/i prodotto/i delle seguenti reazioni:
Fenilacetaldeide (2-feniletanale) + glicole etilenico (1,2-etandiolo) con H+ catalitico;
Fenilacetaldeide + HO-;
Etil propionato (etil propanoato) + etilato di sodio (EtONa);
Acido 4-idrossibutirrico (4-idrossibutanoico) con H+ catalitico.
12
5. Esercizio n. 5 (10 punti).
Considerate la seguente reazione, molto simile ad una che avete eseguito in laboratorio:
O
O
+ X
MeOH
H
O
•
•
•
•
•
OH
che cos’è il reagente X che manca?
quante mmol di X sono teoricamente necessarie per trasformare 4 mmol di chetone?
Alla fine della reazione, dopo opportuno workup (quale potrebbe essere?), ottenete un
prodotto grezzo solido contaminato da circa un 5% di un’impurezza ignota. Quale tecnica
di purificazione utilizzereste per ottenere il prodotto puro?
Per confermare l'identità del prodotto procedete a una ricerca in letteratura del suo punto
di fusione. Come fareste? Dopo averlo trovato (p.f. = 77 °C) 1 come procedereste per
identificare correttamente il prodotto?
L’impurezza presente nel grezzo è un sottoprodotto caratterizzato dagli spettri 1H NMR
(con i valori di integrale riportati accanto ai segnali), IR e massa riportati di seguito: che
composto è? Specificate i segnali caratteristici che vi hanno consentito la determinazione
della sua struttura.
Spettro di massa:
Spettro infrarosso:
1
Ghosh, S.; Datta, I.; Chakraborty, R.; Das, T. K.; Sengupta, J.; Sarkar, D. C., Tetrahedron, 1989, 45, 1441-1446.
13
1
H NMR completo:
1
H NMR - allargamento zona 2.5-7.5 ppm con integrali:
2
2
2
2
14
Chimica Organica 1 – Bologna – Esame scritto 19/09/2012
N. B. Per ogni esercizio occorre spiegare il più dettagliatamente possibile i singoli passaggi,
evidenziando i meccanismi e, quando necessario, la stereochimica delle molecole coinvolte
(sia come reagenti che come prodotti), la struttura di eventuali intermedi reattivi e, se
necessario per la discussione, quella delle relative possibili forme di risonanza.
1. Esercizio n. 1 (5 punti).
• Prevedere il prodotto della reazione tra 1-pentene e permanganato di potassio in ambiente
alcalino e quello della successiva reazione di tale prodotto con acetofenone (1-feniletanone)
in presenza di catalisi acida. Per ciascuna reazione discutere i meccanismi coinvolti e
individuare tutti i possibili stereoisomeri dei prodotti, attribuendo le configurazioni (R,S) a
ciascun centro asimmetrico mediante proiezioni di Fischer o legami a cuneo.
2. Esercizio n. 2 (5 punti).
• Si vuole sintetizzare il seguente etere:
Cl
O
e si hanno a disposizione i seguenti composti:
HO
OH
Cl
Cl
Cl
Cl
Suggerire i partner per la/e possibile/i reazione/i, discutere i meccanismi coinvolti e le
condizioni richieste (altri reagenti, catalizzatori, ecc.) e prevedere anche eventuali reazioni
parassite che si possono verificare nelle procedure scelte.
Attribuire i nomi IUPAC a tutte le strutture indicate.
3. Esercizio n. 3 (8 punti).
• Prevedere i prodotti delle seguenti reazioni:
O
1)
HBr
2-metilpent-2-ene
NH
KOH
MeCl
O
?
?
2) H3O+
Ag2O
?
?
HO-
(3 equiv.)
• Suggerire dei reattivi per effettuare le seguenti trasformazioni:
OMe
OMe
OMe
?
?
NO2
OMe
?
NH2
OMe
?
CN
O
Me
Come si potrebbe ottenere l'ultimo prodotto in un unico stadio a partire dall'anisolo (fenil
metil etere)?
15
4. Esercizio n. 4 (6 punti).
• Prevedere quanti e quali prodotti si ottengono miscelando pentanale e cicloesanone in
etanolo in presenza di EtO-, discutendo i meccanismi coinvolti. Pensate che alcuni di questi
prodotti si formino in maniera preferenziale rispetto ad altri?
• Cosa succederebbe trattando nelle stesse condizioni (EtO- in EtOH) l'etil propanoato?
• Cosa succederebbe trattando nelle stesse condizioni (EtO- in EtOH) il benzil propanoato?
5. Esercizio n. 5 (10 punti).
Per sintetizzare l'acido 4-metossibenzoico utilizzando lo stesso tipo di reazione da voi utilizzata in
laboratorio (quale???) avete a disposizione 4.5 mL di 1-bromo-4-metossibenzene (4-bromofenil
metil etere) (d = 1.49 g/mL) e le opportune quantità degli altri reagenti.
• Scrivete lo schema di reazione bilanciato con tutti i reattivi;
• dopo un'opportuna ricerca bibliografica, avete trovato che l'acido 4-metossibenzoico è un
solido con punto di fusione 182-185 °C: spiegate come effettuereste tale ricerca;
• dalla sintesi, svolto il work-up e la purificazione opportuna (quali???), avete ottenuto 3.8 g
di acido 4-metossibenzoico puro: calcolare la resa della reazione;
• identificare una semplice tecnica di analisi che vi permetta di identificare il prodotto
verificandone contemporaneamente anche la purezza;
• dalla reazione si ottiene anche un sottoprodotto di cui avete di seguito gli spettri MS
(massa), IR (infrarosso) e 1H NMR: suggerire la struttura del sottoprodotto motivandola sia
sulla base della reazione effettuata che sulla base degli spettri.
16
Spettro di massa:
214
Spettro infrarosso:
1
H NMR (con integrali):
3
2
2
17
Chimica Organica 1 – Bologna – Esame scritto 11/02/2013
N. B. Per ogni esercizio occorre spiegare il più dettagliatamente possibile i singoli passaggi,
evidenziando i meccanismi e, quando necessario, la stereochimica delle molecole coinvolte
(sia come reagenti che come prodotti), la struttura di eventuali intermedi reattivi e, se
necessario per la discussione, quella delle relative possibili forme di risonanza.
1. Esercizio n. 1 (9 punti). Prevedere quanti e quali prodotti si formano nelle reazioni tra bromo
(Br2, 1 equivalente) e i seguenti composti, facendo particolare attenzione agli eventuali aspetti
stereochimici (in presenza di stereoisomeri scrivere tutte le possibili strutture e attribuire la
configurazione R o S a ogni centro asimmetrico):
•
•
•
•
•
•
2.
Esercizio n. 2 (9 punti). Prevedere quanti e quali prodotti si formano nelle reazioni tra
eptan-3-one e i seguenti composti, facendo particolare attenzione agli eventuali aspetti
stereochimici (in presenza di stereoisomeri scrivere tutte le possibili strutture e attribuire la
configurazione R o S a ogni centro asimmetrico):
•
•
•
•
•
•
3.
(±)-3-etil-1,2-dimetilcicloes-1-ene;
cicloesene e acqua;
es-2-ino;
(4-nitrofenil)etilene;
fenil metil etere (anisolo) + opportuno catalizzatore;
difenilchetone (benzofenone) + opportuno catalizzatore.
fenilammina (anilina) + catalizzatore acido;
N-metilanilina (fenil metil ammina) + catalizzatore acido;
NaOH;
NaH seguito da etil benzoato;
fenil magnesio bromuro;
litio alluminio idruro.
Esercizio n. 3 (8 punti). Prevedere la struttura dei composti A, B, C, D ed E, facendo
particolare attenzione agli eventuali aspetti stereochimici e indicando se i vari composti si
formano come unico degli eventuali stereoisomeri o come miscela di essi; in quest'ultimo caso,
specificare la relazione stereochimica (isomeri geometrici, enantiomeri, diastereoisomeri, ecc.):
(R)-2-f enilbutano
Cl2 / hν
A
H2O
B
tosil cloruro
E
1) BH3
D
2) H2O2
18
NaOH
C
4. Esercizio n. 4 (parte di laboratorio, 8 punti).
Avete sintetizzato l'acido 3-metilbenzoico (acido meta-toluico, p.f. = 111-113 °C, p.e. = 263-265
°C) utilizzando la reazione di Grignard e siete riusciti a ottenere, dopo purificazione, una quantità di
2.7 g di acido m-toluico puro. Rispondete alle seguenti domande:
•
•
•
•
•
•
individuate i prodotti di partenza necessari per la sintesi;
scrivete la reazione di sintesi bilanciata;
considerando che la resa di reazione rispetto al reagente limitante sia stata pari all'85%,
calcolate la quantità di prodotto di partenza utilizzato;
proponete una procedura di workup della miscela di reazione motivando dettagliatamente i
passaggi;
basandovi sulle caratteristiche fisiche riportate sopra, proponete la migliore tecnica di
purificazione finale (e identificazione) del prodotto;
fate un'assegnazione motivata dei picchi principali negli spettri MS, IR e 1H-NMR del
prodotto di partenza e di quello finale riportati sotto.
19
Prodotto di partenza.
Spettro di massa:
91
170
Spettro infrarosso:
1
H-NMR (con integrali):
3
4
20
172
Prodotto finale.
Spettro di massa:
91
136
119
Spettro infrarosso:
1
H-NMR (con integrali):
3
4
1
21
Chimica Organica 1 – Bologna – Esame scritto 03/04/2013
N. B. Per ogni esercizio occorre spiegare il più dettagliatamente possibile i singoli passaggi,
evidenziando i meccanismi e, quando necessario, la stereochimica delle molecole coinvolte
(sia come reagenti che come prodotti), la struttura di eventuali intermedi reattivi e, se
necessario per la discussione, quella delle relative possibili forme di risonanza.
1. Esercizio n. 1 (10 punti). Prevedere quanti e quali prodotti si formano nelle seguenti reazioni,
dando loro il nome e facendo particolare attenzione agli eventuali aspetti stereochimici (in
presenza di stereoisomeri scrivere tutte le possibili strutture, identificare le relazioni
enantiomero/diastereoisomero e attribuire la configurazione R o S a ogni centro asimmetrico):
•
•
•
•
•
2.
Esercizio n. 2 (8 punti). Prevedere quanti e quali prodotti si formano nelle seguenti reazioni,
dando loro il nome e facendo particolare attenzione agli eventuali aspetti stereochimici (in
presenza di stereoisomeri scrivere tutte le possibili strutture, identificare le relazioni
enantiomero/diastereoisomero e attribuire la configurazione R o S a ogni centro asimmetrico):
•
•
•
•
4.
cicloesene + Br2;
pent-2-ino + Br2 (1 equivalente);
2-metilbutano + Br2/hν;
2-metilbutano + Cl2/hν;
(R)-2-fenilbutano + Br2/hν.
(R,S)-2-cloro-3-metilpentano + sodio metantiolato (MeSNa) in etere etilico;
(R,S)-2-cloro-3-metilpentano + sodio idrossido in acqua;
(R,R)-3-iodo-4-metilesano + etanolo;
(R,R)-3-iodo-4-metilesano + sodio ter-butilato (Me3CONa) in alcol ter-butilico.
Esercizio n. 3 (8 punti). Sostituite ai punti interrogativi i reagenti/catalizzatori/prodotti che
mancano nelle seguenti reazioni del fenolo, discutendo i meccanismi e gli eventuali
sottoprodotti:
?
OH +
OH +
OEt
?
AlCl3
Cl
O
OH +
?
?
?
OH
O
?
OH +
Ph
22
?
5. Esercizio n. 4 (parte di laboratorio, 8 punti). Dovete sintetizzare il prodotto 1-feniletanolo a
partire da acetofenone (fenil metil chetone): SCRIVETE LA REAZIONE BILANCIATA in cui
utilizzate lo stesso agente riducente da voi impiegato in laboratorio per una reazione analoga
(quale ???). Nella vostra reazione, attraverso l'opportuno work-up (quale ???), ottenete 3.75 g
di alcole accanto a 0.18 g di composto carbonilico non reagito. Calcolate resa, conversione, e la
quantità in grammi del riducente necessario, ipotizzando che la molecolarità effettiva della
reazione di H-transfer sia del 60%.
Interpretare i seguenti spettri di massa, infrarosso e 1H NMR del prodotto, dando il maggior numero
possibile di informazioni.
23
Spettro di massa:
Spettro infrarosso:
Spettro 1H-NMR (con integrali nei riquadri):
5
3
1
8
7
6
5
1
4
PPM
24
3
2
1
0
Chimica Organica – Faenza – Esame scritto 25/06/2012
N. B. Per ogni esercizio occorre spiegare il più dettagliatamente possibile i singoli passaggi,
evidenziando i meccanismi e, quando necessario, la stereochimica delle molecole coinvolte
(sia come reagenti che come prodotti), la struttura di eventuali intermedi reattivi e, se
necessario per la discussione, quella delle relative possibili forme di risonanza.
1. Esercizio n. 1.
• Prevedere il/i prodotto/i della reazione tra 1-butene e acido bromidrico e della reazione tra
3,3-dimetilbut-1-ene e acido bromidrico.
• Fare poi la stessa cosa per la reazione tra (E)-4-metilpent-2-ene e bromo (Br2).
• Se in uno/alcuni/tutti i casi precedenti si formano prodotti contenenti carboni asimmetrici,
individuarli, specificare il tipo di stereoisomeri ottenuti sulla base dei meccanismi di
reazione (enantiomeri e/o diastereoisomeri) e disegnarne la struttura sia in proiezione di
Fischer che usando i legami a cuneo, attribuendo a ciascun centro asimmetrico la
configurazione R o S.
2. Esercizio n. 2.
• Proporre un metodo di sintesi del 2-metilbutan-2-olo a partire dal metil propionato (metil
propanoato).
• Indicare i prodotti (e scriverne il nome IUPAC) che si ottengono trattando il 2-metilbutan2-olo con: 1) sodio idruro; 2) PBr3 seguito da metanolo; 3) PBr3 seguito da metilato di
sodio; 4) PBr3 seguito da trimetilammina, Ag2O e HO-.
• Per ogni reazione spiegare in dettaglio il tipo di meccanismo coinvolto e, nei casi in cui si
formassero stereoisomeri, specificarne il tipo e disegnarne esattamente la struttura.
3. Esercizio n. 3.
• Dare i possibili nomi (sia comuni che IUPAC) al seguente composto
OCH3
Br
•
e sintetizzarlo a partire da fenolo coi reattivi che ritenete più opportuni, spiegando i
meccanismi coinvolti in ciascun passaggio.
Fare la stessa cosa col composto
Br
Cl
partendo da 4-cloroanilina.
25
4. Esercizio n. 4.
• Prevedere il/i prodotto/i di reazione tra il dimetil malonato (acido 1,3-propandicarbossilico dimetilestere) e:
Fenilmagnesio bromuro (eccesso);
1-Butanolo (2 equivalenti) in ambiente acido;
Acqua basica (HO-);
1) Metilato di sodio; 2) bromoetano; 3) H3O+ e riscaldamento.
5. Esercizio n. 5
a) Scrivete il meccanismo dettagliato per la seguente reazione (limitatevi allo stadio di riduzione):
O
1) NaBH4,
CH3OH
2) H+, H2O
OH
b) Utilizzando 10 mmol di acetofenone (chetone di partenza), quante mmol di NaBH4 sono
necessarie teoricamente per ridurlo tutto?
c) In seguito alla reazione, eseguite una TLC con una miscela etere di petrolio/Et2O 1:1, che si
presenta come segue. Evidentemente la reazione non era andata a completezza, e nella TLC vedete
sia il chetone di partenza che il prodotto. Purtroppo vi siete dimenticandovi di inserire il materiale
di partenza. Come assegnereste preliminarmente le due macchie (discutete brevemente il perché)?
d) La miscela eluente della TLC è evidentemente non adatta per una purificazione cromatografica.
Perché?
e) Indicate anche una miscela eluente che provereste, per individuare una miscela ottimale.
26
6. Esercizio n. 6
Assegnate gli spettri ai relativi composti, giustificando le vostre risposte:
a) Spettrometria di massa: uno dei due spettri si riferisce al clorobenzene, l’altro al 4fluorofenolo.
Spettro A:
Spettro B:
27
b) Spettroscopia Infrarossa: uno dei due spettri si riferisce alla acetammide, e uno alla N,Ndimetilacetammide (vedi figure sotto).
O
O
N
NH2
Acetammide
N,N-Dimetilacetammide
Spettro A:
Spettro B:
28
c) Spettroscopia 1H NMR: uno dei due spettri si riferisce all’n-butanale, l’altro all’iso-butanale
Spettro A:
10
8
6
8
6
PPM
4
2
0
4
2
0
Spettro B:
10
PPM
29
Chimica Organica – Faenza – Esame scritto 12/07/2012
N. B. Per ogni esercizio occorre spiegare il più dettagliatamente possibile i singoli passaggi,
evidenziando i meccanismi e, quando necessario, la stereochimica delle molecole coinvolte
(sia come reagenti che come prodotti), la struttura di eventuali intermedi reattivi e, se
necessario per la discussione, quella delle relative possibili forme di risonanza.
1. Esercizio n. 1.
• Prevedere il prodotto della reazione tra 1-butino e acqua in ambiente acido.
• Prevedere il prodotto della reazione tra 1-butino e acido bromidrico e quello che si ottiene
facendo reagire tale prodotto ancora con acido bromidrico in presenza di iniziatori
radicalici.
• Prevedere il prodotto della reazione tra 1-butino e bromo (Br2).
• Se in uno/alcuni dei casi precedenti si formano prodotti contenenti carboni asimmetrici,
individuarli, specificare il tipo di stereoisomeri ottenuti sulla base dei meccanismi di
reazione (enantiomeri e/o diastereoisomeri) e disegnarne la struttura sia in proiezione di
Fischer che usando i legami a cuneo, attribuendo a ciascun centro asimmetrico la
configurazione R o S. Fare attenzione anche all'eventuale formazione di diverse
configurazioni non legate a carboni asimmetrici!!!
2. Esercizio n. 2.
• Mettere in ordine di acidità i seguenti composti motivando la risposta e (opzionale) dando
un'ordine di grandezza della pKa: butano, 1-butene, 1-butino.
• Mettere in ordine di acidità i seguenti composti motivando la risposta e (opzionale) dando
un'ordine di grandezza della pKa: butanale, 1-fenilbutan-1-one, N,N-dimetilbutanammide,
pentan-2,4-dione.
• Mettere in ordine di acidità i seguenti composti motivando la risposta e (opzionale) dando
un'ordine di grandezza della pKa: fenolo, 3-nitrofenolo, 4-metossifenolo, 2-nitrofenolo.
3. Esercizio n. 3.
• Prevedere i prodotti delle seguenti reazioni e darne i possibili nomi (sia comuni che
IUPAC):
Cl
SO3
Br2
?
H2SO4 conc.
•
?
H2SO4 dil.
?
AlBr3
Suggerire dei reattivi per effettuare le seguenti trasformazioni e discutere i meccanismi
coinvolti nei vari stadi:
Cl
Cl
OH
?
?
NO2
?
NO2
30
OH
NH2
4. Esercizio n. 4.
• Prevedere il/i prodotto/i di reazione tra il 2-fenilpropanale e:
Benzofenone (difenilchetone) in ambiente basico (HO-);
Anidride cromica seguita da etanolo in ambiente acido (H3O+) (2 stadi successivi);
N-Metilanilina;
Fenil magnesio bromuro.
scrivendo TUTTI gli stereoisomeri dei prodotti che si formano.
5. Esercizio n. 5
Considerate la seguente reazione, molto simile ad una reazione che avete eseguito in laboratorio:
+ X
Na2WO4 cat.
Aliquat cat.
NaHSO4 cat.
Aliquat:
CO2H
O
+
OH
+ 4 H2O
ClN
a) che cos’è il reagente X che manca?
b) quante mmol di X sono teoricamente necessarie per ossidare 5 mmol di substrato olefinico?
c) Qual è il ruolo dell’Aliquat nella reazione (non solo il nome ma anche in che modo esplica
le sue funzioni)?
d) Alla fine della reazione, in seguito a filtrazione e lavaggio con acqua, riuscite ad eliminare
l’acido acetico coprodotto e ad ottenere un grezzo di reazione solido costituito al 93% da
acido benzoico (quindi contenente 7% di un’impurezza ignota). Quale tecnica di
purificazione utilizzereste, per ottenere acido benzoico puro?
e) L’impurezza presente nel grezzo è un intermedio di reazione caratterizzato dagli spettri 1H
NMR (con i valori di integrale riportati accanto ai segnali), IR e massa riportati nelle pagine
successive: che composto è? Specificate i segnali caratteristici che vi hanno consentito la
determinazione della sua struttura.
31
1
5
32
6. Esercizio n. 6
Una miscela di liquidi A e B presenta, a pressione ambiente, il seguente diagramma di fase per
l’equilibrio liquido-vapore:
Indicate nel diagramma di fase:
a) la temperatura di ebollizione di A puro (TA) e la temperatura di ebollizione di B puro (TB) a
pressione ambiente.
b) la temperatura di ebollizione, a pressione ambiente, di una miscela contenente 80 %mol di A
(TX), e la composizione del vapore corrispondente (XV).
c) avendo a disposizione un apparato di distillazione in grado di fornire due piatti teorici, la
composizione XD e la temperatura di ebollizione TD della prima goccia di distillato fornita
da questo apparato a pressione ambiente, se si distilla la miscela contenente 80 mol% A.
d) considerate il caso in cui si voglia ottenere B puro, ma questo composto B decompone ad
una temperatura leggermente inferiore alla sua temperatura di ebollizione a pressione
ambiente, risultando perciò instabile nelle condizioni di distillazione. E’ possibile
modificare le condizioni di distillazione, in modo da poter ottenere il composto B puro, ma
evitandone la decomposizione? In che modo è necessario operare?
e) Supponendo che il composto B sia l’acetato di metile (CH3COOCH3), e il composto A
l’etanolo (CH3CH2OH), assegnate gli spettri NMR e IR riportati nelle pagine successive ai
due composti, giustificando brevemente le vostre risposte.
33
Spettri 1H NMR:
34
Spettri IR:
35
Chimica Organica – Faenza – Esame scritto 17/09/2012
N. B. Per ogni esercizio occorre spiegare il più dettagliatamente possibile i singoli passaggi,
evidenziando i meccanismi e, quando necessario, la stereochimica delle molecole coinvolte
(sia come reagenti che come prodotti), la struttura di eventuali intermedi reattivi e, se
necessario per la discussione, quella delle relative possibili forme di risonanza.
1. Esercizio n. 1 (6 punti). Prevedere i prodotti delle reazioni tra bromo (Br2) e:
• 1-fenilpropano (in presenza di luce);
• 1-fenilprop-1-ene;
• 1-fenilprop-1-ene (in presenza di acqua);
Per ogni prodotto discutere l'eventuale stereochimica spiegando quanti e quali stereoisomeri si
formano, disegnandoli in proiezione di Fischer o coi legami a cuneo e attribuendo la configurazione
(R,S) a ciascun centro asimmetrico.
2. Esercizio n. 2 (6 punti). Prevedere i prodotti delle reazioni tra 1-ammino-2-metilpropano e:
• acido propionico;
• anidride acetica;
• propanale;
• 1-cloropropano (eccesso).
3. Esercizio n. 3 (6 punti).
• Prevedere i prodotti delle seguenti reazioni:
O
O
•
O
NHMe2
H
?
SO2Cl
NaCN
?
?
?
Suggerire dei reattivi per effettuare le seguenti trasformazioni e discutere i meccanismi
coinvolti nei vari stadi:
?
?
?
OMe
OMe
OMe
OMe
OH
SO3H
Br
SO3H
4. Esercizio n. 4 (6 punti).
• Prevedere il/i prodotto/i di reazione tra il 3,3,4-trimetil-2-esanone e:
fenil magnesio bromuro;
sodio idruro seguito da benzaldeide;
sodio boroidruro.
scrivendo TUTTI gli stereoisomeri dei prodotti che si formano.
36
?
Br
5. Esercizio n. 5 (laboratorio, 5 punti)
Considerate la seguente reazione di idrolisi acido-catalizzata (ad esempio da acido acetico o acido
cloridrico) che porta a benzofenone e 3-nitroanilina:
NO2
N
+ H2O
H+ cat.
THF
O
NH2
+
NO2
a) Scrivete un meccanismo dettagliato per la reazione (suggerimento: in laboratorio avete eseguito
la reazione inversa; il meccanismo è identico).
b) Dopo qualche ora una TLC di controllo della miscela di reazione si presenta come segue (a
sinistra nella lastrina è stato seminato il materiale di partenza):
NO2
N
Assegnate preliminarmente le altre due macchie, spiegando il perché della vostra assegnazione.
c) Questa reazione, come tutte le reazioni di idrolisi/condensazione, è una reazione di equilibrio.
Infatti, un’ulteriore TLC di controllo dopo alcune ore si presenta identica alla prima (evidentemente
è stato raggiunto l’equilibrio). Per cercare di portare la reazione a completezza, aggiungereste alla
miscela di reazione acqua o acido? Spiegate il perché.
d) Dopo avere eseguito l’operazione opportuna, siete effettivamente riusciti a mandare la reazione
praticamente a completezza (come vi mostra una nuova TLC di controllo). A questo punto, vi
trovate con una miscela di reazione contenente principalmente benzofenone (il chetone) e la 3nitroanilina. Quale tecnica di separazione/purificazione utilizzereste per separare questi due
composti?
37
6. Esercizio n. 6 (laboratorio, 5 punti)
a)
Gli spettri 1H NMR dell’acido butirrico e iso-butirrico sono riportato sotto. Assegnate i due
spettri ai due composti sulla base dei chemical shift o della molteplicità. Infine, assegnate i segnali
dei due spettri ai diversi gruppi di protoni dei due composti.
HD H
B HB
HD
O
HA
HD
HC HC O
acido butirrico
HC HC O
HC
H
O A
HC
H
HC
HC B
acido i so-butirrico
38
b) Gli spettri di massa del bromobenzene e del 4-fluoro-2-nitrofenolo sono riportati sotto. Assegnate
i due spettri ai due composti, spiegando brevemente il perché (il peso molecolare di entrambi i
composti è 157).
OH
Br
NO2
F
39
c) Gli spettri IR della benzammide e dell'acetofenone sono riportati sotto. Tentate un’assegnazione
motivando la vostra risposta.
O
O
NH2
benzammide
acetof enone
40
Chimica Organica – Faenza – Esame scritto 28/01/2013
N. B. Per ogni esercizio occorre spiegare il più dettagliatamente possibile i singoli passaggi,
evidenziando i meccanismi e, quando necessario, la stereochimica delle molecole coinvolte
(sia come reagenti che come prodotti), la struttura di eventuali intermedi reattivi e, se
necessario per la discussione, quella delle relative possibili forme di risonanza.
1. Esercizio n. 1 (8 punti). Scrivere, sia in proiezione di Fischer che coi legami a cuneo, tutti gli
stereoisomeri possibili del 3-metilpentan-2-olo, assegnando la configurazione R e S a ogni
centro asimmetrico. Proporre un metodo di sintesi a partire dall'(R)-3-metilpentan-2-one,
indicando quanti e quali dei possibili stereoisomeri si formano (e in che relazione stereochimica
stanno tra di loro). Cosa succederebbe (stereochimicamente) se si partisse invece dal (±)-3metilpentan-2-one? Proporre, infine, un metodo di sintesi del (2R,3R)-3-metilpentan-2-olo a
partire da un opportuno alogenuro.
2. Esercizio n. 2 (8 punti). Prevedere i prodotti delle seguenti reazioni, indicando il plausibile
meccanismo e l'eventuale stereochimica:
Cl
Cl
HO-
MeOMeOH
H2O
Cl
Cl
Cl
MeNH2
MeNH2
Br
HO-
MeOH
H2O
Cl
MeO-
Br
PrS-
MeNH2
3. Esercizio n. 3 (8 punti). Indicare i reattivi necessari per le seguenti trasformazioni e spiegare i
meccanismi coinvolti:
A
C
NH2
Cl
B
2) E
1) D
HN
41
Ph
4. Esercizio n. 4 (laboratorio, 10 punti)
O
O
x
B
Na
OH
H2O
+ y NaBH4
x
+ y B(OH)3 + y NaOH
a) Bilanciate l’equazione (ovvero indicate x e y).
b) Quindi, per ridurre il chetone è necessaria una quantità di sodio boroidruro pari a y/x, in rapporto
molare con il chetone di partenza. Tuttavia, se ne usa generalmente una quantità maggiore. Perché?
c) L'alternativa, per eseguire la stessa reazione, è utilizzare litio alluminio idruro. Perché però si
preferisce generalmente utilizzare sodio boridruro?
d) Quale solvente scegliereste fra metanolo e toluene, per effettuare la reazione, e perché?
e) Assegnate gli spettri IR e 1H NMR che seguono (due sono del chetone di partenza e due del
prodotto di riduzione). Spiegate come li avete assegnati.
A
42
B
(ppm)
C
(ppm)
D
43