Metodi ottici d'analisi
Spettrofotometria UV/VIS
Spettrofotometria IR
Polarimetria
La natura della Luce.
I metodi ottici d'analisi si basano sull'interazione tra radiazione elettromagnetica e materia, in
particolar modo radiazione ultravioletta e infrarossa.
Per poter spiegare le proprietà ottiche della materia come l'emissione di radiazione, l'assorbimento e
il potere rotatorio, non ci si può basare sulla teoria corpuscolare che pur spiegando bene l'ottica
geometrica non spiega i fenomeni suddetti. Mentre la teoria ondulatoria permette di studiare questi
fenomeni ma non può spiegare l'effetto fotoelettrico.
Verso il 1925 con le nuove teorie della meccanica ondulatoria prende corpo la natura dualistica
della luce che è contemporaneamente corpuscolo e onda. Questi centri o granuli di energia che
viaggiano nello spazio sotto forma d'onda prendono il nome di fotoni. Che viaggiano ad una
velocità C (velocità della luce) paria a C = λν (2,997*108 m/s) dove lambda (λ) e la lunghezza
d'onda mentre nu (ν) è la frequenza. Mentre l'energia correlata al fotone dipende dalla frequenza
secondo la relazione E=hν. Dove h è la costante di Planck. Quindi l'energia correlata al fotone
cresce al crescere della frequenza.
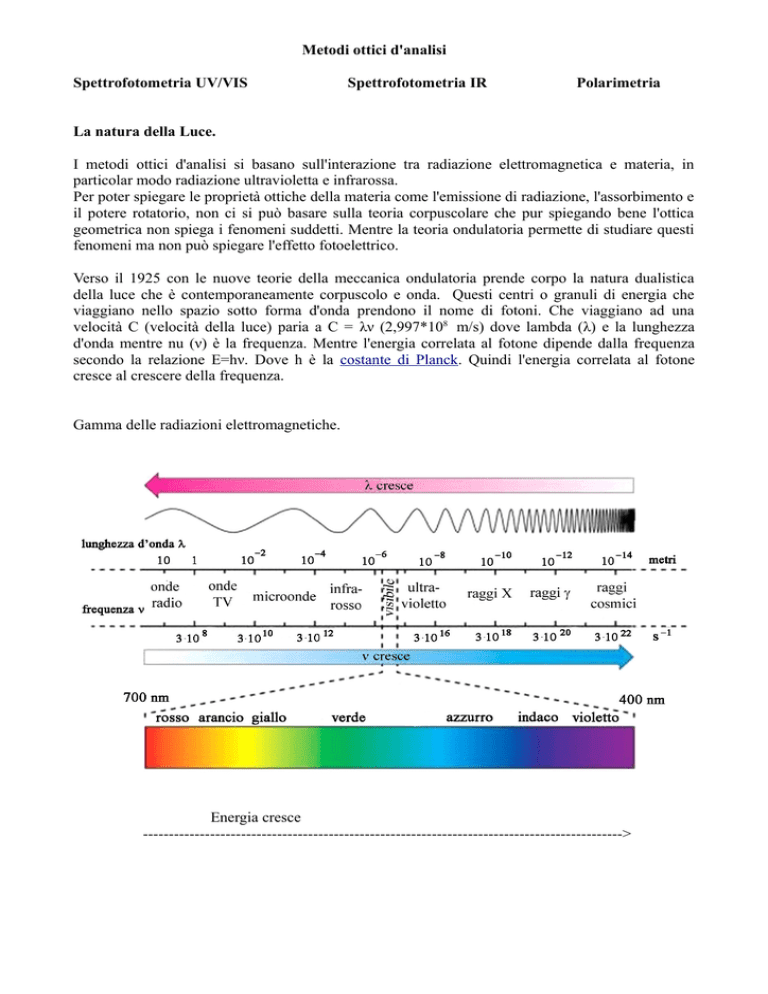
Gamma delle radiazioni elettromagnetiche.
Energia cresce
--------------------------------------------------------------------------------------------->
Quando sottoponiamo una sostanza all'azione delle radiazioni elettromagnetiche, l'energia raggiante
in essa contenuta può venir assorbita dalle molecole per essere trasformata in altre forme d'energia.
Ricordiamo che per la teoria dei quanti ciò può avvenire solo per pacchetti hν.
--L'energia hν può aumentare l'energia cinetica di traslazione.
--L'energia hν può aumentare l'energia cinetica di rotazione.
--L'energia hν può in caso di molecole poliatomiche può essere trasformata in energia di vibrazione.
--L'energia hν può provocare il salto quantico di un elettrone.
Le frequenze assorbite sono caratteristiche delle molecole.
Radiazioni correlate ai vari tipi di trasformazione dell'energia:
Traslazione (onde radio)
Rotazione (estremo infrarosso)
Moti vibratori (IR medio e vicino)
Salti elettronici (UV/VIS)
Leggi sull'assorbimento. (Lambert Beer)
Trasmittanza
Estinzione o Assorbanza
Trasmittanza:
Quando una radiazione luminosa incide su di un mezzo trasparente in parte viene riflessa e in parte
si rifrange nel mezzo. Io è l'intensità della luce incidente mentre I x è l'intensità della luce che ne
fuoriesce. Mentre Is è l'intensità della luce che fuoriesce da una soluzione di riferimento o bianco.
Ix
La trasmittanza sarà paria T = -----Is
Estinzione o Assorbanza
Il logaritmo decimale del reciproco della trasmittanza prende il nome di estinzione o assorbanza.
1
Is
E = log ------ = log ------- = abc (a=coefficente d'estinzione,b=spessore, c=concentrazione)
T
Ix
Da cui c=E/ab
Spettrofotometria UV/VIS
Spettrofotometria
Da Wikipedia, l'enciclopedia libera.
Uno spettrofotometro
Uno spettrofotometro portatile
In fisica il termine spettrofotometria designa lo
studio degli spettri elettromagnetici. Si tratta di
un termine più specifico del termine generale
spettroscopia elettromagnetica, in quanto la
spettrofotometria si occupa di luce visibile, dal
vicino ultravioletto al vicino infrarosso.
La
spettrofotometria
richiede
l'uso di
spettrofotometri. Uno di tali strumenti è un
fotometro, cioè un dispositivo per la misura
dell'intensità luminosa, che può determinare
l'intensità come funzione della lunghezza d'onda
della radiazione luminosa. Sono disponibili molti
generi di spettrofotometri. Tra le distinzioni più
importanti adottate per classificarli vi sono gli
intervalli di lunghezze d'onda nei quali operano,
le tecniche di misurazione che adottano, le
modalità secondo le quali acquisiscono uno
spettro e le sorgenti dell'intensità luminosa
variabile per la cui misura sono stati progettati.
Altri aspetti importanti degli spettrofotometri
includono la loro banda spettrale e il loro intervallo di linearità.
L'applicazione forse più comune degli spettrofotometri è la misurazione dell'assorbimento
luminoso.
Vi sono due maggiori categorie di spettrofotometri; quelli a fascio singolo e quelli a fascio doppio.
Uno spettrofotometro a fascio doppio misura il rapporto dell'intensità luminosa di due diversi
percorsi della luce, mentre uno spettrofotometro a fascio singolo misura una intensità luminosa
assoluta.
Indice
•
•
•
•
•
1 Spettrofotometri della regione del visibile
2 Spettroradiometri
3 Spettrofotometri UV e IR
4 Voci correlate
5 Collegamenti esterni
Spettrofotometri della regione del visibile
La spettrofotometria della regione del visibile, tra ca. 400 e ca. 700 nm, viene usata estesamente
nella colorimetria scientifica. I produttori di inchiostri, le aziende della stampa, i produttori di tessili
e molti altri tipi di imprese necessitano di dati ottenibili attraverso la colorimetria. Solitamente,
nella spettrofotometria del visibile si effettuano misurazioni ad intervalli di lunghezza d'onda di 10
nanometri e si produce una curva di riflettanza spettrale. Queste curve possono essere utilizzate per
controllare i lotti di coloranti per verificare se soddisfano i requisiti specifici. Gli spettrofotometri
del visibile tradizionali non riescono a rilevare se un colorante presenta fluorescenza. Questo rende
loro impossibile operare correttamente sui colori quando qualcuno degli inchiostri da stampa
analizzato è fluorescente. Per i coloranti che presentano fluorescenza occorre usare uno
spettrometro fluorescente bispettrale. Sono disponibili due assetti principali per gli spettrofotometri
per lo spettro visibile chiamati rispettivamente d/8 o sferici e 0/45. Questi termini sono derivati
dalla geometria della sorgente luminosa, dell'osservatore e dell'interno della camera di misurazione.
Rappresentazione spettrografica dell'emissione luminosa di una lampada ad incandescenza (sinistra)
e di una lampada fluorescente (destra)
Spettrofotometri UV e IR
Gli spettrofotometri più comuni sono usati nelle regioni UV e visibile dello spettro; alcuni di questi
strumenti operano altrettanto bene nella regione dell'infrarosso vicino. Gli spettrofotometri
progettati per la regione principale dell'infrarosso sono molto differenti, a causa delle esigenze
tecniche delle misurazioni in questa parte dello spettro. Uno dei fattori principali è il tipo di
fotosensori che sono efficaci nelle diverse regioni spettrali, ma le misurazioni nell'infrarosso
risultano impegnative anche perché virtualmente tutti gli oggetti emettono radiazioni IR in
conseguenza di fenomeni termici, specialmente a lunghezze d'onda superiori ai 5 μm.
Molti spettrofotometri per analizzare lo spettro usano un monocromatore a prisma o a reticolo.
Lo spettrofotometro misura quantitativamente la frazione di luce che attraversa una determinata
soluzione. In uno spettrofotometro, una luce proveniente da una lampada nella regione vicinoIR/VIS/UV (tipicamente una lampada a scarica in gas deuterio per l'UV/VIS e particolari lampade
ad incandescenza per l'IR) viene guidata attraverso un monocromatore che separa dallo spettro
complessivo la radiazione di una particolare lunghezza d'onda. Questa luce passa attraverso il
campione che deve essere sottoposto alla misurazione. Attraversato il campione, l'intensità
rimanente della radiazione viene misurata mediante un rivelatore costituito da un fotodiodo o da un
altro sensore luminoso; questo consente di calcolare la trasmittanza della lunghezza d'onda in
esame.
Mentre gli assorbimenti di lunghezze d'onda che cadono nell'ambito dell'UV/VIS danno luogo a
variazioni di energia elettronica, gli assorbimenti nella regione infrarossa sono invece legati a
variazione dell'energia vibrazionale delle molecole. Tali effetti, che stanno alla base di una misura
spettrofotometrica, vengono comunemente sfruttati in chimica per determinazioni qualitative,
quantitative ed inerenti allo studio della struttura e legame chimico.
Spettrofotometro UV/VIS
Monocromatore a reticolo
Possibili moti vibrazionali, IR.
Spettrofotometro IR
POLARIMETRIA
La polarimetria è una tecnica analitica strumentale che sfrutta il cambiamento di direzione del
piano di vibrazione della luce linearmente polarizzata durante il suo passaggio attraverso uno
strato trasparente di una sostanza anisotropa (caratteristiche fisiche diverse in tutte le direzioni).
Essa trova applicazione prevalentemente nello studio di strutture molecolari e nell’analisi
quantitativa delle soluzioni di sostanze otticamente attive, in quanto la direzione e l’entità della
rotazione dipendono dal potere rotatorio di queste.
La luce e sue proprietà
La luce ordinaria è una radiazione elettromagnetica con proprietà simili ad un’onda che si allontana
dalla sorgente lungo la linea di propagazione. Un raggio di luce è costituito da due componenti che
vibrano su piani perpendicolari tra loro: un campo elettrico ed un campo magnetico, oscillanti, che
variano rapidissimamente di verso ed intensità. I piani su cui avvengono le vibrazioni sinusoidali di
ciascun campo (elettrico e magnetico) oltre ad essere perpendicolari tra di loro sono perpendicolari
alla direzione di propagazione del raggio.
La distanza fra due creste successive è definita lunghezza d’onda ().
L’ampiezza della vibrazione corrisponde alla sua intensità.
L’energia luminosa consiste di più onde elettromagnetiche che vibrano su piani differenti. La luce
“ordinaria”, infatti, vibra su un numero infinito di piani perpendicolari alla direzione di
propagazione.
Luce polarizzata
Se questa luce ordinaria passa attraverso un filtro polarizzatore ottico, la luce emergente sarà un
raggio il cui vettore elettrico vibra su un singolo piano.
L’energia risultante è chiamata luce polarizzata su un piano (o linearmente polarizzata).
In realtà la luce piano-polarizzata è la risultante di due componenti polarizzate circolarmente
opposte, dirette verso destra e verso sinistra, in concordanza di fase e con uguale frequenza ed
ampiezza.
Quando una delle due componenti è rallentata da un mezzo chirale i vettori destro e sinistro si
troveranno fuori fase e quindi cambierà l’orientamento del piano di polarizzazione.
luce ordinaria
luce polarizzata: vettori
campi elettrico e
magnetico
La luce può anche essere polarizzata circolarmente o ellitticamente:
circolarmente, se il piano di oscillazione ruota continuamente, con regolarità
periodica, attorno la direzione di propagazione, per cui il vettore rappresentativo
del campo elettrico descrive una spirale a proiezione circolare; ellitticamente, se
la spirale descritta dal vettore ha proiezione ellittica.
Attività ottica e composti chirali
Si definisce attività ottica la capacità di un composto di ruotare il piano di
vibrazione della luce linearmente polarizzata, in una direzione o nell’altra.
In genere, le sostanze dotate di asimmetria cristallina o molecolare possiedono
questa capacità. Le sostanze anisotrope (asimmetriche) quindi fanno ruotare il
piano di vibrazione dell’onda-luce polarizzata, per cui sono otticamente attive.
Un esempio è dato dagli zuccheri e dagli amminoacidi.
Come è noto, esistono composti organici contenenti uno o più atomi di carbonio al quale sono legati
quattro differenti gruppi funzionali. Dal momento che un atomo di carbonio con legami semplici ha
una geometria tetraedrica (ibridizzazione sp3), i quattro gruppi funzionali possono esservi legati con
due configurazioni diverse, dando origine a due molecole, una immagine speculare dell’altra, cioè
una coppia di antipodi ottici (enantiomeri).
Questa particolare geometria influenza la trasmissione della luce piano-polarizzata dando a tali
molecole la proprietà dell’attività ottica. Quindi, sostanze in grado di ruotare il piano di vibrazione
della luce polarizzata sono dette otticamente attive.
Polarizzatori
Per l’analisi polarimetrica bisogna disporre di luce polarizzata che si ottiene mediante l’uso di
dispositivi detti polarizzatori. Il polarizzatore ha sulla luce naturale una funzione filtrante, che
permette di isolare raggi luminosi i cui vettori
elettrici vibrano tutti su un solo piano.
Sono polarizzatori:
- tormalina1 (la sua trasmittanza però
dipende dalla lunghezza d’onda)
- prisma di Nicol (due prismi di calcite
incollati con balsamo del Canadà)
- herapatiti2 (sostanze dicroiche ottenute
artificialmente)
Prisma di Nicol
Un cristallo di spato d’Islanda 3viene tagliato in due secondo un piano diagonale B. le due parti
vengono poi riunite e saldate con balsamo del Canada 4. L’inclinazione del cristallo rispetto al
raggio incidente I viene studiata in modo che il raggio ordinario O incida sulla superficie B
secondo un angolo superiore all’angolo limite5, mentre il raggio straordinario S può penetrare nel
balsamo ed emergere, polarizzato, dalla parte opposta del cristallo. Il raggio O deviato verrà
assorbito dalla faccia inferiore annerita del cristallo C.
Quando un raggio di luce naturale, monocromatico penetra nel prisma, esso subisce rifrazione e
viene sdoppiato in due raggi linearmente polarizzati (fenomeno della birifrangenza), uno detto
ordinario e l’altro straordinario, con piani di polarizzazione perpendicolari tra loro. Il raggio
ordinario incide sulla faccia interna del prisma con un angolo tale da farlo riflettere totalmente
all’interno e da venire assorbito da una parete appositamente annerita; il raggio straordinario incide
sulla faccia interna del prisma con un angolo tale da passare inalterato. Dal prisma di Nicol emerge
pertanto un raggio piano-polarizzato parallelo al raggio naturale incidente.
Polarimetro
I polarimetri sono gli strumenti che permettono di
misurare il potere rotatorio di sostanze otticamente
attive.
Il cuore di un polarimetro è costituito dal materiale
anisotropo che, grazie al fenomeno della
birifrangenza, è in grado di polarizzare la luce.
Birifrangenza
Un raggio di luce ordinaria r, che attraversa un
1 Minerale: silicato complesso di metalli diversi, di colore variabile in relazione alla composizione chimica; le varietà
trasparenti sono usate come gemme di notevole pregio
2 Sostanze microcristalline polarizzabili elettricamente di origine sintetica derivate da reazioni dello iodio con
solfato di chinino
3 Varietà limpida di calcite, in grossi cristalli utilizzabili per strumenti ottici.
4 Liquido secreto da varie piante, costituito per lo più da resine, che all’aria diviene vischioso o solido
5 Valore di angolo oltre il quale si ha riflessione e non rifrazione (quando l’angolo di rifrazione tende a 90°, l’angolo
di incidenza assume valore di angolo limite)
mezzo anisotropo, si sdoppia nei raggi O (ordinario) e S (straordinario) polarizzati
perpendicolarmente tra di loro.
Il fenomeno è detto anche doppia rifrazione perché entrambi i raggi risultano deviati rispetto alla
direzione del raggio incidente, ma con un diverso indice di rifrazione e risultano polarizzati
linearmente su piani ortogonali.
I componenti principali di un polarimetro sono:
1. sorgente luminosa
2. polarizzatore
3. tubo polarimetrico
4. analizzatore
5. oculare
6. scala per misurare l’angolo di rotazione
(A) Schema di un comune
polarimetro ottico
S =sorgente P =polarizzatore principale Pa
=polarizzatore ausiliario, parallelo al principale T
=tubo contenente il campione
An =polarizzatore analizzatore, perpendicolare al principale, ruotabile e montato su un nonio Lc e
Lf =lenti O =oculare
(B) Nella fase di azzeramento il polarizzatore An viene ruotato finché nell’oculare O non si nota
una condizione di penombra uniforme. A questo corrisponde una posizione b del nonio.
(C) Quando viene introdotto nel tubo un campione otticamente attivo, nell’oculare si notano due
semicerchi di diversa intensità.
(D) Infine si ruota An fino a ripristinare la condizione di penombra uniforme (posizione c del
nonio). La differenza fra c e b corrisponde all’angolo di rotazione della luce polarizzata dovuto
al campione.
In una prima fase il polarizzatore ausiliario e l’analizzatore vengono allineati in modo tale che,
quando il tubo è vuoto o riempito di opportuno solvente, all’oculare si possano osservare due
semicerchi illuminati di luce gialla con la medesima intensità. In seguito si ruota l’analizzatore per
realizzare le condizioni di massima oscurità ed in corrispondenza di questa posizione viene
controllata la posizione dello zero.
In un secondo momento si introduce la soluzione campione nel tubo e si fa ruotare l’analizzatore in
modo da ripristinare le condizioni di uguale intensità dei due semicerchi attraverso l’oculare. Un
nonio fornirà l’entità dell’angolo di rotazione misurato.
Valutazione del segno del potere rotatorio
Per convenzione, le sostanze che ruotano verso destra il piano della luce polarizzata sono dette
destrogire, al contrario, se lo ruotano verso sinistra sono dette levogire. E’ importante sottolineare
che non si può dedurre il segno del potere rotatorio specifico di una sostanza incognita con una sola
determinazione polarimetrica. In assenza, o con tubo polarimetrico vuoto si ha campo dell’oculare
uniforme in corrispondenza di 0° e di 180°; introducendo il mezzo otticamente attivo, si ristabilisce
l’estinzione (campo dell’oculare uniforme) facendo ruotare l’analizzatore di un angolo , ma anche
facendolo ruotare in senso opposto di - 180°
Per evitare errori nella valutazione, quando la sostanza in esame non è nota, è indispensabile fare
una doppia misurazione utilizzando nella seconda un tubo di lunghezza metà del precedente:
- se la sostanza è destrogira si otterranno valori corrispondenti ad /2 e /2 ± 180.
- se la sostanza è levogira si otterranno valori corrispondenti ad -180/2 e -180/2 ± 180.
Dagli angoli trovati nella seconda misura è possibile ricavare il valore corretto.
Esempio
La misurazione su una sostanza attiva, in tubo da 4 dm, dà l’uniformità di campo a +78° () ed a –
102° (-180). Ripetendo la misura in tubo da 2 dm si trovano i valori –51° e +129°; la rotazione di
–51° soddisfa la relazione (-180)/2 per cui si deduce che la sostanza è levogira e poiché si è
utilizzato un tubo polarimetrico di 2 dm il suo potere rotatorio specifico sarà [] = –51°/2 = –25,5°
Rotazione ottica
Per un composto otticamente attivo l’angolo di rotazione sperimentale (espresso in gradi) del
piano di polarizzazione dipende dalla concentrazione c del composto, dalla lunghezza del cammino
l e da un fattore k, dove k è una caratteristica del composto, detta “potere rotatorio specifico”
=c•l•k
Potere rotatorio specifico
Il potere rotatorio specifico, o [], è una costante fisica e quindi una proprietà intrinseca dei
composti che presentano attività ottica. E’ una grandezza che rappresenta la rotazione in gradi
provocata da un grammo di sostanza sciolto in 100 ml di soluzione, posta in un tubo polarimetrico
di 1 dm; esso dipende dalla temperatura e dalla lunghezza d’onda utilizzata; si indica con:
o, standardizzando
questi parametri a 20° e
riga D dello spettro del
sodio, con:
t
[]
20
[]
D
per cui sostituendo nella formula precedente:
= c • l •[]
20
da cui:
D
20
[] =
D
c•l
Da questa relazione, conoscendo il potere rotatorio specifico, è possibile ricavare facilmente, dalla
misura dell’angolo , la concentrazione incognita di una soluzione.
20
c = • 100 / l • []
D
esempio di calcolo del potere rotatorio specifico:
una soluzione contenente in 10 ml 400 mg di soluto è posta in una cella di 10 cm di lunghezza; la
rotazione osservata in questo campione a 20°C usando la riga D del sodio è di +4,36°. Calcolare la
rotazione specifica del soluto.
La concentrazione è di 400 mg / 10 ml, cioè 0,4 g /10 ml, cioè ancora 4 g / 100 ml; per cui
sostituendo
20
+4,36 • 100
[] =
D
= + 109°
4•1
Minerale: silicato complesso di metalli diversi, di colore variabile in relazione alla composizione
chimica; le varietà trasparenti sono usate come gemme di notevole pregio
[1]
[2] Sostanze microcristalline polarizzabili
elettricamente di origine sintetica derivate da reazioni
dello iodio con solfato di chinino
[3] Varietà limpida
di calcite, in grossi cristalli utilizzabili per strumenti ottici.
Liquido secreto da varie piante, costituito per lo più da resine, che all’aria diviene vischioso o
solido
[4]
[5] Valore
di angolo oltre il quale si ha riflessione e non rifrazione (quando l’angolo di rifrazione
tende a 90°, l’angolo di incidenza assume valore di angolo limite)
Isomeria
Da Wikipedia, l'enciclopedia libera.
Tipi di isomeri
L'isomeria (dal greco ισομερης, isomerès; isos = "uguale", méros = "parte") è quel fenomeno per il
quale sostanze diverse per proprietà fisiche e spesso anche per comportamento chimico hanno la
stessa formula bruta, cioè stesso peso molecolare e stessa composizione percentuale di atomi.[1]
Indice
• 1 Tipologie di isomeri
• 2 Alcuni esempi di isomeria
• 2.1 Isomeria di catena
• 2.2 Isomeria di posizione
• 2.3 Isomeria cis-trans
• 2.4 Isomeria ottica
• 3 Nuclidi
• 4 Note
• 5 Bibliografia
• 6 Voci correlate
• 7 Altri progetti
• 8 Collegamenti esterni
Tipologie di isomeri
Due composti con uguale formula bruta si dicono isomeri. Questi possono essere:
• Isomeri costituzionali (o strutturali), se hanno formula bruta identica ma diversa
connettività. In altre parole, sono composti aventi la stessa formula molecolare ma diversa
formula di struttura.[2] Ciò implica differenti proprietà fisiche e chimiche, dovute ai legami
differenti degli elementi che compongono la molecola.
• Stereoisomeri, se hanno formula bruta identica, stessa connettività, ma la diversa
orientazione spaziale degli atomi rende loro non sovrapponibili.
• Omomeri, se hanno formula bruta identica, stessa connettività e sono sovrapponibili (in
pratica sono molecole identiche).
L'isomeria è molto diffusa ed importante nei composti organici e le classi di isomeri, si possono
dividere ulteriormente in sottoclassi.
Gli isomeri costituzionali possono essere isomeri:
• di catena, che interessa la struttura dello "scheletro" di carbonio, ossia la presenza e
posizione di ramificazioni od anelli; isomeri di questo tipo hanno proprietà fisiche diverse,
ma reattività chimiche spesso abbastanza simili;
• di posizione, che interessa la posizione di legami multipli o di gruppi contenenti atomi
diversi da carbonio e idrogeno; isomeri di questi tipo appartengono alla stessa classe di
composti, hanno quindi generalmente reattività chimica simile, diverse sono invece le loro
proprietà fisiche;
• di gruppo funzionale, isomeri cioè che pur avendo formula bruta uguale, presentano gruppi
funzionalmente diversi, ed hanno quindi proprietà chimiche e fisiche molto differenti.
Gli stereoisomeri possono essere isomeri:
• configurazionali, o ottici, nelle molecole in cui sono presenti degli elementi stereogenici,
cioè elementi a causa dei quali la molecola ammette due isomeri che sono uno la forma
speculare non sovrapponibile dell'altro. Elementi stereogenici possono essere un punto (un
atomo, tipicamente un carbonio portante quattro sostituenti diversi, che viene definito centro
chirale), un asse (l'asse di un legame fra due o più atomi ad esempio alleni portanti quattro
sostituenti diversi su carboni terminali), o un piano (una molecola planare con sostituenti
orientati in maniera particolare sia nel piano della molecola che sopra o sotto questo). Di
questa categoria fanno parte gli enantiomeri, isomeri di cui uno è l'immagine speculare non
sovrapponibile dell'altro. Tipicamente due isomeri configurazionali in cui uno non è
l'immagine speculare dell'altro si dicono diastereoisomeri, anche se tutte le coppie di
stereoisomeri non enantiomeri possono essere considerate tipi di diastereoisomeri.
• geometrici, o cis-trans, nelle molecole in cui due carboni legati da un legame doppio sono
entrambi legati a due gruppi differenti o, più in genere, in molecole la cui struttura
impedisce una libera rotazione attorno ad uno o più legami; le loro proprietà fisiche sono
diverse, la loro reattività chimica è generalmente simile, ma vi sono notevoli eccezioni
legate proprio a particolari configurazioni geometriche;
• conformazionali, è il caso in cui pur non essendoci uno stereocentro, le possibili
orientazioni date dalla rotazione di un legame C-C e dalle possibili conformazioni di una
molecola (come ad esempio nel caso in cui i sostituenti di un atomo o una catena di atomi si
orienti ad elica e anche nelle conformazioni dei cicloalcani) producono molecole con ugual
formula bruta, ugual connettività ma non sovrapponibili. Un isomero conformazionale si
dice anche conformero o rotamero. È il caso di sottolineare che i conformeri non sono dei
veri e propri isomeri, in quanto la barriera energetica tra le varie orientazioni è molto piccola
e, a temperatura ambiente, l'una si trasforma nell'altra, pur avendo ciascuna una maggiore o
minore probabilità a seconda della stabilità.
Alcuni esempi di isomeria
Isomeria di catena
I tre composti riportati in questo esempio hanno formula bruta: C8H16.
Isomeria di posizione
I tre composti riportati in questo esempio sono tre fenoli. Differiscono per la posizione dei loro
gruppi attorno all'anello. Ed i loro prefissi sono: orto- meta- para-.
Isomeria cis-trans
Detta anche isomeria geometrica;[3][4] affinché ci sia questo tipo di isomeria sono necessarie due
condizioni:
• non deve esserci rotazione attorno al legame tra i due atomi di carbonio;
• ciascuno dei due atomi di carbonio deve essere legato a due gruppi diversi.
Per la prima condizione non può esserci isomeria cis-trans negli alcani (nei quali gli atomi di
carbonio possono ruotare liberamente attorno al legame semplice); per la seconda non può esserci
negli alchini (in cui essendo i due atomi di
carbonio legati tramite un legame triplo, possono
fare soltanto un altro legame). Pertanto l'isomeria
cis-trans avviene solo negli alcheni e in alcuni casi
nei cicloalcani.[5] Le due coppie di composti
riportate in questo esempio differiscono per la
disposizione dei gruppi attorno ad un elemento
che impedisce rotazione (ad esempio un doppio
legame od un anello). Gli isomeri geometrici
vengono comunemente classificati con due diversi
tipi di nomenclatura: cis e trans o Z e E. Nella
prima l'isomero cis è quello che ha due gruppi
uguali dalla stessa parte di un doppio legame o di
un ciclo, il trans li ha da parti opposte.[3] Nel
secondo tipo di nomenclatura, l'isomero Z è quello
con i gruppi a priorità maggiore dalla stessa parte
(la priorità viene stabilita in base alle regole di
priorità usate per la nomenclatura dei composti
chirali) mentre l'isomero E li ha da parti opposte. A volte può succedere che le configurazioni cis e
Z si equivalgano, come del resto trans e E.
Isomeria ottica
Le due molecole riportate in questo esempio, differiscono solamente per il fatto di essere l'una
l'immagine speculare non sovrapponibile dell'altra. Due stereoisomeri che sono l'uno l'immagine
speculare non sovrapponibile dell'altro si dicono enantiomeri (in questo caso, l'elemento
stereogenico è un punto, cioè un atomo di carbonio). Questa proprietà è anche detta chiralità.
L'isomeria ottica è una particolare tipologia di isomeria nella quale i due composti isomeri
presentano le stesse identiche proprietà fisiche e chimiche (a parte la diversa reattività con altre
molecole chirali) tranne differire per una caratteristica proprietà ottica: se inseriamo una soluzione
con i due isomeri ottici all'interno di un polarimetro, il fascio di luce che verrà fatto passare sarà
deviato verso destra e verso sinistra dello stesso angolo, rispetto alla retta che il fascio
individuerebbe in assenza degli isomeri. La luce non verrà deviata se nel polarimetro inseriamo una
soluzione contenente le stessa identica quantità dei due isomeri, ossia una soluzione "racemica";
solo in questo caso la luce continuerà a vibrare su un unico piano senza subire alcuna deviazione.
L’angolo α di cui ruota il piano di vibrazione della luce polarizzata dopo aver attraversato una
soluzione è detto potere rotatorio specifico di una sostanza.
Il potere rotatorio di una soluzione dipende sia dalla concentrazione sia dalla lunghezza del tubo
polarimetrico. Per rendere indipendente dai parametri sperimentali il potere rotatorio di una
sostanza, si usa il potere rotatorio specifico [α]:
[α] = α/c∙l
dove:
• α = angolo di rotazione misurato
• c = concentrazione in g/ml
• l = lunghezza del tubo in dm
nome del
gruppo
funzionale
legame singolo
legame doppio
legame triplo
formula del
gruppo
funzionale
C-C
C=C
C≡C
fenile
C6H5-
ione alogenuro
-F -Cl -Br -I
(generico: X-)
acile
-CO-X
gruppo amminico
primario
gruppo amminico
secondario
gruppo amminico
terziario
gruppo ammidico
primario
gruppo ammidico
secondario
gruppo ammidico
terziario
gruppo -azogruppo ciano-
-NH2
ammine primarie
ammino-
-ammina
-NHR
ammine secondarie
alchilammino-
alchilammina[5]
-NRR'
ammine terziarie
alchilammino-
-alchilammina
-CO-NH2
ammidi primarie[6]
carbossammide-
-ammide
-CO-NHR
ammidi secondarie
alchilcarbossammide-
-alchilammide
-CO-NRR'
ammidi terziarie
alchilcarbossammide-
-alchilammide
-N=N-CN
-NO2
Azocomposti
Nitrili
-azociano-
-azo-nitrile
Nitroderivati
nitro-
-NO
Nitrosocomposti
nitroso-
-N=C=O
Isocianati
-isocianato
-N=C=S
Tiocianati
-tiocianato
gruppo nitrogruppo nitrosogruppo
-isocianato
gruppo
-tiocianato
gruppo
-carbammico
carbossile
ossidrile
formile
gruppo acile
gruppo acilossi
gruppo alcossi
gruppo
solfidrilico
classe di composti
contenenti il gruppo
prefisso
suffisso
funzionale
Alcani
alchil-ano
Alcheni
alchenil-ene
Alchini
alchinil-ino
Idrocarburi
fenilaromatici[4]
fluoro-; cloro-; bromo-;
Alogenuri alchilici
iodoalogenuro di
Alogenuri acilici
...-oile
R-NH(CO)O-R uretani
-carbammato
-COOH
-OH
-OH
-CHO
-CO-R
-COO-R
-O-R
-O-O-R
Acidi carbossilici
Alcoli
Fenoli
Aldeidi
Chetoni
Esteri
Eteri
Perossidi
carbossiidrossi-
acido ...-oico
-olo
formilalcoil-[7]
alcossilalcoperossi-
-ale
-one
-ato[8]
-alchil etere
-alchil perossido
-SH
Mercaptani
mercapto-
-tiolo










