Il legame a idrogeno
Il legame a idrogeno è uno dei tre tipi fondamentali di forze intermolecolari assieme a le forze di
dispersione (forze di London) e le forze dipolo-dipolo.
Il legame a idrogeno, detto anche ponte di idrogeno è caratteristico delle molecole polari contenenti
atomi di idrogeno legati direttamente con elementi molto elettronegativi quali fluoro, ossigeno e
azoto. Il legame si forma quando la parziale carica positiva dell’idrogeno (definito accettore) +
entra in contatto con un doppietto elettronico, di uno dei precedenti elementi (detti donatori), che
lega l’idrogeno, facendo acquisire così una parziale carica negativa - all’altro elemento. Il ponte di
idrogeno può essere considerato come un particolare tipo di interazione dipolo-dipolo, ovvero come
un dipolo permanente-dipolo permanente.
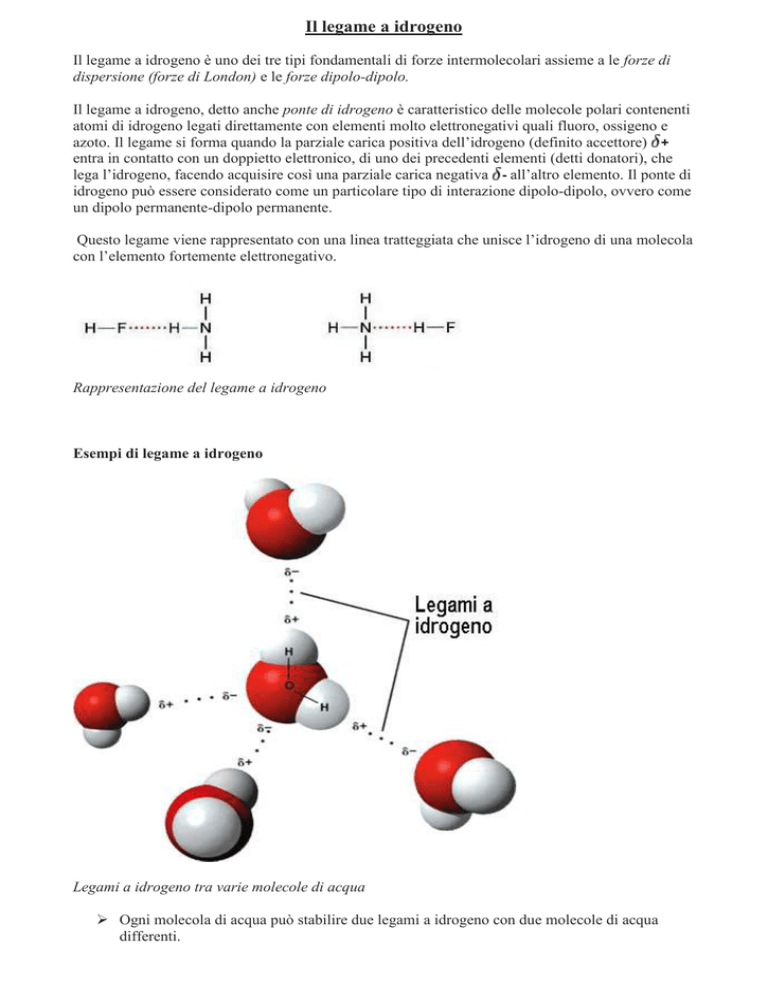
Questo legame viene rappresentato con una linea tratteggiata che unisce l’idrogeno di una molecola
con l’elemento fortemente elettronegativo.
Rappresentazione del legame a idrogeno
Esempi di legame a idrogeno
Legami a idrogeno tra varie molecole di acqua
Ogni molecola di acqua può stabilire due legami a idrogeno con due molecole di acqua
differenti.
Legame a idrogeno tra molecole di H2O e NH3
In base alla loro forza, le forze intermolecolari possono essere così ordinate:
Tipo di forza
Intensità relativa
Dove si trova
Esempio
Forze di
dispersione
Debole ma aumenta
con
il peso molecolare
In tutti gli atomi
e le molecole
H2
Forze dipolodipolo
Moderata
Solo nelle molecole polari
HCL
Legame a
idrogeno
Forte
Nelle molecole contenenti H direttamente
legato a F,O,N
HF
Come si può notare il legame a idrogeno è il tipo di forza intermolecolare più forte, infatti la
sua energia di legame varia tra 20-50 kJ/mol.
Conseguenze del legame a idrogeno
L’esistenza dei ponti di idrogeno si riflette su alcune proprietà fisiche di determinate sostanze.
-Punto di ebollizione, (diminuisce costantemente al diminuire della massa molecolare) quando è
presente un legame a idrogeno il punto di ebollizione assume valori elevati indipendentemente dal
valore del peso molecolare dell’ elemento.
Variazione del punto di ebollizione tra HF, HCl, HBr e HI
Confrontando i valori del punto di ebollizione tra HF, HCl, HBr r HI possiamo notare come
il fluoruro di idrogeno nonostante abbia un peso molecolare minore, presenta una
temperatura di ebollizione maggiore, grazie al legame a idrogeno che si instaura tra H e F.
-Densità, la presenza dei ponti di idrogeno nelle molecole di acqua spiega anche il motivo per cui
la densità del ghiaccio è inferiore a quella dell'acqua, poichè quando l'acqua congela le molecole
sono costrette a distanziarsi per formare la struttura esagonale ordinata tipica del ghiaccio che
risulta essere meno densa della struttura disordinata tipica dell'acqua allo stato liquido.
Struttura dell’acqua allo stato liquido e del ghiaccio
Importanza biologica del legame a idrogeno
I legami a idrogeno hanno una particolare importanza in quanto essi influenzano in maniera
particolare sulle forme e sulle caratteristiche di alcune molecole biologiche.
Struttura, i ponti a idrogeno sono responsabili della formazione della struttura terziaria e
quaternaria delle proteine e del loro corretto funzionamento all’interno dell’organismo
vivente.
Legami a idrogeno nella struttura terziaria delle proteine
DNA, la doppia elica che forma il DNA è resa dai legami a idrogeno che si instaurano tra le
basi azotate presenti sui due filamenti. La duplicazione del DNA è possibile poiché ogni
base azotata interagisce unicamente con un’altra grazie a questi legami che risultano essere
specifici: adenina-timina, citosina-guanina; quando una cellula sta per dividersi i legami a
idrogeno possono essere rotti facilmente, non essendo covalenti. Quando tutti i legami a
idrogeno sono rotti, i singoli filamenti si separano e posso assumere strutture variegate.
Legami a idrogeno tra basi azotate complementari