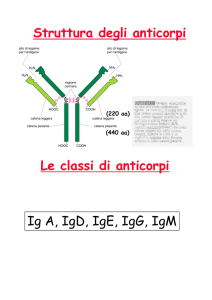
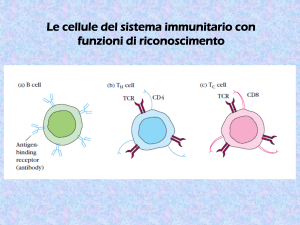
Presentazione dell’antigene alle
cellule T
• Antigen processing
• Antigen presentation
MHC di classe I e II trasportano sulla
superficie cellulare peptidi che derivano da
compartimenti cellulari diversi
• Agenti infettivi possono raggiungere il cytosol o il
compartimento vescicolare e quindi il processamento degli
antigeni può avvenire in entrambi I compartimenti
• MHC di classe I trasportano peptidi che si originano nel
cytosol
• MHC di classe II trasportano peptidi che si originano nelle
vescicole
• L’uso di diverse molecole MHC garantisce che sia attivata
l’appropriata strategia di eliminazione dell’agente infettivo
MHC di classe I e II trasportano sulla
superficie cellulare peptidi che derivano da
compartimenti cellulari diversi
Trasporto di peptidi dalle molecole
MHC di classe I
Trasporto di peptidi dalle molecole
MHC di classe I
• MHC I (catene alfa) si accumulano nel reticolo endoplasmatico dopo la loro sintesi,
associate alla calnexina
• Una volta che si associa la ß2-microglobulina, la calnexina si stacca e la molecola di
MHC ancora non completamente “folded” si associa al trasportatore TAP attraverso un
adattatore (la tapasina)
• Altre molecole sono coinvolte in questa fase: la chaperone ERp57 e la calreticulina
• MHC resta nel reticolo endoplasmatico finchè non è rilasciata dal legame con un
peptide che porta al suo “folding” completo
• Anche in assenza di infezioni, ci sono continuamente peptidi che si formano per opera
del proteasome a partire da:
• “defective ribosomal products” (DRiPs)
• Proteine “vecchie”
• Questi peptidi vengono trasportati da TAP, eventualmente “limati” dall’aminopeptidasi
ERAAP e poi si associano alla molecola di MHC di classe I, che migra al Golgi e da qui è
portata alla membrana cellulare
Trasporto di peptidi dalle molecole
MHC di classe II
Trasporto di peptidi dalle molecole
MHC di classe II
• Una Antigen-Presenting-Cell (APC) può inglobare la fonte di
antigene dall’esterno, oppure il parassita, batterio o virus possono
avere invaso la cellula e replicare all’interno di vescicole
intracellulari
• Il pH delle vescicole va progressivamente acidificandosi
• La diminuzione del pH porta all’attivazione di una serie di proteasi
vescicolari che processano l’antigene in peptidi
• La molecola di MHC di classe II durante la sua maturazione entra
nelle vescicole e si associa al ligando peptidico per poterlo poi
trasportare alla membrana cellulare
Il processo di maturazione delle molecole di MHC di
classe II coinvolge molte proteine accessorie
Organizzazione genica del complesso
MHC
• Il complesso MHC ha due caratteristiche:
– Poligenico: ogni individuo ha molti geni per MHC
di classe I ed altrettanti per la classe II
– Polimorfico: esistono molteplici varianti alleliche
per ogni gene nella popolazione (> 800 alleli)
• Ogni individuo può esprimere almeno tre
molecole di classe I e tre o quattro di classe II
in base alla poligenia delle molecole di MHC, e
molte di più per il loro polimorfismo
Organizzazione genica del complesso
MHC
Restrizione da MHC
Trasduzione del segnale ed
attivazione linfocitaria
Il TCR non è sufficiente per mediare il
signaling intracellulare
• Il TCR funzionale comprende oltre
all’eterodimero alfa-beta del TCR (che contiene
le superfici di interazione per l’antigene) anche
le quattro catene (due epsilon, una gamma ed
una delta) di CD3, e due catene Zeta unite da un
ponte disolfuro
• CD3 e Zeta contengono I domini
“immunoreceptor tyrosine-based activation
motif” (ITAM) che contengono dei residui in
tirosina citoplasmatici che vengono fosforilati in
seguito al legame del recettore con il ligando
Il TCR non è sufficiente per mediare il
signaling intracellulare
• Una volta fosforilati, I domini ITAM diventano
siti di legame per proteine che contengono I
domini di interazione proteina-proteina SH2, in
grado di riconoscere le tirosine fosforilate
Attivazione linfocitaria
• Ogni APC presenta un gran numero di peptidi diversi, quindi il
riconoscimento dell’antigene da parte di TCR e BCR deve
avvenire anche in presenza di un numero basso di molecole
antigeniche specifiche
• Misure in vitro suggeriscono che bastano 20-50 recettori
(TCR-BCR) legati all’antigene specifico per attivare la
risposta linfocitaria
• I primi eventi di legame dei complessi TCR e BCR a
peptide/MHC non sono ben compresi
• Evento primario dopo il riconoscimento dell’antigene/MHC da
parte del TCR è –tramite I corecettori CD4 e CD8- l’attivazione
della chinasi Lck, che è responsabile per la fosforilazione dei
domini ITAM del complesso del TCR
• L’attività di Lck dipende dalla sua defosforilazione per
opera della fosfatasi CD45
• I domini ITAM fosforilati sono riconosciuti dalla chinasi ZAP-70
• Oltre al reclutamento di Lck, I corecettori sono ritenuti anche
responsabili per la stabilizzazione dell’altrimenti non
fortissimo legame fra TCR e peptide/MHC
Attivazione di PLC-gamma
• ZAP-70 fosforila due altri substrati, LAT e SLP-76
• Queste modificazioni consentono ad una proteina adattatrice,
Gads, di formare un complesso ternario con LAT ed SLP-76
• La fosfolipasi C-gamma viene reclutata dal complesso Gads-LATSLP-76 ed a questo punto viene attivata da un’altra chinasi (Itk)
La formazione di “second messengers”
• PLC-gamma genera a partire da PIP2 due lipidi: DAG e IP3
• IP3 porta all’efflusso di ioni Calcio dal reticolo endoplasmatico al
cytosol, e quindi apertura di canali del calcio (CRAC) di membrana che
consentono ulteriore ingresso di Calcio nel cytosol
• DAG porta al reclutamento della Proteina chinasi C-delta e di proteine
attivanti Ras alla membrana citoplasmatica
• Attraverso questi 3 pathways intracellulari
• Ioni calcio
• PKC-delta
• RAS
•
vengono attivati tre diversi pathway trascrizionali
• Ioni Calcio: shuttling nucleare del fattore di trascrizione NFAT
• RAS (attraverso una cascata di chinasi intracellulari) porta
all’attivazione del fattore di trascrizione AP1
• PKC-Delta porta all’attivazione di AP1 e del fattore di trascrizione
NF-kB
• Questi pathway trascrizionali hanno numerosi target
• IL-2 integra I 3 segnali, dal momento che tutti questi fattori di
tarscrizione legano elementi regolatori presenti nel promotore
del gene
IL-2
Il ruolo di CD28 (recettore costimolatore)
Il ruolo di CD28 (recettore costimolatore)
• IL legame dell’antigene al TCR non è sufficiente per l’attivazione linfocitaria delle
cellule T naïve
• Le APCs esprimono sulla superficie cellulare delle molecole co-stimolatorie
• Queste interagiscono con recettori co-stimolatori delle cellule T
• Il legame ligando-recettore (insieme con il legame TCR-MHC/antigene) porta
all’attivazione linfocitaria
• I co-stimolatori attivano un pathway intracellulare parallelo e necessario per
l’efficiente trasduzione del segnale mediata da TCR/antigene
• Il risultato dell’attivazione di CD28 è l’attivazione della PI-3 chinasi che porta alla
produzione di PIP3, che porta a sua volta all’attivazione di Itk che attiva PLC-gamma
• Anche la chinasi Akt è attivata
•
Anche il BCR si comporta come il TCR
• Il BCR si associa ad un eterodimero (legato
attraverso un ponte disolfuro) di due
molecole chiamate Ig-alfa ed Ig-beta, che
presentano entrambe un dominio ITAM che
viene fosforilato dopo legame del BCR
all’antigene
Anche il BCR si comporta come il TCR
• Diverse chinasi fosforilano I domini ITAM presenti sulle
molecole associate al BCR (IG-alfa ed Ig-beta)
• La chinasi Syk (come ZAP-70) si associa ai domani
fosforilati ITAM del BCR
• Syk porta all’attivazione di vari pathway intracellulari
• Pathway e fattori di trascrizione coinvolti si
sovrappongono in gran parte a quelli delle cellule
T, ma l’outcome è diverso
La risposta immune è regolata da
recettori inibitori
• Molecole correlate a CD28 sono espresse dai
linfociti T e legano molecole della famiglia di B7
• Tra queste molecole, alcune hanno attività
inibitoria
– Cellule T: CTLA-4 e PD-1
– Cellule B/T: BTLA
• Modelli animali: topi privi di CTLA-4 hanno
proliferazioni linfocitaria incontrollata, a
dimostrazione della necessità dei meccanismi di
controllo
Attività di CTLA-4 come bloccante il
legame di CD28 a B7