1
SISTEMATICA CHIMICA E NOMENCLATURA
INTRODUZIONE.
Scopo della sistematica chimica è quello di suddividere i milioni di composti esistenti in
gruppi simili ai quali si può, in linea di massima, attribuire una formula generale che
indica tipo e numero di atomi presenti. Ad ogni composto va poi assegnato un nome
razionale che lo identifica in modo univoco e dal quale è possibile risalire alla sua
formula chimica; per questo fine, si possono utilizzare vari tipi di nomenclatura, ma
quelle più utilizzate attualmente sono la nomenclatura classica o tradizionale e la
nomenclatura IUPAC, più moderna ed universalmente impiegata. Entrambe si basano su
precise regole da seguire per assegnare il nome ad un composto in relazione al tipo ed al
numero di atomi che lo compongono.
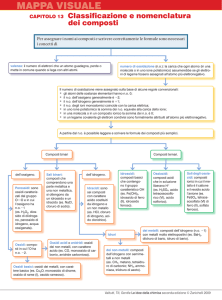
CLASSIFICAZIONE DEI COMPOSTI.
La sistematica chimica distingue tutti i composti esistenti in due categorie fondamentali:
1) i composti binari costituiti da atomi di due elementi diversi (ad esempio H 2O, NH3,
FeS, HCl, NaCl…);
2) i composti ternari costituiti da atomi di tre elementi diversi (ad esempio Na2SO4,
HClO3, KMnO4…);
3) i composti quaternari costituti da atomi di quattro elementi diversi (ad esempio
NaHCO3, KHSO4…).
Un ulteriore classificazione si basa sul tipo di atomi presenti nei composti, ovvero se essi
sono formati da metalli, non metalli, ossigeno e/o idrogeno:
a) si dicono OSSIDI BASICI (nomenclatura IUPAC) o semplicemente OSSIDI i composti
formati da un metallo e da ossigeno;
b) si dicono OSSIDI ACIDI (nomenclatura IUPAC) o ANIDRIDI i composti formati da un
non-metallo e da ossigeno;
c) si dicono IDROSSIDI i composti formati da un metallo, ossigeno ed idrogeno;
d) si dicono IDRURI i composti formati da un metallo e da idrogeno;
e) si dicono IDRACIDI i composti formati da un non-metallo e da idrogeno;
f) si dicono OSSIACIDI o ACIDI OSSIGENATI i composti formati da idrogeno, un nonmetallo ed ossigeno;
g) si dicono SALI i composti formati da un metallo e da un non-metallo;
h) si dicono SALI OSSIGENATI i composti formati da un metallo, da un non-metallo e da
ossigeno.
Tutti questi tipi di composti possono essere ricondotti a delle formule generali e per ogni
classe si possono scrivere le reazioni di formazione a partire da precisi reagenti.
Si può già notare che ossidi, anidridi, idruri, idracidi ed alcuni sali fanno parte dei
composti binari, mentre idrossidi, ossiacidi e sali ossigenati appartengono ai composti
ternari.
Prima di esaminare le reazioni di formazione di questi composti e di assegnare loro
l’appropriato nome è necessario introdurre nuovamente il concetto di valenza, di numero
di ossidazione e di elettronegatività.
2
VALENZA E NUMERO DI OSSIDAZIONE.
Per VALENZA di un atomo si intende il numero di legami che esso può formare, ovvero il
numero di elettroni coinvolti nei legami con altri atomi. Essa si indica in numeri romani e
si scrive come apice a destra del simbolo dell’atomo; ad esempio, la notazione C IV indica
che l’atomo di carbonio ha valenza 4 (ovvero è tetravalente), cioè può formare quattro
legami.
Più complessa, ma più utile, è la definizione di NUMERO DI OSSIDAZIONE (n.o.) che
rappresenta l’ipotetica carica che un atomo coinvolto in un legame assumerebbe se gli
elettroni di legame fossero attratti dall’atomo più elettronegativo. Tale numero può,
quindi, assumere valori positivi o negativi. Si ricorda che l’elettronegatività esprime la
tendenza di un atomo coinvolto in un legame ad attrarre su di se gli elettroni di legame e
che, lungo la tavola periodica degli elementi, essa aumenta procedendo da sinistra verso
destra e dal basso verso l’alto. Ad esempio, si consideri l’acido cloridrico HCl; il cloro è
molto più elettronegativo dell’idrogeno, per cui si può assumere che esso acquisti una
carica negativa -1, mentre l’idrogeno assume una ipotetica carica +1. In tal caso si dice
che il cloro ha n.o. = -1 e l’idrogeno ha n.o. = +1.
La valenza o il numero di ossidazione di qualsiasi atomo in un composto può essere
determinata seguendo regole ben precise e ricordando che:
o l’idrogeno è sempre monovalente, ovvero ha sempre n.o. = +1, eccetto negli idruri in
cui ha n.o.= -1;
o l’ossigeno è sempre bivalente, ovvero ha sempre n.o.= -2, eccetto nei perossidi in cui
ha n.o.= -1;
o i metalli alcalini sono sempre monovalenti, ovvero hanno sempre n.o. = +1;
o i metalli alcalino - terrosi sono sempre bivalenti, ovvero hanno sempre n.o. = +2;
o gli alogeni sono sempre monovalenti rispetto l’idrogeno, ovvero hanno sempre
n.o. = -1 nei loro composti con tale elemento;
o il n.o di uno ione monoatomico è uguale alla carica dello ione;
o la somma dei n.o. degli atomi di una molecola neutra è nulla;
o la somma dei n.o. degli atomi di uno ione poliatomico è uguale alla carica dello ione.
È possibile, così, risalire ai n.o. o alle valenze degli atomi di un composto conoscendo i
n.o. o le valenze degli elementi base ed impostando opportune equazioni per il loro
calcolo. Ad esempio, nel sale FeCl2 il cloro è monovalente (n.o. = -1) ed il ferro è bivalente
(n.o. = +2). Infatti, gli atomi coinvolti in un legame devono avere a disposizione un ugual
numero di elettroni per formare le coppie di legame; nell’esempio specifico è come dire
che il cloro può formare un solo legame, mentre il ferro due legami. Ne deriva che,
affinché i due atomi posseggano lo stesso numero di elettroni coinvolti nei legami, il ferro
deve legare due atomi di cloro per formare il composto dato. Si può quindi affermare che,
per determinare la formula di un composto, è sufficiente calcolare il m.c.m. tra le valenze
dei due elementi (che indica il numero di elettroni disponibili per ogni elemento) e
dividerlo per ciascuna di esse, ottenendo così il corrispondente indice:
FeII
m.c.m. = 2
ClI
4 : 4 = 1 indice di S
m.c.m. = 4
AlIII
4 : 2 = 2 indice di O
SO2
6 : 3 = 2 indice di Al
m.c.m. = 6
OII
FeCl2
2 : 1 = 2 indice di Cl
SIV
OII
2 : 2 = 1 indice di Fe
Al2O3
6 : 2 = 3 indice di O
3
Allo stesso modo è possibile risalire alle valenze dei singoli elementi presenti in un
composto semplicemente scambiando gli indici presenti nella sua formula:
Na2O
scambio degli indici Na monovalente
O bivalente
FeCl3
scambio degli indici Fe trivalente
Cl monovalente
P 2O 5
scambio degli indici P pentavalente
O bivalente
Questo procedimento è molto semplice da applicare per i composti binari, ma risulta più
complicato per i composti ternari e quaternari. Un metodo più semplice e diretto consiste
nel considerare i n.o. il cui calcolo è più immediato seguendo le regole sopra citate. Si
consideri, ad esempio, il composto KMnO4. In base a quanto elencato precedentemente, il
potassio ha sempre n.o. = +1 e l’ossigeno ha sempre n.o. = -2, quindi il problema consiste
nel determinare il n.o. del manganese. A tal fine si imposta un’equazione del tipo:
+1 + x + 4 (-2) = 0
essendo il composto in esame neutro.
Risolvendo come una semplice equazione di primo grado:
+1 + x -8 = 0
da cui x = 8 – 1 = +7
Ne deriva che il manganese in questo composto ha n.o. = +7, ovvero è eptavalente.
Si consideri, ora, il caso di uno ione poliatomico come Cr 2O72-; sapendo che l’ossigeno ha
sempre n.o. = +2, il n.o. del cromo si ottiene risolvendo l’equazione di primo grado:
2x + 7(-2) = -2
da cui 2x – 14 = -2 ovvero 2x = 12 ed x = +6
Questo vuol dire che l’atomo di cromo in questo composto ha n.o. = +6, ovvero è
esavalente.
REAZIONI DI FORMAZIONE e NOMENCLATURA delle varie classi di composti.
Ossidi ed Anidridi.
Gli ossidi propriamente detti nella nomenclatura IUPAC come composti che si formano
per reazione degli elementi con l’ossigeno vengono distinti, nella nomenclatura
tradizionale, in ossidi ed anidridi a seconda che l’elemento che reagisce con l’ossigeno sia
un metallo o un non-metallo. Da questa distinzione, deriva che i generici ossidi si
ottengono sempre per reazione di un elemento con l’ossigeno:
Metallo + Ossigeno Ossido basico
ESEMPI:
4Na
2Mg
2Fe
4Fe
+ O2
+ O2
+ O2
+ 3O2
TRADIZIONALE
2Na2O
2MgO
2FeO
2Fe2O3
Ossido di sodio
Ossido di magnesio
Ossido ferroso
Ossido ferrico
IUPAC
Ossido di disodio
Ossido di magnesio
Ossido di ferro
Triossido di diferro
4
Non-metallo + Ossigeno Ossido acido o Anidride
ESEMPI:
S
2S
2P
2P
2Cl2
2Cl2
2Cl2
2Cl2
+
+
+
+
+
+
+
+
O2
3O2
3O2
5O2
O2
3O2
5O2
7O2
TRADIZIONALE
SO2
2SO3
P2O3
P2O5
2Cl2O
2Cl2O3
2Cl2O5
2Cl2O7
Anidride solforosa
Anidride solforica
Anidride fosforosa
Anidride fosforica
Anidride ipoclorosa
Anidride clorosa
Anidride clorica
Anidride perclorica
IUPAC
Diossido di zolfo
Triossido di zolfo
Triossido di fosforo
Pentossido di fosforo
Ossido di dicloro
Triossido di dicloro
Pentossido di dicloro
Eptaossido di dicloro
Per quanto riguarda la nomenclatura di questi composti, il sistema IUPAC identifica
come ossidi tutti i composti ottenuti per reazione di qualsiasi elemento con l’ossigeno e li
nomina semplicemente indicando il numero di atomi di ossigeno e dell’elemento
attraverso i prefissi di -, tri-, tetra-, penta-, esa-, epta-… anteponendo il nome “ossido” a
quello dell’altro elemento. Nella nomenclatura tradizionale, invece, si effettua la
distinzione tra ossidi ed anidridi in base al carattere metallico o non- metallico
dell’elemento che si lega all’ossigeno; inoltre, si devono considerare le valenze di entrambi
gli atomi secondo il seguente schema:
Non-metallo : suffisso IPO- + nome del non-metallo + desinenza – OSO o – OSA
la valenza o n.o. più bassa in assoluto
nome del non-metallo + desinenza – OSO o –OSA per la valenza
bassa
nome del non-metallo + desinenza – ICO o – ICA per la valenza
alta
suffisso PER- + nome del non-metallo + desinenza - ICO o – ICA
la valenza o n.o. più alto
per
più
più
per
Metallo : nome del metallo + desinenza – OSO per la valenza più bassa
nome del metallo + desinenza – ICO per la valenza più alta
se il metallo possiede una unica valenza, si utilizza semplicemente la
preposizione “di” seguita dal nome del metallo
COSTRUZIONE GENERALE DEL NOME DI UN OSSIDO O DI UN’ANIDRIDE
nella nomenclatura tradizionale
OSSIDO + nome del metallo + desinenza – OSO o – ICO a seconda della valenza
(più bassa o più alta)
ANIDRIDE + prefisso IPO- o PER- (se necessari) + nome del non-metallo + desinenza
– OSA o – ICA
Idrossidi.
Si ottengono per reazione degli ossidi propriamente detti o ossidi basici con l’acqua ed il
loro nome si assegna facilmente anteponendo il termine IDROSSIDO al nome del metallo
da cui derivano (attenzione: nella nomenclatura IUPAC si devono sempre indicare il
numero di atomi o di gruppi atomici presenti, mentre nella nomenclatura tradizionale si
deve semplicemente indicare, quando necessario, la desinenza del metallo).
5
ESEMPI:
Na2O
MgO
FeO
Fe2O3
+
+
+
+
TRADIZIONALE
H 2O
H 2O
H 2O
H 2O
2NaOH
Mg(OH)2
Fe(OH)2
Fe(OH)3
Idrossido di sodio
Idrossido di magnesio
Idrossido ferroso
Idrossido ferrico
IUPAC
Idrossido di sodio
Diidrossido di magnesio
Diidrossido di ferro
Triidrossido di ferro
Non a caso gli ossidi basici hanno questo nome; infatti, reagendo con l’acqua, formano
composti “basici” caratterizzati da un tipico comportamento alcalino con peculiari
caratteristiche (sono vischiosi, amarognoli e molto corrosivi).
Da sottolineare che gli idrossidi si ottengono anche per reazione diretta tra i metalli
(soprattutto i metalli alcalini ed alcalino – terrosi)e l’acqua.
Idruri.
Tali composti si ottengono per reazione di metalli alcalini ed alcalino – terrosi con
idrogeno gassoso ed il loro nome si costruisce semplicemente anteponendo al termine
IDRURO il nome del metallo.
2Na + H2 2NaH
2Li + H2 2LiH
Mg + H2 MgH2
Idruro di sodio
Idruro di litio
Idruro di magnesio
Idracidi.
Si ottengono per reazione dei non-metalli con idrogeno gassoso ed il loro nome nella
nomenclatura tradizionale si ottiene posponendo al temine ACIDO il nome del nonmetallo seguito dalla desinenza –IDRICO. Nella nomenclatura IUPAC, invece, si indica il
non-metallo con la desinenza – URO seguita dalla costruzione di idrogeno, indicando gli
atomi di questo elementi presenti nel composto.
ESEMPI:
H2
H2
H2
H2
H2
+
+
+
+
+
F2 2HF
Cl2 2HCl
Br2 2HBr
I2
2HI
S
H 2S
TRADIZIONALE
Acido fluoridrico
Acido cloridrico
Acido brimidrico
Acido iodidrico
Acido solfidrico
IUPAC
Fluoruro di idrogeno
Cloruro di idrogeno
Bromuro di idrogeno
Ioduro di idrogeno
Solfuro di diidrogeno
Ossiacidi o acidi ossigenati.
Per quanto riguarda tali composti è molto più semplici riferirsi alla nomenclatura
tradizionale secondo la quale il loro nome discende dal fatto che essi si ottengono per
reazione delle corrispondenti anidridi con l’acqua. Il nome di tali acidi si ottiene
posponendo al termine ACIDO il nome del non-metallo preceduto e seguito dalle apposite
desinenze a seconda della valenza del non-metallo.
6
ESEMPI:
SO2
SO3
N 2O 3
N 2O 5
CO2
Mn2O7
TRADIZIONALE
+
+
+
+
+
+
H 2O
H 2O
H 2O
H 2O
H 2O
H 2O
H2SO3
H2SO4
2HNO2
2HNO3
H2CO3
HMnO4
Acido solforoso
Acido solforico
Acido nitroso
Acido nitrico
Acido carbonico
Acido permanganico
IUPAC
Acido triossosolforico
Acido tetraossosolforico
Acido diossonitrico
Acido triossonitrico
Acido triossocarbonico
Acido tetraossomanganico
Solitamente, gli ossiacidi si ottengono per reazione delle corrispondenti anidridi con una
molecola di acqua e la formula dell’acido si ottiene semplicemente sommando
singolarmente i vari tipi di atomi, andando a semplificare quando possibile. Per alcune
anidridi, però, si possono ottenere diversi acidi a seconda del numero di molecole di
acqua che esse legano; un esempio tipico è quello delle anidridi del fosforo, l’anidride
fosforosa P2O3 e l’anidride fosforica P2O5, che possono combinarsi con una, due o tre
molecole di acqua dando origine, rispettivamente, agli acidi meta, piro ed orto:
P2O5 + H2O 2HPO3
P2O5 + 2H2O H4P2O7
P2O5 + 3H2O H3PO4
Acido metafosforico
Acido pirofosforico
Acido ortofosforico (acido fosforico)
Elementi non-metallici che si comportano in modo analogo sono il boro, il silicio,
l’arsenico e l’antimonio.
Da notare che la valenza del non-metallo presente negli ossiacidi si può calcolare
semplicemente moltiplicando la valenza dell’ossigeno (2) per il numero dello stesso
presenti nella formula e sottraendo al risultato ottenuto il numero di atomi di idrogeno:
H2Cr2O7
valenza del cromo = [(7 x 2) – 2]/2 = (14 – 2)/2 = 6
Sali binari.
I sali binari si ottengono prevalentemente per reazione tra idracidi e metalli o idracidi e
ossidi basici o idracidi e idrossidi secondo le seguenti reazioni:
TRADIZIONALE
Zn
CaO
NaOH
Fe(OH)3
+
+
+
+
2HCl
HCl
HCl
3HCl
ZnCl2 + H2
CaCl2 + H2O
NaCl + H2O
FeCl3 + 3H2O
Cloruro zincoso
Cloruro di calcio
Cloruro di sodio
Cloruro ferrico
IUPAC
Dicloruro di zinco
Dicloruro di calcio
Cloruro di sodio
Tricloruro di ferro
Si nota che la formazione di questi Sali comporta sempre lo sviluppo di idrogeno o la
formazione di acqua.
Per quanto riguarda l’assegnazione del nome, secondo la nomenclatura tradizionale si
indica il nome del non-metallo associato dalla desinenza –URO (dalla desinenza –IDRICO
del corrispondente idracido) e seguito dal nome del metallo con l’apposito suffisso – OSO
o – ICO a seconda della sua valenza. Nella nomenclatura IUPAC, al solito, si indicano
sempre tipo e numero degli elementi presenti.
7
Sali ternari o Sali ossigenati.
Questi sali differiscono dai precedenti perché presentano sempre atomi di ossigeno nella
loro formula. Si ottengono prevalentemente per reazione di acidi ossigenati con metalli,
ossidi basici ed idrossidi, seguendo le seguenti reazioni:
TRADIZIONALE
2Na
FeO
2Al(OH)3
3Pb(OH)4
+
+
+
+
2HClO 2NaClO + H2
2HNO3 Fe(NO3)2 + H2O
3H2SO4 Al2(SO4)3 + 6H2O
4H3PO4 Pb3(PO4)4 + 12H2O
Ipoclorito di sodio
Nitrato ferroso
Solfato di alluminio
Fosfato piombico
La relativa nomenclatura tradizionale prevede che il nome dei sali ternari si ottenga
seguendo la costruzione:
Prefisso
IPO- o PER(se necessario)
+ nome del non-metallo + desinenza -ITO (valenza più bassa)
-ATO (valenza più alta)
+ nome del metallo + desinenza –OSO o –ITO
In altre parole, la desinenza del corrispondente acido si trasforma da –OSO a –ITO e da
–ICO ad – ATO quando si passa ai sali ossigenati.
Come intuibile, tutti i sali derivano dai corrispondenti acidi attraverso reazioni in cui si
scambiano i cosiddetti RADICALI ACIDI che derivano dagli acidi per eliminazione di uno
o più idrogeni.
ESEMPI:
OSSIACIDO
H2SO3
H2SO3
H2SO4
HNO3
H3PO3
H3PO4
H3PO4
H2CO3
H2CO3
HCl
H 2S
RADICALE ACIDO
SO32HSO3SO42NO3PO33PO43HPO42CO32HCO3Cl S 2-
Solfito
Bisolfito
Solfato
Nitrato
Fosfito
Fosfato
Fosfato acido
Carbonato
Bicarbonato
Cloruro
Solfuro
I radicali acidi hanno la valenza o il n.o. uguale alla loro carica, ovvero la valenza
dell’intero radicale è uguale al numero di idrogeni sottratti all’acido corrispondente.
8