Biochimica
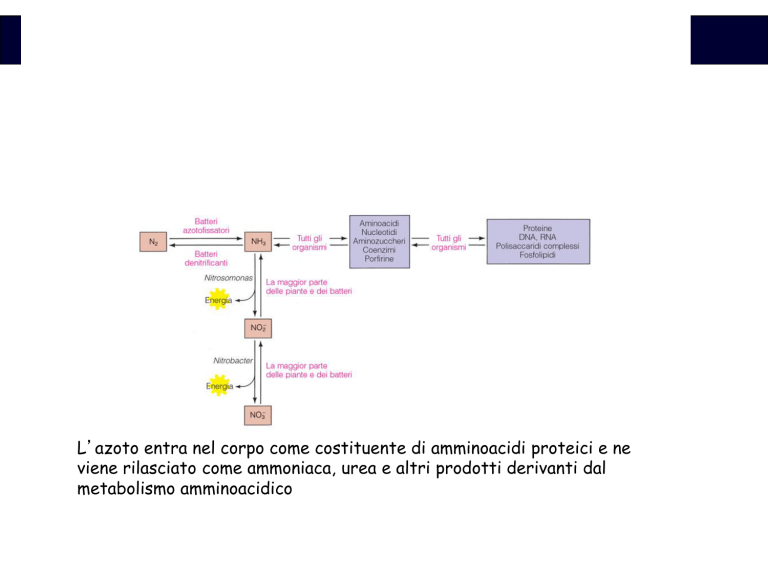
L’azoto entra nel corpo come costituente di amminoacidi proteici e ne
viene rilasciato come ammoniaca, urea e altri prodotti derivanti dal
metabolismo amminoacidico
Biochimica
Idrolisi di proteine introdotte con la dieta, sintetizzate ex novo: pool
aminoacidi liberi
Sintesi di proteine corporee
300-400 gr al giorno
Sintesi di molecole:
porfirine
Creatina, neurotrasmettitori
Purine, pirimidine etc
Metabolizzate:
Glucosio,glicogeno
CO2
Corpi chetonici, acidi grassi,steroidi
Biochimica
Biochimica
Tipico degli organismi
in crescita:
Gravidanza e
allattamento
Biochimica
Biochimica
Biochimica
8
Biochimica
Digestione ed assorbimento delle proteine e degli aminoacidi
La digestione inizia nello stomaco
H+-K+ ATPase
Si Ottengono
polipeptidi e
amminoacidi
Intestino tenue
Biochimica
I peptidi sono ulteriormente scissi dall’azione di proteasi pancreatiche: il loro rilascio è
stimolato dalla produzione di CCK delle cellule intestinali e attivate dalla liberazione di ioni
Gli amminoacidi liberi e i dipeptidi sono assunti dalle cellule
carbonato il cui rilascio è stimolato dalla secretina
dell’epitelio intestinale.
Tripsina, chimotripsina, elastasi, carbossipeptidasi hanno specificità diverse
I dipeptidi prima di essere rilasciati nel sistema portale vengono
idrolizzati
Poiché la concentrazione di amminoacidi liberi nei fluidi
extracellulari è comunque inferiore a quella intracellulare, il
trasporto è effettuato da sistemi di trasporto attivo per idrolisi
di ATP.
Una amminopeptidasi stacca in
successione il residuo
amminoterminale producendo
ammnioacidi liberi
Il catabolismo degli amminoacidi
nelle piante è in genere correlato alla
Biochimica
produzione di metaboliti per altre vie biosintetiche.
Tre situazioni in cui gli amminoacidi negli animali subiscono una
degradazione ossidativa:
1) Durante la sintesi e degradazione delle proteine cellulari (turnover delle
proteine), alcuni amminoacidi, se non necessari per la sintesi di altre proteine
possono essere ossidati.
2) Quando una dieta è ricca di proteine e gli amminoacidi sono in eccesso per
la sintesi di proteine; non si possono formare riserve di amminoacidi!
3) Durante il digiuno prolungato.
Biochimica
Da dove
dove vengono
vengono i
Da
gruppi amminici?
amminici?
gruppi
44
Biochimica
Destino metabolico degli amminoacidi
Per poter essere utilizzati nel
metabolismo energetico gli aminoacidi
devono prima subire deamminazione:
L’azoto può essere eliminato o
incorporato in altri composti
1.transamminazione
amminotraferasi
Glutammato DH
Dette anche transaminasi si trovano nel citosol di tutte le cellule, ma specialmente nelle cellule
epatiche, renali, intestinali e muscolari
Biochimica
AST = aspartato aminotransferasi
ALT= alanina aminotransferasi
Biochimica
Derivato della vitamina B6
Biochimica
aminoacidi
chetoacidi
Biochimica
Trasporto di ammoniaca:
Utilizzo della glutammina sintetasi (1)
Tessuti
periferici
Fegato e rene
Glutamminasi (2)
Biochimica
Biochimica
Biochimica
La gln è l’amminoacido più concentrato nel
sangue:
a livello renale rilascia ammoniaca che si
protona a NH4+ (serve a tamponare il pH acido,
risparmiando HCO3-)
donatore di azoto per la sintesi di altri
amminoacidi (his e trp), basi puriniche, a livello di
SNC è precursore di glu e GABA
nell’intestino viene trasformata in alanina e
ammoniaca, l’alanina andrà al fegato dove darà
piruvato e glutammato (sintesi dell’urea).
Biochimica
..nel muscolo la molecola prescelta per il trasporto è l’alanina
α-KG
piruvato
Biochimica
Il ciclo del glucosio -alanina
Ciclo glucosio-alanina
Biochimica
2. Deamminazione ossidativa
GDP e ADP
ATP e GTP
Glutammato DH (nella matrice
mitocondriale)
Preferenzialmente nel fegato e nel rene
Meccanismo spontaneo
Dopo l’assunzione di un pasto ricco di proteine il livello di glutammato epatico si alza e la reazione
proceve verso la formazione di NH3
Biochimica
Biochimica
Biochimica
E’ possibile classificare le specie animali in base al prodotto di
escrezione attraverso cui eliminano l’azoto:
o Gli animali ammoniotelici eliminano l’azoto sotto forma di ammoniaca
(animali acquatici come i pesci)
o Gli animali ureotelici eliminano l’azoto sotto forma di urea
(mammiferi e anfibi adulti)
o Gli animali uricotelici eliminano l’azoto sotto forma di acido urico
(uccelli e rettili)
Le piante riciclano i gruppi amminici senza alcun tipo di escrezione
ammoniaca
urea
Acido urico
Biochimica
Il ciclo dell’urea avviene in modo completo solamente nel fegato
In due compartimenti cellulari: mitocondri e citoplasma
La reazione complessiva del ciclo dell’urea è la seguente:
2NH4+ + HCO-3 + 4ATP + H2O → UREA + 4ADP + 4Pi
Biochimica
Ciclo dell’urea
Deriva dalla deamminazione ossidativa del Glu
Carbamil fosfato sintetasi I
Ornitina
transcarbamilasi
Viene trasportata nel citosol
Biochimica
Regolazione del
ciclo dell’Urea
arginina
49
Biochimica
Argininsuccinato
sintasi
Argininsuccinato
liasi
Biochimica
arginasi
Un aumento di aminoacidi in entrata nel fegato a causa di attiva
degradazione delle proteine a causa di digiuno [gluconeogenesi] o
aumento dell’apporto proteico nella dieta inducono gli enzimi del
ciclo
Biochimica
Ciclo dell’urea
Solo nel fegato
Esistono disordini legati a difetti di
tutti gli enzimi del ciclo.
Provocano iperammonemia, alcalosi,
encefalopatie, disordini legati alla
tossicità dell’ammoniaca sul sistema
nervoso.
In condizioni di acidosi metabolica
nel rene viene stimolato l’assorbimento
di gln, indotta la glutamminasi e la glu
DH: aumenta il rilascio di NH4+, gli
scheletri carboniosi vengono utilizzati nel
ciclo di Krebs a formare CO2 ≅ HCO3che parteciperà a neutralizzare H+ in
eccesso.
Nel fegato si ha diminuzione del ciclo
dell’urea con risparmio di gln per il rene
Fumarasi
Malato DH
ossalacetato che viene transaminato in aspartato. Il fumarato fa da
Biochimica
“trait d’union” fra ciclo dell’urea
e ciclo dell’acido citrico (Krebs).
Biochimica
La deaminazione degli amminoacidi
porta alla formazione di 7 prodotti
intermedi
Biochimica
Biochimica
Biochimica
Sintesi delle catecolamine
Regolatori del metabolismo dei
carboidrati e dei lipidi
Biochimica
La creatina
La sintesi avviene prevalentemente
nel fegato e nei reni
La quantità è correlata
alla massa muscolare
Avviene nel muscolo e nel
cervello
Si trova prevalentemente nel muscolo
Biochimica
Biochimica
Poiché la sua eliminazione giornaliera
è costante, la quantità di creatinina
rilasciata nelle 24 ore, può essere
utilizzata per determinare se il
campione rispecchia l’eliminazione
giornaliera di urina e quindi
determinare eventuali danni come
l’insufficienza cardiaca, disidratazione,
ostruzione del flusso urinario.
Funge da riserva di ATP
Biochimica
Errori congeniti del metabolismo aminoacidico










