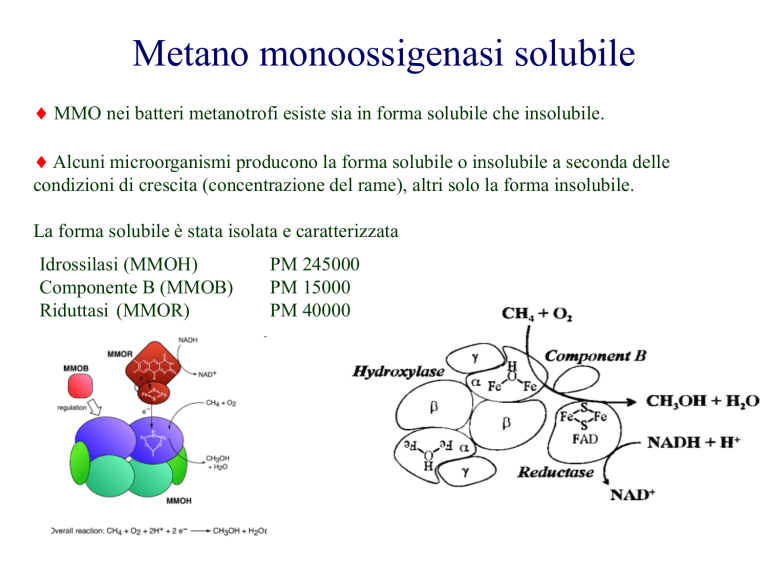
Metano monoossigenasi solubile
MMO nei batteri metanotrofi esiste sia in forma solubile che insolubile.
Alcuni microorganismi producono la forma solubile o insolubile a seconda delle
condizioni di crescita (concentrazione del rame), altri solo la forma insolubile.
La forma solubile è stata isolata e caratterizzata
Idrossilasi (MMOH)
Componente B (MMOB)
Riduttasi (MMOR)
PM 245000
PM 15000
PM 40000
Idrossilasi e sue proprietà
spettroscopiche
E’ costituita da 6 subunità (222).
La subunità contiene un centro binucleare con ioni ferro collegati da un ponte a OH.
Nello stato di riposo il cluster è nello stato diferrico [FeIII-FeIII.
Può accettare 1 o 2 elettroni per dare la valenza mista [FeIII-FeII o lo stato diferroso
[FeII-FeII.
La forma ridotta è quella che lega O2 e dà inizio al ciclo catalitico
Proprietà spettroscopiche:
Forma ossidata: 2 ioni Fe3+ (S=5/2) antiferromagneticamente accoppiati per dare un centro
diamagnetico EPR silente
Dati EXAFS indicano una distanza Fe-Fe > 3 Å.
Dati Mossbauer indicano una costante di accoppiamento Fe-Fe più debole che nel caso di
-oxo-bridged clusters.
3+
3+
Fe
Fe
OH
Idrossilasi: proprietà spettroscopiche
Forma semiridotta: 2 ioni Fe3+ e Fe2+ (S=5/2 e S=2) per
dare una specie antiferromagneticamente accoppiata con S = ½
- EPR gav < 2
Forma ridotta: 2 ioni Fe2+ (S=2) ferromagneticamente accoppiati per dare una specie con
stato fondamentale S = 4.
- EPR gav = 16
-Dati Mossbauer indicano che i 2 ioni ferro sono in intorni simili, ma distinguibili.
-Spettri CD e MCD indicano che ogni ione ferro è 5-coordinato con geometria piramidale
quadrata distorta.
-Dati EXAFS indicano che i 2 ioni ferro sono più lontani che negli altri stati di ossidazione
-e possono essere meno fortemente accoppiati.
Ciò è in accordo con la struttura cristallina che indica la perdita del ponte idrossido
C
O
+
O
2+
Fe
2+
Fe
Struttura cristallografica
La struttura della
forma ossidata è nota
sia per l’idrossilasi
da Methylococcus
capsulatus che da
Methylosinus
trichosporium
Il centro binucleare risiede in un centro costituito da un
“4-helix bundle” con 2 segmenti Glu-X-X-His che
servono come leganti degli ioni ferro.
Forma ossidata
Nella forma ossidata ogni ione ferro è esa-coordinato con un N istidinico e 5 O come
leganti. I dettagli variano a seconda dell’enzima e delle condizioni sperimentali
Maarten Merkx et al., Angewandte Chemie International Edition, 2001, 40:2782-2807
Centro binucleare nella forma ossidata e ridotta
In seguito a riduzione il Glu 243 subisce il cosiddetto “shift del carbossilato”, ovvero passa da una
posizione terminale, come monodentato su il Fe2, a legante monodentato a ponte tra i 2 ioni ferro.
Uno dei 2 ponti OH viene perso e l’altro diventa legante terminale su Fe1.
Fe2+ 5-coordinato
Non è stato individuato un vero e proprio canale verso l’interno della proteina.
L’ingresso del substrato puo’ essere dipendente dalla flessibilità della proteina o dall’interazione con
MMOB e MMOR per creare un canale di entrata.
Riduttasi (MMOR) e componente B
(MMOB)
Riduttasi
Contiene sia FAD che un centro Fe2S2.
Ossida il NADH. Gli e- vengono trasferiti al sito diferrico dell’idrossilasi attraverso
il FAD e il centro Fe2S2.
La MMOR interagisce con MMOH modificandone la struttura o la reattività,
attraverso la formazione di un complesso con la subunità .
Componente B
Non contiene cofattori o centri metallici.
MMOB interagisce con la subunità della MMOH.
La formazione del complesso ha effetti sulla velocità delle reazioni del ciclo
catalitico, sulla struttura della MMOH.
MMOR: struttura dei domini che legano NAD e FAD
NAD domain
FAD domain
(A) The backbone atoms (N,C,C) of the 10 lowest energy NMR-derived structures are displayed in
stereoview (residues 10-251). Secondary structural elements are shown colored in cyan ( sheet)
and red ( helix).
(B) Ribbon diagram and nomenclature of FAD- and NADH-domains, with bound FAD cofactor shown in
blue at the interface between the two domains.
MMOR: struttura del dominio che contiene il centro Fe-S
(A) Stereoview of the backbone atoms (N, C, and C) of 10 superimposed NMR-derived structures
of MMOR-Fd (residues 3-96). strands and helices are shown in blue and red, respectively.
(B) Ribbon diagram of MMOR-Fd in the same orientation
MMOB structure
Ribbon diagram of the structure including terminal regions, the orientations of which are not defined.
Effetti regolatori della riduttasi e della
componente B
MMOR: la sua interazione con la subunità della MMOH ne modula il potenziale in modo
da permettere il trasferimento degli elettroni a MMOH
MMOB: la sua interazione con la subunità della MMOH permette alla forma ridotta di
MMOH di interagire rapidamente con O2 e facilita l’interconversione degli intermedi per dare
il composto Q, che interagisce direttamente con il substrato
Come MMOB modula la reattività per O2?
Induce cambiamenti conformazionali in MMOH, di lieve entità aumentando l’accessibilità al
sito metallico binucleare.
Il sito binucleare è schermato dal solvente da 2 eliche, contenenti 4 AA legati al ferro,
che confinano con un canale aperto dove interagiscono le altre componenti.
Ogni perturbazione in queste eliche, per es. causata dall’interazione con MMOB, può alterare
l’intorno del cluster binucleare
L’azione combinata di MMOR e MMOB rende ottimale
l’attività catalitica
A surface diagram model for docking MMOB (top) into the canyon of
MMOH (bottom). Each subunit of MMOH is distinguished by color,
whereas MMOB is colored according to binding data. Residues of MMOB
most affected are colored blue and those least affected are red.
For clarity, MMOB has been translated away from its proposed docking
site on the surface of the hydroxylase and rotated clockwise about the yaxis by 90° to expose residues most involved in binding.
Studi genetici
Il cluster di geni della MMOH, MMOR, MMOB è stato sequenziato e clonato sia per
le proteine da Methylococcus. capsulatus che Methylosinus trichosporium.
MMOH, a differenza di MMOR e MMOB, non viene espressa singolarmente in forma attiva.
L’intero cluster di geni è stato clonato con successo in E. coli, e in Pseudomonas.
Il batterio ricombinante ha bassa attività nei confronti del metano, ma può ossidare altri
substrati come tricloroetilene.
Sequenza degli intermedi di reazione
Il ciclo comincia con la
riduzione dello ione Fe3+ a Fe2+
.
Composto O - Mantiene il segnale EPR g = 16, dello stato
diferroso. E’ l’addotto che si forma per interazione di O2 nel
sito attivo, prima di legarsi al ferro
Composto P – Non mostra segnali EPR. Dati Raman
evidenziano
frequenze di stretching tipiche di specie perossidiche Dati
Mossabauer
evidenziano la presenza di 2 ioni Fe3+ con l’ossigeno legato in
maniera
simmetrica
Composto Q – Dati Mossbauer indicano la presenza di 2 ioni
Fe(IV) antiferromagneticamente accoppiati. In assenza di
substrato si forma più rapidamente di quanto decada.
Composto R – E’ un intermedio a vita breve che deriva
dall’astrazione di un atomo di H dal substrato, formando la
specie radicalica del substrato
Composto T – E’ l’addotto terminale enzima-prodotto. Il
rilascio del prodotto è il passaggio limitante la velocità di
reazione.
In assenza di substrato Q si forma più rapidamente di quanto decada
Intermedi del ciclo catalitico
Ciclo catalitico della MMO
E. G. Kovaleva, M.B. Neibergall, S. Chakrabarty, J. D. Lipscomb Acc. Chem. Res. 40:475-483, 2007
Proposed structures of
sMMO P and Q from
spectroscopic studies.
The precise structures of
these compounds have not
been definitively established
(Tinberg & Lippard, 2011).
Altre monoossigenasi con un cluster
binucleare a ferro
Toluene monoossigenasi
T2MO (
o-cresolo) Isolata da Burkholderia cepacia
E’ costituita da 3 componenti
• Idrossilasi ()2 PM 211000
• Riduttasi (FAD + Fe2S2) PM 40000
• Componente B PM 10400
L’idrossilasi contiene un centro binucleare Fe-Fe
T3MO (
m-cresolo)
E’ stato identificato il gene, ma non è stato isolato l’enzima
T4MO (
p-cresolo) Isolata da P. mendocina e espressa in E. coli
E’ costituita da 4 componenti
• Idrossilasi ()2 PM 220000
• Ferredossina [Fe2S2)R PM 36000
• Riduttasi (FAD + Fe2S2) PM 36000
OH
• Componente B PM 11600
L’idrossilasi nello stato ossidato ha un centro
Fe
Altri sistemi contenenti centri metallici binucleri (Fe)
Fenolo Idrossilasi
Xilene monoossigenasi
Alcano idrossilasi
Fe
pMMO
E’ costituita da 3 tipi di subunità
pmoB ( 47000 Da)
pmoA ( 24000 Da)
pmoC ( 22000 Da)
La composizione in metalli è stata oggetto di un lungo
dibattito:
Riportati 2-15 Cu per complesso (3-4 sulla base della
struttura del 2005)
0-2 Fe (0 sulla base della struttura del 2005)
2 ioni Cu in un sito binucleare, più eventualmente un
terzo ione di tipo II, sulla base di studi spettroscopici e
di biologia molecolare (2010, probabilmente conclusivo)
Rame proteine
Type I Cu
OH2
Cu
His
His
Type II Cu
His
Type III Cu
Uncoupled
Coupled
CuA
Struttura di pMMM da Methylococcus capsulatus
Le subunità sono organizzate in un trimero 333 che forma una
struttura di tipo cilindrico
Zona solubile
Eliche transmembrana
La parte solubile dell’apertura al centro del trimero si affacciano residui idrofilici come Glu,
Asp e Lys, che stabilizzano il trimero.
Struttura e subunità della pMMO
Subunità C
Contiene 5 elicvhe TM
Orientate parallelamente,
di circa 29 residui ciascuna
Subunità B
Comprende 2 strutture a barrel, una all’estremità N e una C
terminale, nella parte solubile della proteine. I 2 barrel sono
separati da 2 eliche TM. La subunità B contiene un centro
binucleare a Cu nell’estremità N-terminale.
Subunità A.
Prevalentemente TM.
Consiste di 7 eliche che
Interagiscono con quelle
della subunità B.
Una corta elica esce
dalla membrana e
interagisce con la parte
solubile della subunità B.
Lieberman, R.L., Rosenzweig, A.C.
(2005) Nature 434: 177-182
Sito di Zn, proposto
legare due ioni Fe in vivo
Proposto sito di legame per
cluster di rame trinucleare
Confronto tra le subunità B di pMMO (magenta) e la subunità II
della citocromo C ossidasi (verde) da P. denitrificans
I centri metallici
Altri possibili siti di binding dei metalli:
Siti avventizi
Met 42, Asp 47, Asp 49, Glu 100 della subunità pmoA e Glu 154 della subunità pmoC
Dimostrazione che il sito dinucleare è quello attivo (I)
L’enzima as-isolated e demetallato torna attivo con tre equivalenti di rame
Epossidazione del propilene
Monoossigenazione del metano
Balasubramanian, …, Rosenzweig
(2010) Nature 465: 115-119
Dimostrazione che il sito dinucleare è quello attivo (II)
Il dominio solubile della
subunità è attivo. La
mutazione di un
aminoacido che lega il
rame mononucleare
riduce ma non elimina
l’attività
Epossidazione del propilene
Monoossigenazione del metano
Il meccanismo è ignoto
Dx: intermedio di reazione (l’ossidante) proposto
su considerazioni teoriche: Cu(II)Cu(III)((O)2)
Oppure più semplicemente Cu(II)Cu(II)(-(O))
Citocromo P450
E’ un enzima le cui varianti sono presenti in mammiferi, piante,
batteri, lieviti, insetti, ecc. Un singolo organismo può conterne
molteplici varianti
Ruolo:
- idrossilazione di substrati endogeni (acidi grassi, aminoacidi,
ormoni)
- idrossilazione di sostanze xenobiotiche
H3C
H3C
H
CH3
CH3
OH
CH3
H3C
CH3
H3C
P450
H
O2
CH2
CH2
HO
HO
COLECALCIFEROLO VIT D3
OH
1,2,5-DIIDROSSICOLECALCIFEROLO
HO
NH2 P
450
NH2
O2
- NAFTILAMMINA
IDROSSI- - AMMINONAFTALENE
(carcinogeno)
Enzima di membrana (più raramente solubile, es: P450 cam)
Reazioni
catalizzate
M. Sono, M.P.
Roach, E.D. Coulter
and J.H. Dawson,
Heme-containing
oxygenases, Chem.
Rev. 96 (1996), pp.
2841–2888
Struttura a raggi X
P450 cam 414 AA, PM 45000
Eme in intorno idrofobico senza nessuna esposizione all’esterno. La regione in nero (a dx) mostra le
zone coinvolte nel riconoscimento del substrato.
G. Denisov, T.M. Makris, S.G. Sligar and I. Schlichting, Structure and chemistry of cytochrome P450, Chem. Rev. 105 (2005), pp. 2253–2277
Cit P450: classi
RH + O2 + NAD(P)H + H+
ROH + H2O + NAD(P)+
All known P450s are multi-centre enzymes consisting of a heme, or P450, component with associated
reductase components. Mitochondrial and most bacterial P450s are three component systems, comprising
a P450, a ferredoxin and a NADH-dependent, FAD-containing ferredoxin reductase (class I).
The microsomal P450s (class II), are two component systems, both membrane bound, with a
NADPH-dependent diflavin reductase (FAD and FMN) and P450. Class III P450s, such as P450 BM3
from Bacillus megaterium, contain the same cofactors as the class II P450s but are soluble and fused into
one continuous polypeptide. Class IV P450s, contained in Rhodococcus, are also soluble, one
component enzymes but contain an NADPH-dependent, FMN-containing reductase and ferredoxin fused
to the heme domain. A schematic of these classes is shown below.
Batterico e
mitocondriale, ma
nei mitocondri
solo la
ferredossina è
solubile, le altre
due proteine sono
legate alla
membrana interna
Citocromi P450 di mammiferi coinvolti nella degradazione di composti xenobiotici
Il tamoxifen è un
farmaco impiegato
nella cura e
prevenzione del tumore
del seno
I principi realmente
attivi sono alcuni suoi
derivati metabolici,
prodotti in seguito
all’azione di diversi
isoenzimi del citocromo
P450
Valori di logP per alcuni substrati dei citocromi P450
P450 cam (P. putida)
414 AA, PM 45000
Eme posto tra 2 eliche. Assenza di legami covalenti con la
proteina
Cys-S
N
Fe III N
RH, e-
Cys-S
N
Fe II N
H2O
Low spin
(Resting state)
S=1/2
High spin
(Lega O2, CO)
S=2
Interazione con il substrato
Il legame con la canfora è accompagnato dall’allontanamento
di alcune molecole di acqua dalla cavità dove si posiziona la canfora
La cavità per il substrato è formata da aminoacidi idrofobici.
Fa eccezione la Tyr-96 che forma legame a H con CO in posizione 2 della canfora.
Il substrato viene stabilizzato per effetto di interazioni idrofobiche
(8-CH3, 9-CH3 e Val-295)
Analogie nella sequenza dei citocromi P450:
-regione comprendente Cys assiale
-regione comprendente Thr (252 per P450 cam) che interagisce
con O2 nel complesso P450-O2.
Meccanismo di reazione
L.S. E°=-330mV
H.S. E°=-170mV. L’aumento
del potenziale cresce col
crescere dell’affinità fra la
tasca e il substrato
from putidaredoxin
(Fe(II)-O2)
Struttura cristallografica di 4
Rottura eterolitica del gruppo
perossidico
III
Fe
O
OH
III
“0”
Fe
O
IV
Un elettrone è donato dalla
Fe
porfirina, che prende carica +1
O
2-
+ OH-
Ciclo veloce e disaccoppiamento tra trasferimento di e- e di
ossigeno
Ciclo veloce
Alcuni donatori di atomi di ossigeno come perossidi, peracidi, NaIO3, NaClO2, possono
sostituire i 2 e- e l’O2 richiesti per il ciclo normale e generare direttamente, l’intermedio (6).
O
N
N
Fe
N
IV
N
S-Cys
+
Alcuni citocromi P450 possono utilizzare direttamente H2O2 e formare l’intermedio (5b).
OH
O
N
N
FeIII
N
S-Cys
N
Disaccoppiamento tra trasferimento di e- e di ossigeno
E’ possibile avere trasferimento elettronico senza trasferimento
OH
di ossigeno al substrato per protonazione di (5b)
O
N
O
N
o per protonazione di (6)
Fe
N
N
IV
N
S-Cys
III
Fe
N
S-Cys
2 H+, 2 e-
N
N
N
N
H+
H2O2 N
H2O
N
Fe
Cys-S
III
Rottura del legame O-O
La specie reattiva osso-ferrile viene ottenuta per riduzione del complesso
superossido-Fe(III) seguita da doppia protonazione dell’atomo esterno per
ottenere Fe(III)-OH2 e poi indurre la rottura eleterolitica del legame O-O.
Condizioni per la rottura eterolitica
Effetto di spinta da parte del legante Cys
Il carattere di forte elettron donatore della Cys coordinata al ferro in posizione
assiale facilita la rottura del legame O-O.
Quando il legame O-O è eteroliticamente rotto, il legante assiale, elettron donatore,
stabilizza l’elevato numero di ossidazione della specie osso-ferrile
IV
Fe
O
Meccanismo push-pull
Meccanismi push-pull per la rottura del legame O-O di un ferro-perossido nel caso
di un sistema con un gruppo tiolato (P450) e con un gruppo istidinato (perossidasi)
Rilascio di protoni da parte
dei gruppi in posizione distale
251
252
E’ necessaria una “sorgente” di protoni per permettere all’ossigeno esterno del perossido di
allontanarsi come acqua.
Due aminoacidi, Thr 252 e Asp 251, sono coinvolti nel processo, formando una rete di rilascio
di protoni. Insieme a 2 residui carichi (Arg e Lys) consentono il trasferimento di protoni dal
solvente, in superficie, al sito attivo.
Intermedio reattivo
.+
IV
(P )Fe
O
L’intermedio è una specie altamente elettrofila.
Preferenzialmente reagisce con atomi di C elettron ricchi (C-terziari
-secondari -primari)
Trasferisce un atomo di ossigeno neutro al substrato
.
(P +)
IV
Fe
O
+ RH
Altre formule risonanti per l’intermedio
III
Fe(P) + ROH
Applicazioni biotecnologiche
Produzione di composti complessi
Mutante F87W/Y96F/V247L di P450cam
Bell SG et al., J. Am. Chem. Soc., 125: 705 -714, 2003
Applicazioni biotecnologiche II
Georg Zocher; Martin E. A. Richter; Uwe Mueller; Christian Hertweck; J. Am. Chem. Soc. 2011, 133,
2292-2302.
A serine-substituted P450 catalyzes highly efficient carbene transfer to olefins in vivo
Coelho PS et al., Nature Chemical Biology, 2013
La mutazione del legante assiale rende possibile la riduzione con NADH (i.e.
abolisce il bisogno della riduttasi) e azzera la capacità di effettuare
monossigenazione.
La resa è dell’ordine dei g/litro in E. coli.