Elettroforesi
Un processo mediante il quale molecole cariche
si separano in un campo elettrico a causa della
loro diversa mobilità
m = K c/ M
m= mobilità elettroforetica della molecola
K =costante di proporzionalità che dipende dalla
ddp applicata e dal mezzo in cui viene fatta
l’elettroforesi
M = PM della molecola
Elettroforesi di aa
• Gli aa si frazioneranno durante
l’elettroforesi, se l’elettroforesi viene
effettuata ad un valore di pH al quale gli
aa presenti nella miscela , avranno
differenti valori di carica netta
• Se l’elettroforesi viene fatta ad un pH che
corrisponde al PI dell’aa esso non migra
Elettroforesi di proteine
PI è compreso tra 3-10, la maggioranza ha pI <8
Quindi a PH = 8 o a pH > 8 la maggior parte
delle proteine hanno carica netta – e
migreranno all’anodo ( elettrodo positivo)
Supporto per l’elettroforesi
• Gel di poliacrilammide :
copolimerizzazione di un monomero
(acrilammide) solubile in acqua e di un
agente reticolante Bisacrilammide
( CH2=CH-CO-NH2) acrilammide
Preparazione del gel di
poliacrilammide
I monomeri di acrilammide polimerizzano nel
senso testa-coda, x cui si forma un
polimero lineare.
Occasionalmente i monomeri di
acrilammide si legano alla bis acrilammide
e si firmano legami crociati
Agenti polimerizzanti
• Ammonio persolfato e TEMED
( tetrametilenetilendimina)
APS eTEMED catalizzano la decomposizione dello
ione persolfato con la formazione del
sorrispondente radicale libero
S2O8 2- + e
SO42-+ SO42-
Reazione tra Acrilammide e
Radicale libero
• R. + A
• RA. + A
• RAA. + A
RA.
RAA.
RAAA. E così via
• Catalisi radicalica
• R. = radicale dello ione persolfato
• A= monomero di acrilammide
Come possono essere regolate le
dimensioni dei pori ?
• Variando la quantità di acrilammide usato
• Aumentando la quantità di Bis ( pori più
stretti)
• Proteine più grandi sono ritardate nella
migrazione
• Le più piccole migrano di più
Gel in gradiente
• Gel in cui la percentuale di acrilammide
varia dal basso verso l’alto, così varia la
porosità.
• Per separare proteine con PM molto vicino
SDS -PAGE
• Separare le proteine solo in base al loro
PM
• SDS : ( ogni 2 aa si lega una molecola di
SDS
Stacking gel
• E’ costituito da una piccola percentuale di
acrilammide per assicurare un’alta
porosità
• E’ tamponato con Tris HCl a pH 6,8
Lower gel
Percentuale di acrilammide è più alta
Tris HCL pH 8,8
Tampone di corsa
• Tris a pH 8,3 con Glicina
• Il campione + tampone contenente
colorante( blu di bromofenolo), SDS e beta
mercaptoetanolo viene caricato sullo
stacking gel dopo bollitura
TECNICHE ELETTROFORETICHE
SDS-PAGE
RELAZIONE MOBILITA’
ELETTROFORETICA / MASSA PROTEINA
Elettroforesi in condizioni native
• Consente di separare la proteina in base
alla sua attività biologica
• Non denatura la proteina
• Gel di poliacrilammide 7,5% senza SDS
• pH: 8.7
• Separazione in base alla carica e setaccio
molecolare del gel
Procedura
• Corsa elettroforetica
• Identificazione dell’Enzima di interesse:
• 1-Incubazione del gel in una soluzione
contenente S in grado si fornire un P colorato in
corrispondenza dell’E
• 2-Inclusione di S in un gel di agarosio che viene
fatto polimerizzare sul gel si acrilammide
• Diffusione di E ed S tra i due gel produce bande
colorate dove è presente E
IEF
• separazione in base al differente PI delle
proteine
• Gel orizzontali montati su piastre si vetro o
foglietti di plastica
• separazione su un gel in gradiente di pH
• Anfoline ( miscele di acisi poliamminopolicarbossilici sintetici)
• Gel di poliacrilammide a basse
concentrazioni(4%) o agarosio
• DDP alte 2500Volt x 2-3 ore la corsa è fatta su
piastre refrigerate
Colorazione
• Gel viene lavato in TCA 10%, che fa
precipitare e fissare le proteine ed lava gli
anfoliti
• Colorazione in comassie
• decoloraione
Elettroforesi bidimensionale
• IEF in tubicini di vetro, in presenza di
anfoliti urea 8M ed un detergente non
ionico- Proteine denaturate si separano in
base al loro PI
• il gel è estruso dai tubi e incubato in SDS
in modo che il detergente si leghi alle
proteine denaturate
• Gel posto su SDS-PAGE
Western Blotting
• Identificazione di una proteina di interesse
in una miscela proteica totale
• Estrazione ed isolamento della proteina
Procedura
•
•
•
•
SDS-PAGE
Trasferimento su nitrocellulosa
Incubazione con anticorpi specifici
immunorivelazione
Trasferimento su nitrocellulosa
• Preparazione di un sandwich che contiene
gel e nitrocellulosa
• Sandwich immerso in un tampone di
trasferimento in una camera con elettrodi
• La corrente perpendicolare al gel
trasferisce le proteine dal gel alla
nitrocellulosa
Dopo il trasferimento
• Incubazione del blot con gelatina o latte o
BSA
• Incubazione con anticorpi primari
• Lavaggi
• Incubazione con anticorpi secondari
marcati in vario modo
Anticorpi secondari legati ad un E
• E legato all’anticorpo secondario è
immerso in una soluzione contenente il S
che si trasforma in un P colorato che
precipita sulla proteina riconosciuta
• E : la fosfatasi alcalina o la perossidasi di
rafano
Perossidasi alcalina
• BCIP (incolore)
Prodotto blue
5-bromo-4-cloro-indolofosfato
Perossidasi di rafano
4-cloro-1-naftolo
3-ammino-9-etilcarbazolo
P blue
P marrone
Enhanced chemiluminescence
• Perossidasi in presenza di H2O2 e luminolo,
ossida il luminolo e produce luce, che viene
rivelata su lastra fotografica
Luminolo + H2O2
luminolo ossidato+ fotone
perossidasi
Anticorpi secondari con isotopo
radioattivi
•
125I
Rivelazione per autoradiografia
Anticorpi secondari con
fluoresceina
• Rivelazione: esponendo il blot alla luce UV
Anticorpi secondari marcati con
particelle d’oro
Si colorano in rosso a contatto con Anticorpo
primario
Gel di agarosio
• agarosio: polisaccaride lineare, formato
dalla ripetizione di monomeri di
agarobiosio e di galattosio e 3,6 anidro
galattosio
Gel di agorosio
• Separazione di DNA o frammenti di acido
nucleico in base alle loro dimensioni
Perché si usa l’agarosio?
• DNA e i frammenti analizzati sono + grandi
delle proteine
• Agarosio forma un gel a pori di dimensioni
maggiori della poliacrilammide
Gel di agarosio
• Separa frammenti da 100 basi a 20kb
• Nel campione da separare si aggiunge
etidio di bromuro , colorante che si
intercala tra le basi ed è altamente
fluorescente all’UV
Preparazione del gel di agarosio
• Agarosio 0,3% x separare DNA a doppio
filamento di dimensioni tra 5-60kb
• Agarosio al 2% x separare DNA a doppio
filamento di dimensioni tra tra 0,1-3kb
• Agarosio allo 0,8% x separare molecole
tra 0,5 e 10kb
Procedura
Agarosio è sciolto per bollitura in apposito tampone
Versato su lastra di vetro o plastica circondato da nastro adesivo o da una vaschetta di plastica
in modo che lo spessore sia di 3mm
Pettine x pozzetti immerso nell’agarosio ancora liquido
Pettine tolto quando l’agarosio è solidificato
Gel immerso nella cameretta elettroforetica ricoperto di tampone
Campioni sciolti in tampone (saccarosio e gliceroloe blu di bromofenolo) caricati nei pozzetti
Corsa elettroforetica ON 1,5V/cm
Colorazione
• Gel immerso in una soluzione di etidio
bromuro (0,5mg/ml), che si lega tra le
coppie basi di DNA
• Dove ci sono frammenti di DNA il bromuro
di etidio si concentra
• All’UV il bromuro di etidio rende
fluorescente il DNA, producendo una luce
rosso-arancio
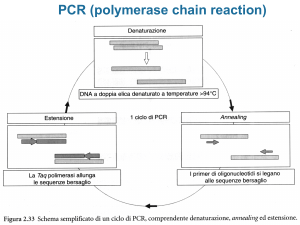
L’elettroforesi su gel di agarosio
L’elettroforesi su gel è
una tecnica utilizzata per
separare frammenti di
DNA in funzione delle
loro diverse dimensioni.
RAPD (Random Amplified Polymorphic DNA)
• Estrazione e
purificazione del
DNA
• Elettroforesi su gel di
agarosio con
bromuro di etidio
• Osservazione del gel
ai raggi UV
Recupero del DNA dal gel: uso preparativo
del gel di agarosio
• Bande vengono tagliate dal gel, e
recuperate x elettroeluizione
• Bande sminuzzate e in tampone e
centrifugate, nel surnatante si recupera il
DNA
Elettroeluizione
• Bande poste in tubo da dialisi con
tampone
• Tubo posto in una camera orizzontale con
una maggiore quantità di tampone tra i
due elettrodi
• Passaggio corrente stacca il DNA dal gel
• rRecupero del DNA nel tampone del tubo
da dialisi
Isolameto dei frammenti di DNA x
elettroeluzione
• Dopo elettroforesi la banda corrispondente
al frammento che ci interessa viene
rimosa dal gel
• Banda messa in un sacchetto da dialisi e
immersa in una soluzione ad alto sale
• Recupero della banda
Southern Blotting
• Identificazione di un pezzo di DNA che
vogliamo riconoscere
Trasferimento del DNA dal gel alla
nitrocellulosa
Nitrocellulosa incubata con DNA radioattivo,
cDNA come sonda che riconosce e lega la
banda di DNA
Autoradiogarfia
Schema
trasferimento e
ibridazione