I liquidi e loro proprietà
Stati di aggregazione e forze
intermolecolari
Le interazioni intermolecolari determinano le
proprietà fisiche della materia, come:
- lo stato di aggregazione (solido, liquido e gas)
- Il punto di fusione
- Il punto di ebollizione
I Liquidi e loro caratteristiche
• non possiedono una propria forma
• non sono comprimibili e hanno quindi un volume
proprio
• L’energia cinetica e l’energia potenziale sono
paragonabili tra di loro (Ecinet ~ Epotenz)
• Le caratteristiche peculiiari dei liquidi sono:
viscosità/fluidità; tensione superficiale e tensione
di vapore
Viscosità e fluidità
La viscosità: rappresenta la resistenza opposta da un liquido allo
scorrimento, come conseguenza della presenza di forze di
coesione intermolecolari. Esse dipendono dalle simmetrie
simmetrie strutturali e dalle dimensioni delle molecole che
compongono il fluido:
Liquidi composti da molecole piccole ed asimmetriche sono
poco viscosi
Liquidi composti da molecole grandi ed simmetriche sono molto
viscosi
La fluidità: rappresenta la capacità delle particelle di scorrere le
une sulle altre sotto l’azione di forze esterne
Tensione superficiale
La tensione superficiale è una proprietà dei fluidi che opera lungo la
superficie di separazione (interfaccia) tra il fluido stesso ed un
materiale di un'altra natura, ad esempio un solido, un liquido o un
gas. Dal punto di vista termodinamico può essere definita come il
lavoro per unità di area richiesto per formare una nuova superficie.
Forte forza
intermolecolare
Alta tensione
superficiale
Proprietà dei Liquidi
Le azioni attrattive tra le molecole di un liquido (le forze di coesione)
fanno sì che le molecole dello strato superficiale siano soggette ad una
forza risultante non nulla che tende a farle spostare verso l'interno; esse
pertanto tendono a sfuggire dalla superficie limite del liquido e di
conseguenza questa tende ad assumere l’estensione minima possibile
(in assenza di altre forze, la superficie minima, è quella sferica).
Coesione
Proprietà dei Liquidi
non è più sufficiente considerare le sole forze di coesione, in quanto
la presenza di un altro corpo ha influenza sui valori della tensione,
nel senso che le molecole di questo svolgono anch'esse delle azioni
(le forze di adesione) sulle molecole dello strato superficiale del
liquido.
Adesione
Vapore
frazione di molecole
Tensione di vapore
Hevap.
energia delle molecole sulla superficie
Liquido
L’evaporazione è un
fenomeno che avviene sulla
superficie di separazione.
Osservazione
Il numero di particelle che dal liquido tendono a passare alla fase
gassosa dipende anche dal numero delle particelle presenti nell’unità
di volume
Temperature
di Ebollizione ad 1 atm
LO STATO SOLIDO
Caratteristiche e proprietà dei solidi:
Incompressibilità
Elevato
grado di ordine e rigidità
Forma definita
Alta energia potenziale, bassa
energia cinetica
11
Solidi
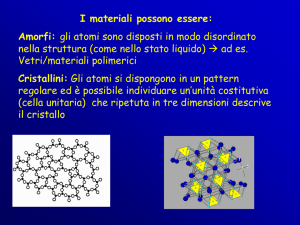
Solidi cristallini
particelle disposte
regolarmente nello spazio
isotropia
punto di fusione ben
definito
Solidi amorfi
Disposizione disordinata delle
particelle
anisotropia
punto di fusione non ben
definito
I solidi amorfi sono in realtà
dei liquidi ad elevata viscosità
12
CLASSIFICAZIONE DEI SOLIDI CRISTALLINI
IN BASE AL TIPO DI LEGAME
- Solidi ionici
- Solidi covalenti
molecolari
- Solidi covalenti
macromolecolari
- Solidi metallici
13
I solidi sono quindi corpi rigidi in cui le particelle che
li costituiscono occupano posizioni stabili e regolari che
costituiscono i nodi del reticolo cristallino
Cella elementare: è la più piccola unità ripetitiva di una
struttura cristallina in 3D che mostra l’intera simmetria della
struttura”
La cella elementare
è una scatola con:
• 3 lati - a, b, c
• 3 angoli - , ,
14
Celle
elementari
Sette forme di celle elementari
•
•
•
•
•
•
•
Cubica
Tetragonale
Ortorombica
Monoclinica
Triclinica
Esagonale
Romboedrica
a=b=c
a=bc
abc
abc
abc
a=bc
a=b=c
===90°
===90°
===90°
==90°, 90°
90°
==90°, =120°
==90°
15
Celle
Cubiche
16
Caratteristiche dei solidi ionici
Nel reticolo cristallino dei solidi ionici si alternano, con regolarità, ioni
positivi e negativi
Esempi: Cloruro di sodio
•
Temperatura di fusione relativamente alta dovuta al
legame ionico forte
•
Fragilità alla trazione
•
Sfaldamento diagonale rispetto ai piani reticolari: i
piani diagonali contenenti tutti atomi con carica dello
stesso segno.
•
Solubili in acqua
•
Allo stato fuso ed in soluzione acquosa conducono la
corrente elettrica: deriva dalla presenza degli ioni
liberi quando il reticolo viene demolito.
17
Caratteristiche dei solidi covalenti
molecolari
Nei nodi del reticolo cristallino dei solidi molecolari sono
presenti molecole legate con deboli legami intermolecolari
Esempi: ghiaccio,CO2 solida, iodio
• Temperatura di fusione bassa
• Scarsa durezza
• Alta tensione di vapore
• Non conducono corrente
elettrica in quanto sono
costituiti da molecole neutre
18
Caratteristiche dei solidi covalenti
macromolecolari
Nei nodi del reticolo cristallino dei solidi covalenti sono presenti
gli atomi legati con legame covalente
• Temperatura di fusione molto
alta
• In generale grande durezza
• Isolanti o semiconduttori
• Insolubili in acqua
Gli elementi che tendono a
formare questi solidi sono quelli
che appartengono al IV gruppo:
Si, C.
19
20
Cella elementare del diamante
(sistema cubico)
dC-C = 154 pm
d (diamante) = 3.52 g/cm3
20
21
Struttura della grafite
(sistema esagonale)
340 pm
dC-C = 142 pm
d (grafite) = 2.25 g/cm3
21
22
22
23
Fullereni
I fullereni sono strutturalmente simili alla grafite, la quale
si costituisce di anelli esagonali collegati tra loro su un
piano, ma si differenziano per alcuni anelli di forma
pentagonale (o a volte ettagonale) che impediscono una
struttura planare
C60
24
Grafene e Nanotubi
Grafene
costituito da uno strato
monoatomico di atomi di carbonio
(avente cioè uno spessore
equivalente alle dimensioni di un
solo atomo).
Nanotubo
formato da soli esagoni, mentre le
strutture di chiusura sono formate
da esagoni e pentagoni,
esattamente come i fullereni
24
Solidi metallici e legame metallico
Nei nodi del reticolo cristallino dei solidi metallici
sono presenti ioni positivi legati da legame metallico.
Il reticolo è avvolto dalla nuvola elettronica
Legame metallico
I Metalli trattengono gli elettroni nella loro sfera di
valenza molto debolmente. Di conseguenza gli elettroni
sono liberi di muoversi nel solido
Sono ioni positivi (cationi) fluttuanti in un mare di
elettroni.
Metalli conducono elettrcità.
+
+
+
+
+
+
Esempi: sodio, ferro, rame
+
+
+
+
+
+
25
…a livello atomico…
• Nella struttura cristallina dei metalli, gli elettroni +
esterni sono meno legati al nucleo, e il moto di
agitazione termica fornisce loro energia sufficiente
per staccarsi dall’atomo e muoversi liberamente nel
reticolo cristallino
• Gli atomi sono quindi ioni, tra i quali vagano in
modo disordinato gli elettroni, come un gas, che
viene quindi chiamato mare di Fermi
26
Proprietà dei solidi metallici
•
•
•
•
•
Temperatura di fusione generalmente alta
Elevata densità
Buona conducibilità termica ed elettrica
Lucentezza al taglio
Elevata malleabilità e duttilità (vengono facilmente ridotti
in lamine e fili metallici)
Tutte queste proprietà possono essere spiegate in termini
di mobilità degli elettroni di valenza
27
La
malleabilità e duttilità si deve alla struttura del reticolo
cristallino dei metalli; tirando o piegando il reticolo infatti le forze
che legano i vari ioni e la nuvola che li avvolge rimangono
invariate.
+
Forza
+
+
+
+
+
+
+
+
+
+
+
Le
alte temperature di fusione sono una conseguenza della forza
del legame metallico che rende il reticolo difficile da rompere.
28
I conduttori metallici
• I metalli sono ottimi conduttori di elettricità poiché al
loro interno vi sono moltissimi elettroni liberi di
muoversi
• Quando sono sottoposti ad un campo elettrico essi si
muovono verso i punti a potenziale + alto generando
una corrente elettrica
• Gli elettroni liberi del metallo si chiamano elettroni di
conduzione
29